Traitement du cancer du rein métastatique

Traitement du cancer du rein métastatique.
Bernard Escudier.
Introduction
Le cancer du rein représente 2 à 3% des tumeurs malignes de l’adulte ce qui correspond en
France à près de 10000 cas. Dans 70 à 80% des cas, il s’agit d’une tumeur à cellules claires,
plus rarement d’une tumeur papillaire (10 à 20%) ou d’une tumeur chromophobe (5%). Un
tiers des patients est diagnostiqué d’emblée au stade métastatique, et, parmi les patients
présentant une forme localisée, environ 30% vont développer des métastases.
Les armes thérapeutiques sont limitées puisque le cancer du rein métastatique est
chimiorésistant avec des taux de réponse inférieurs à 10% dans la plupart des études publiées.
Jusqu’à 2005, le standard de traitement était l’immunothérapie avec l’utilisation de 2
cytokines l’interféron α (IFNα) et l’interleukine 2 (IL-2). La survie globale médiane est alors
de 8 à 10 mois et le taux de survie à 5 ans inférieur à 10%.
Depuis 2006, l’intérêt des thérapies moléculaires ciblées (antiangiogénique ou inhibiteurs des
tyrosine kinases) a été démontré modifiant les stratégies thérapeutiques et posant de nouvelles
questions.
Les cytokines
En première ligne métastatique, l’IFNα a conduit à des taux de réponse globale de 10 à 15%
dont 2 à 5% de réponses complètes. La survie globale a été prolongée de 3 à 7 mois par
rapport à un placebo dans différents essais. L’ajout de l’IL2 augmente les taux de réponse
globale au prix d’une toxicité plus importante mais sans répercussion significative sur la
survie globale. Par ailleurs, aucune étude n’a montré la supériorité del’IL2 intraveineuse par
rapport à la forme injectée en sous-cutanée. Chez les patients de pronostic intermédiaire,

l’utilisation des cytokines en mono ou en bithérapie n’a pas montré de supériorité en terme de
survie par rapport à l’utilisation de progestatifs (medroxyprogesterone).
Il est actuellement recommandé d’utiliser les cytokines en première ligne uniquement chez les
patients dits de bon pronostic (bon état général, un seul site métastatique) car il existe une
possibilité d’obtenir une rémission complète. L’association avec le bevacizumab est dans
cette situation une bonne option thérapeutique.
La place de la néphrectomie
Deux études ont montré l’intérêt de la néphrectomie chez les patients métastatiques traités par
la suite par immunothérapie. Un bénéfice en survie de 5 à 10 mois a été observé chez des
patients par ailleurs en bon état général. Le rôle de la néphrectomie par rapport aux thérapies
ciblées n’est pas encore connu. Un essai, en cours en France (essai Carmena), teste le rôle de
la nephrectomie chez des patients traités par Sutent.
Actuellement, on considère que :
La nephrectomie est le standard chez les patients en bon état général, avec une tumeur
primitive volumineuse
La nephrectomie ne doit pas être pratiquée chez les patients métastatiques en mauvais
état général
Dans les autres cas, il n’y a pas de consensus
La néoangiogénèse
Le cancer du rein à cellules claires est une tumeur réputée hypervascularisée avec une
angiogénèse importante. Une des mutations précoces identifiées dans son développement
concerne le gène von Hippel-Lindau (VHL). Elle est retrouvée dans 60 à 80% des formes
sporadiques. Quand le gène VHL est muté, il existe une accumulation de HIF-1α ce qui

entraîne une surexpression de plusieurs gènes impliqués dans l’angiogénèse et la prolifération
cellulaire comme en situation d’hypoxie ; ces gènes sont le vascular endothelial growth factor
(VEGF), le platelet-derived growth factor (PDGF) ou encore le transforming growth factor
(TGF α). Le VEGF qui se lie à un des différents isomères du récepteur au VEGF et est
l’élément clé de l’angiogénèse en induisant la migration des cellules endothéliales, leur
prolifération et leur survie. Le PDGF favorise l’angiogénèse par son action sur les péricytes.
Le TGF α qui se lie au récepteur de l’épidermal growth factor (EGF-R) favorise la
prolifération, la survie, la différenciation et la migration cellulaires. Les voies de transduction
du signal liées à ces récepteurs sont la voie PI3kinase/AKT et la voie raf/MAPkinase qui
jouent un rôle dans la régulation de la prolifération cellulaire, de l’apoptose ou de
l’angiogénèse. De ce fait, des thérapeutiques, ciblant la voie VHL-HIF-VEGF, ont été
développées, avec deux grandes familles de médicaments, les anti VEGF et les inhibiteurs de
mTOR.
Les thérapies ciblées
Le bévacizumab
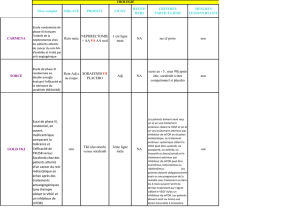
Cette molécule est un anticorps monoclonal humanisé qui agit sur le VEGF. Sa fixation sur le
ligand circulant empêche l’activation du VEGF-R. C’est la première thérapie ciblée qui a
montré un intérêt dans le cancer du rein métastatique. Dans un essai de phase II randomisée,
le bévacizumab à la dose de 10 mg/kg (voie intraveineuse) apporte un bénéfice de survie sans
progression de 2,3 mois chez des patients prétraités par rapport à un placebo (cf tableau n°1).
10% de réponses partielles sont observées. Les principales toxicités sont l’HTA, l’épistaxis,
les hématuries et les protéinuries.

Deux études de phase III comparant l’association Bevacizumab et interferon à l’interferon
avec un placebo ont confirmé l’efficacité du bevacizumab. Dans l’étude européenne, la survie
sans progression est de 10,2 versus 5,4 mois en rajoutant le bevacizumab, et le taux de
réponse passe de 13 à 31%. Les résultats finaux montrent une amélioration de la survie
globale, non significative, sans doute largement expliquée par les traitements ultérieurs reçus
par les patients.
Le sorafénib
Cette molécule est un inhibiteur de tyrosine kinase administré par voie orale, en continu, à la
dose de 400 mg x2/jour. Il agit sur le VEGF-R 2 et 3, sur cKit, sur PDGF-Rβ modulant ainsi
l’angiogénèse, la prolifération cellulaire et l’apoptose.
Dans une grande étude de phase II, chez 202 patients traités en deuxième ligne pendant 12
semaines, il existe 36% de réponse globale et 34% de stabilisation. La survie sans progression
médiane est de 24 semaines chez les patients traités par sorafénib contre 6 semaines avec le
placebo (p=0,0087).
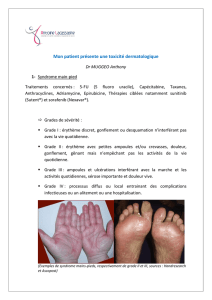
Les principales toxicités sont l’asthénie (73%) dont 7% de grade 3-4, le syndrome mains-
pieds (62%) dont 13% de grade 3, le rash cutané (66%) et la diarrhée (58%) dont 4% de grade
33,1% des patients ont eu une HTA de grade 3 traités par des antihypertenseurs classiques.
Une phase III (sorafénib contre placebo) a été présentée chez 905 patients confirmant un
avantage en survie sans progression de 12 semaines en deuxième ligne avec des toxicités
proches de celles décrites dans la phase II (cf tableau n°1). Actuellement, cette molécule a
l’AMM en deuxième ligne métastatique, après échec de cytokines. Son utilité en première
ligne de traitement est possible, notamment au vu de récentes études de phase III.

Le sunitinib
Il s’agit d’un inhibiteur de tyrosine kinases multicible (VEGF-R 1 et 2, PDGF-R α et β, cKit,
Flt3) qui est administré par voie orale à la dose de 50 mg/jour 4 semaines sur 6. Plusieurs
phases II ont montré une survie sans progression médiane de 8,3 à 8,7 mois avec des taux de
réponse de l’ordre de 34 à 40% et presque 30% de stabilisations (cf tableau n°1).
Les principales toxicités sont l’asthénie (38% de grade 2-3), les diarrhées (24% de grade 2-3),
les nausées (19% de grade 2-3), des lymphopénies, des neutropénies et des anémies de grade
3-4 sont retrouvées dans 32, 13 et 10%. La survenue d’une hypothyroidioe biologique est
fréquente (>50%), et près de la moitié des patients nécessitent une thérapeutique substitutive.
Une étude de phase III comparant chez 750 patients l’IFNα au sunitinib en première ligne
métastatique a montré un avantage en survie sans progression de 23 semaines et 6 fois plus de
réponses partielles (cf tableau n°2). Le sunitinib a reçu l’AMM en Juillet 2006. Le bénéfice en
survie globale est démontré lors de l’analyse finale (26 vs 21 mois).
Le temsirolimus
Il s’agit d’un inhibiteur de mTor agissant sur la voie PI3kinase-AKT. Quand mTor est activé,
il existe une activation d’HIF (« hypoxia-inducible factor ») et donc de l’angiogénèse . Une
étude de phase III menée chez 626 patients de mauvais pronostic, en première ligne
métastatique, comparant le temsirolimus (à 25 mg IV par semaine) à l’IFNα a montré un
doublement de la survie sans progression avec le CCI-779 et une augmentation de 49% de la
survie globale. Les toxicités de grade 3-4 les plus fréquentes sont l’asthénie, l’anémie et la
dyspnée. Le temsirolimus a reçu son AMM en novembre 2007.
L’everolimus
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%