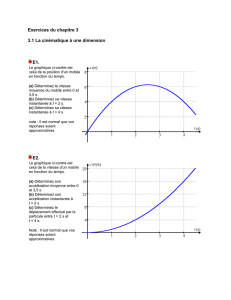
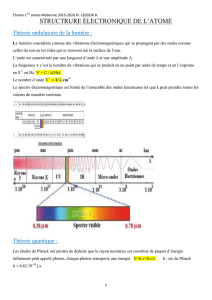
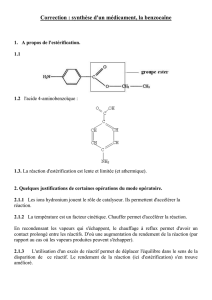
Problèmes supplémentaires

Éléments de chimie organique
Problèmes d’analyse organique
1. La constante molale de l'abaissement du point de fusion du camphre est 40°C.kg/mol et le
camphre pur fond à 179°C. Lorsque 0,108g du composé A est dissout dans 0,90g de camphre, la
solution se liquéfie à 166°C. Déterminez la masse molaire du composé A.
(rep: 369 g/mol)
2. La combustion complète de 0,858g d'un composé X produit 2,63g de CO2 et 1,28g d'eau.
a) Sachant que le spectre ir du composé n'indique aucune bande entre 1650 et 1750 cm
-1 et entre
3500 et 3650 cm
-1, déterminez la formule empirique du composé.
b) Déterminez la formule moléculaire du composé pour lequel la masse molaire sera la plus
faible.
(rep: C3H7 ; C6H14)
3. L'analyse d'un composé organique révèle les résultats suivants: 92,25% C, 7,743% H. Sa
masse molaire a été déterminée par sepctroscopie de masse et est égale à 78,11 g/mol.
a) Quelle est la formule moléculaire du composé?
b) Combien y a-t-il de liaisons π dans ce composé?
(rep: C6H6 ; 4 si linéaire, 3 si cyclique)
4. L'analyse d'un composé liquide révèle 92,3% C et 7,7% H. La vaporisation de 0,2g de ce
dernier à 99°C sous une pression de 98,63 kPa dégage un volume de 80,5 mL de vapeur.
Déterminez la formule moléculaire du composé liquide.
(rep: C6H6)
5. L'analyse d'un composé donne 51,7% C et 6,9% H. Le spectre ir du composé indique une
bande d'absorption entre 2500 et 3000 cm
-1, entre 1720 et 1740 cm
-1 et entre 1700 et 1725 cm-1.
Une étude qualitative ne révèle aucune liaison double ou triple entre deux atomes de carbone. De
plus, lorsque 3.,0g de ce composé sont dissous dans 80g de benzène, le point de congélation est
abaissé de 1,7°C. La constante molale de l'abaissement du point de fusion du benzène est
5,10°C.kg/mol. Déterminez la formule moléculaire du composé et sugérez une formule
structurale développée pour le représenter.
(rep: C5H8O3; le composé présente la fonction acide carboxylique et la fonction aldéhyde)
6. Lanalyse élémentaire de 50 mg d'un composé qui contient C, H et O produit 119 mg de CO2 et
61 mg d'eau. Sa densité de vapeur par rapport à l'air est 2,55. Le spectre ir présente une bande
d'absorption à environ 3600 cm
-1. Déterminez la formule moléculaire du composé et proposez
toutes les formules structurales développées possibles pour ce composé.
(rep: C4H10O; fonction alcool présente)
7. L'analyse de la substance active extraite de la mouche d'Espagne (la cantharidine) révèle
61,2% C, 6,2% H et la présence d'oxygène. La MM déterminée par cryoscopie est 201±20 g/mol.
Déterminez la formule moléculaire du composé.
(rep: C10H12
O4)

Éléments de chimie organique
Problèmes d’analyse organique
8. La combustion de 100 mg de l'extrait actif, le DEET, d’un produit répulsif à moustiques qui
contient C, H, N et O libère 276,28 mg de CO2 et 80,64 mg d'eau (H2O). Le volume de d’azote
(N2) obtenu à TPN est de 5,856 mL. La masse molaire de ce composé a été déterminée par
spectroscopie de masse et est égale à 191,27 g/mol.
Le spectre ultraviolet du composé indique une bande d’absorption à 255 nm et une autre à 280
nm. Le spectre infrarouge montre clairement une bande intense entre 1650 et 1695 cm-1 et une
autre entre 1450 et 1600 cm-1. On observe une bande d’absorption de faible intensité ayant
l’aspect d’une bosse sur ce spectre entre 3200 et 3500 cm-1. Déterminez en démontrant
clairement votre cheminement: la formule empirique du composé, la formule moléculaire du
composé, une formule structurale développée du composé (justifiez).
9. La N-éthylamphétamine est une amphétamine aromatique (hydrocarbure aromatique aminé
monosubstitué) qui est utilisée pour le traitement de l'anorexie. La combustion de 100 mg de ce
stimulant libère 296,93 mg de CO2, 9,39 mg d'eau (H2O) et 6,88 mL de N2 (g) à TPN. Nous
savons que le composé contient 8,59% d'azote. La masse molaire de ce composé a été
déterminée par spectroscopie de masse et est égale à 163 g/mol. L'analyse qualitative du
composé indique la présence d'un cycle aromatique (hydrocarbure benzénique) et d'azote.
Le spectre infrarouge montre clairement une bande de faible intensité entre 3200 et 3600 cm-1.
De plus, un seul petit pic pointu apparaît au centre de cette bande. Nous n'observons aucune
bande d'absorption entre 1650 et 1800 cm-1. Déterminez en démontrant clairement votre
cheminement: la formule empirique du composé, la formule moléculaire du composé, une
formule structurale développée du composé (justifiez).
10. L’éthanolamine (HO-CH2-CH2-NH2) est un agent que l’on retrouve dans différents produits
courants tels : gel de mise en pli pour cheveux, lotions… . On peut le produire par la réaction
entre le nitrométhane (CH3-NO2) et le formaldéhyde (CH2O). Le mélange réactionnel contient
les trois substances énumérées précédemment. Connaissant les propriétés suivantes, suggérez
une méthode qui permettra de purifier l’éthanolamine. Expliquez clairement le principe de la
méthode et déterminez en justifiant ce qui va se passer.
Propriétés
Éthanolamine
Nitrométhane
Formaldéhyde (aq)
Tfusion (°C) 10,3 -29,0 0
Tébullition (°C)
170,8
101,2
96,0
Solubilité dans
1. eau
2. alcool (CH3CH2OH)
3. CCl4
1+2 et 2+3 : miscible
1+3 : non miscible
Soluble
Soluble
Peu soluble
Peu soluble
Soluble
Soluble
Soluble
Soluble
Peu soluble
1
/
2
100%