23/10/14 FOUCHERE Elise L2 CR : BRASSIER Julia TSSI

TISSU SANGUIN ET SYSTEME IMMUNITAIRE
Dynamique de la Réponse Innée
23/10/14
FOUCHERE Elise L2
CR : BRASSIER Julia
TSSI
Pr Frédéric Vely
12 pages
DYNAMIQUE DE LA REPONSE INNEE
A. Introduction
I. Évolution d'une infection en fonction de la présence du système immunitaire
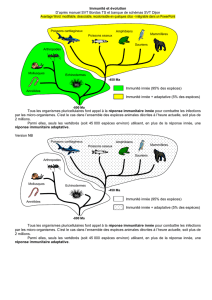
On observe que chez un sujet sain, le nombre de micro-organismes va croître au début de l'infection et si le
système immunitaire fonctionne correctement on peut éradiquer l'agent pathogène.
En revanche s'il n'y a pas d’immunité innée fonctionnelle, la charge d'agent pathogène croit de façon
exponentielle très tôt après l'infection et ce malgré la présence d'un système immunitaire adaptatif fonctionnel,
celui-ci risque d’être débordé par la charge infectieuse et il n'y aura pas de contrôle de cette infection.
A l'inverse lorsqu'il y a uniquement le système immunitaire inné fonctionnel, on aura un contrôle de la charge
infectieuse uniquement au début de l' infection puis de nouveau une perte de contrôle sans la présence d'un
système immunitaire adaptatif fonctionnel.
Il y a donc une collaboration étroite entre les cellules de l’immunité innée et les cellules de l’immunité
adaptative.
Les pathologies les plus graves du système immunitaire sont nommées « déficit immunitaire combiné
sévère DICS». Dès les premiers mois de vie, on diagnostic des infections virales très graves dont le traitement
de référence reste la greffe de moelle osseuse
1/12
Plan :
A. Introduction
I. Évolution d'une infection en fonction de le présence du système immunitaire
II. Différence entre le système immunitaire inné et adaptatif
III. Les barrières naturelles
B. Dynamique de la réponse immunitaire
I. Mécanismes généraux
II. Reconnaissance PAMP-TLR
III. Sécrétion de molécules inflammatoires
IV. Le système du complément
V. Mécanismes lors d'une infection virale
VI. Mécanismes coopératifs avec les cellules NK
C. Conclusion

TISSU SANGUIN ET SYSTEME IMMUNITAIRE
Dynamique de la Réponse Innée
II. Différence entre le système immunitaire inné et adaptatif
Chaque individu a les mêmes spécificités dans son génome pour les récepteurs de l'immunité innée qui
reconnaissent des structures très conservées. Alors que pour l’immunité adaptative on n'hérite pas de
récepteurs mais de segments de gènes pour le BCR et le TCR que l'on va réarranger pour avoir des récepteurs
ayant une reconnaissance très particulière. Chaque individu va sélectionner ses réarrangements génétiques de
manière aléatoire !
Ces récepteurs sont exprimés par tous les types de cellules de l'immunité innée (macrophages, polynucléaires,
cellules dendritiques) en revanche le TCR sera uniquement exprimé par les lymphocytes T de même que pour le
BCR par les lymphocytes B.
La réponse est immédiate pour l’immunité innée dans les premières heures post-infection tandis que pour la
réponse adaptative il faut attendre au moins 5 jours.
Les récepteurs de l’immunité innée reconnaissent une très large classe d'agents pathogènes :
–les bactéries Gram via le lipopolysaccharide
–les bactéries flagellées via la flageline...
Alors que pour l’immunité adaptative on aura
la reconnaissance d'un épitope pour une
immunoglobuline (Ig) donnée.
Il y a une distribution clonale pour les
lymphocytes B et T qui n'expriment qu'un seul
type de récepteur pour un antigène à sa surface
en multiples copies avec une spécificité très
grande.
L'immunité adaptative est capable de distinguer
des structures moléculaires même étroitement
liées : le changement d'un acide aminé dans la
poche à peptides peut stopper la reconnaissance
par exemple.
2/12

TISSU SANGUIN ET SYSTEME IMMUNITAIRE
Dynamique de la Réponse Innée
III. Les barrières naturelles
Pour l’immunité innée la première protection contre les agents infectieux sont les muqueuses. Ces barrières
naturelles peuvent être:
–Mécaniques : cellules épithéliales attachées par des jonctions serrées, flux d’air ou de liquide à la
surface des cellules épithéliales et déplacement du mucus via les cils vibratiles
–Chimiques : présence d'acides gras au niveau de la peau, d'enzymes tel que les lysosymes au niveau de
la salive/sueur/larmes, d'un pH bas au niveau de l'estomac ou bien de peptides antibactériens.
–Microbiologiques : La flore normale est en compétition pour les nutriments et pour l’attachement à
l’épithélium et peut produire des substances antimicrobiennes.
La flore microbienne est une flore commensale
Il faut distinguer le non soi non dangereux du non soi dangereux : au niveau du tube digestif, on note la
présence de nombreux acteurs où chacun tire partie de cette colonisation, par contre si une bactérie crée une
inflammation locale elle sera considérée comme du non soi dangereux et une réponse immunitaire se mettra en
place.
B. Dynamique de la réponse immunitaire
I. Mécanisme généraux
Suite à une blessure, il y a franchissement des barrières naturelles et pénétration de la bactérie à l’intérieur du
derme et de l’épiderme .
A ce niveau-la on note déjà la présence de cellules de l’immunité innée comme la présence de macrophages
qui vont permettre de phagocyter puis de digérer ces bactéries dans des compartiments acides. Il va se créer une
vacuole de phagocytose qui va migrer dans les endosomes puis les lysosomes (endolysosome) pour permettre la
présentation de peptides antigéniques.Ces peptides vont être associés à des molécules d'histocompatibilité
de classe I ou II pour coopérer avec les cellules de l'immunité adaptative.
A côté de ces macrophages on note également la présence de polynucléaires neutrophiles également capables
de phagocytose mais surtout de bactéricidie. Ces globules blancs majoritaires chez l'homme sont indispensables
pour l'élimination des agents bactériens.
D'autres cellules de l’immunité innée jouant le rôle d’intermédiaires, les cellules dendritiques, vont coopérer à
la mise en place de l’immunité adaptative. Lorsque elles sont immatures ces cellules sont en périphérie et ont
une très importante capacité de phagocytose.
Une fois cette phagocytose effectuée, elles vont associer les peptides produits à partir des agents pathogènes à
leurs molécules du CMH. Au cours de leur trajet vers le ganglion lymphatique elles vont exprimer de
nombreuse molécules de CMH de classe I ou II pour les associer aux peptides et elles vont progressivement
perdre leurs propriété de phagocytose. La perte des capacités de phagocytose va leurs permettre d'exprimer de
plus en plus de molécules de CMH et de molécules de co-stimulation.
Dans les ganglions elles vont stimuler les lymphocytes T naïfs. Si celui-ci présente le bon récepteur il y aura
prolifération clonale. Puis coopération avec les lymphocytes B pour la production des Ac, et les lymphocytes T
helpers pour la production de cytokines capables d'augmenter la réponse immune. Il y a un retour de ces
cellules par voie sanguine sur le site de l' infection. Sur le lieu de l'infection va se mettre en place : la sécrétion
de cytokines par les LT effecteurs pour permettre l'activation des macrophages, le phénomène d'opsonisation
des bactéries via les anticorps.
L'agent pathogène est maintenant sous contrôle.
3/12

TISSU SANGUIN ET SYSTEME IMMUNITAIRE
Dynamique de la Réponse Innée
L'immunité innée ne détient pas la même finesse de reconnaissance qu'un TCR ou BCR il n'y a donc pas de
reconnaissance de structures très spécifiques, ni beaucoup de récepteurs pour reconnaître l'ensemble des agents
pathogènes rencontrés. Elles reconnaissent donc des structures très conservées (protéines ou lipides) chez les
pathogènes au cours de l’évolution.
Dans une bactérie Gram – se trouvent des composés très immunogènes : le lipopolysaccharide (LPS) que les
cellules de l’immunité innée sont capables de reconnaître via des récepteurs nommés TLR (Toll Like
Receptors). Il n'y a donc pas de spécificité très fine. Les cellules de l’immunité innée vont également
reconnaître le peptidoglycane, spécifique de certaines bactéries Gram + et même Gram -. Il y a donc une
grande différence entre les récepteurs TLR de l’immunité innée et les récepteurs TCR/BCR de l'immunité
adaptative.
II. Reconnaissance PAMP-TLR
Les cellules dendritiques permettent la connexion entre l’immunité innée et adaptative. Elles sont capables de
présenter les antigènes.
Elles sont également équipées de récepteurs spécialisés dans la reconnaissance de certains motifs appelés
PAMP (Pathogen Associated Molecular Patterns) d’origines très diverses (bactérie, virus, parasite,
champignon) et de nature variée. Ces récepteurs spécialisés sont appelés les Toll Like Receptors ou TLR. Ils
appartiennent à la grande famille des PRR (Pattern-Recognition Receptors). Ces cellules dendritiques sont donc
équipées de récepteurs TLR exprimés sous forme monomérique ou dimérique capables de reconnaître les
PAMPs dérivés d'agents pathogènes.
4/12

TISSU SANGUIN ET SYSTEME IMMUNITAIRE
Dynamique de la Réponse Innée
On retrouve plusieurs classe de TLR interagissant avec différents ligands PAMP, par exemple :
–TLR3 reconnaît l'ARN double brin présent chez certains virus. Ce récepteur TLR est présent non pas à
la surface mais à l’intérieur de la cellule qui pourra détecter la présence de l'ARN viral au cours de son
cycle réplicatif. Ce qui permet donc la reconnaissance des ARN viraux lorsqu'ils sont simple brin (TLR-
7) ou double brin ( TLR-3).
–TLR4 reconnaît le LPS des bactéries Gram – et l'acide lipotéichoïque des bactéries Gram+
–TLR5 reconnaît la flagelline présente sur les bactéries flagellées
–TLR9 reconnaît l'ADN CpG qui n'est présent que chez les bactéries, ce récepteur existe au niveau
intracellulaire pour reconnaître cet ADN
–TLR8 reconnaît des oligonucléotides
–TLR1, TLR2 et TLR6 reconnaissent des peptidoglycanes, des lipoprotéines, des zymosane (composé
présent chez les levures)...
Au final on a peu de récepteurs pour reconnaître l'ensemble du monde infectieux à la différence de l’immunité
adaptative où l'on a une spécificité très fine qui s’établira par des réarrangements géniques. Chaque individu
détient les mêmes gènes et mêmes récepteurs de l'immunité innée, on est donc capable de lutter contre l'agent
infectieux à armes égales pour cette immunité là (sélection par l'espèce à ne pas confondre avec l'immunité
adaptative qui est une sélection d'un individu au sein d'une espèce).
De plus, on constate que tout les TLR ne sont pas forcement en surface, ils peuvent être intracellulaires ou dans
des vésicules d'endocytose car certains pathogènes sont intracellulaires.
Cette reconnaissance PAMP-TLR va conduire à l'activation de facteurs de transcription le NF-KB qui
permettra la production de cytokines. Une fois ces facteurs de transcription activés il va y avoir production
d’interférons αβ de type 1 (≠ interférons γ de type 2). Ces signaux permettront d'activer la réponse immunitaire
sur le site de l'infection.
Exemple ci-dessous : des protéoglycanes bactériens peuvent être reconnus en surface par des TLR ou des
protéines NOD dans le cytosol de la cellule afin de conduire via le facteur NFkb à l'activation de la
transcription et à l'expression de gènes pro-inflammatoires.
5/12
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%