Chapitre 4

CH4 Octobre2012
Chapitre4
Équationschimiques
équationnominative:
Ex.Hydrogène+oxygène
monoxydededihydrogène
(eau)
équationsquelette:
Ex.H
2
+O
2
H
2
O
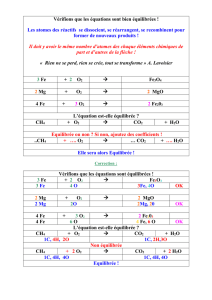
équationéquilibrée:
Ex.
2
H
2(g)
+O
2(g)
2
H
2
O
(l)
Enmots:
2
moléculesd'hydrogèneréagissentavec
1
moléculed'oxygènepour
former
2
moléculesd'eau.
A
(s)
+B
(aq)
C
(l)
+D
(g)

CH4 Octobre2012
Laloidelaconservationdelamasse:
Danstouteréactionchimique,lamassetotaledesréactifsestégaleàlamasse
totaledesproduits.
Donc,lenombred'atomesdechaqueélémentprésentdanslesréactifsdoit
êtreégalaunombred'atomesdechaqueélémentprésentdanslesproduits

CH4 Octobre2012

CH4 Octobre2012

CH4 Octobre2012
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%