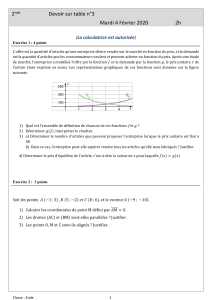
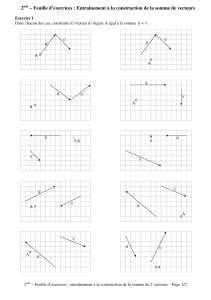
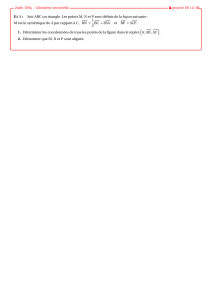
Transition lycée – université en physique et chimie 1. Compétences

Transition lycée – université
en physique et chimie
1. Compétences exigées au lycée
Ce tableau résume les compétences acquises en série S, essentiellement en terminale, mais aussi en
première. Les séries STI (Sciences et Technologies Industrielles, ex F) et STL (Sciences et
Technologies de Laboratoire ont des programmes plus spécifiques suivant leur spécialité (génie
électrique, génie mécanique, génie civil, chimie et génie des procédés, génie optique, biochimie).
A noter que le programme de terminale S aborde de nombreux domaines de la physique, sans permettre
un approfondissement pour chacun des thèmes traités. Par exemple en électricité on se limite à la
réponse à un échelon de tension des dipôles RL, et RC, et au régime libre pour le circuit LC.
En chimie, le programme étant moins étendu, les thèmes abordés peuvent être plus approfondis. Des
notions ont été récemment introduites telles que le quotient de réaction, l’avancement de la réaction
ainsi que de nouveaux outils comme le tableau d’avancement et le critère d’évolution spontanée des
systèmes chimiques. La chimie organique occupe moins de place que par le passé dans les
programmes de première et terminale.
Le tableau ci dessous résume les notions dont la maîtrise est exigée au lycée.
PHYSIQUE
NOTIONS COMPETENCES EXIGEES
AU LYCEE COMMENTAIRES
ONDES
Définir une onde mécanique,
onde transversale, longitudinale.
Exploiter les relations entre
retard, distance et célérité.
Exploitation de documents
expérimentaux
Onde progressives mécanique
périodique Relation λ = v T
Phénomène de diffraction.
Milieu dispersif
La lumière λ = C T
Diffraction θ = λ /a
Aucun calcul n’est demandé
toute représentation de la
forme y = f(x,t) est hors
programme
RADIOACTIVITE
Composition du noyaux,
isotropes, diagramme (N,Z)
radioactivité β+, β-, α, émission.
γ
Lois de conservation, loi de
décroissance. Application à la
datation.
Equivalence masse énergie,
défaut de masse, énergie de
liaison
Fission fusion
Unité de masse atomique
non exigée

DIPOLE RC
Etude expérimentale de la
tension aux bornes d'un
condensateur d'après la réponse
d'un dipôle RC à un échelon de
tension.
Exprimer i d'après uC.
Etablir l'équation différentielle
vérifiée par uC et vérifier la
solution proposée.
Constante de temps:
détermination graphique et par le
calcul. Analyse dimensionnelle.
Energie emmagasinée.
L’aspect résistif du
condensateur n’est pas
évoqué en terminale.
Les solutions des équations
différentielles sont
démontrées en L1.
DIPOLE RL
Etude expérimentale de
l’intensité du courant dans un
dipôle RL soumis à un échelon
de tension.
Exprimer uL.
Etablir l'équation différentielle
vérifiée par i et vérifier la
solution proposée.
Constante de temps:
détermination graphique et par le
calcul. Analyse dimensionnelle.
Energie emmagasinée.
E
L
E
C
T
R
I
C
I
T
E
DIPOLE RLC
Oscillations libres dans un
circuit RLC
Connaître les régimes
périodique, pseudo-périodique et
apériodique. Interprétation
énergétique.
Résolution analytique dans le cas
d’un amortissement négligeable.
CHUTE
VERTICALE
Chute verticale avec frottement :
2 loi de Newton, résolution par
méthode numérique itérative.
Régime asymptotique avec
vitesse limite et temps
caractéristique.
Chute verticale libre : Etablir
l’équation et la résoudre.
Application aux projectiles
MOUVEMENTS
DES
SATELLITES ET
DES PLANETES
Les lois de Kepler. Mouvement
circulaire uniforme
Période de révolution et période
de rotation propre
M
E
C
A
N
I
Q
U
E
OSCILLATIONS
Pendule simple étude
expérimentale : amplitude
pseudo-période isochronisme
Solide – ressort : force de rappel,
2 loi de Newton, équation
différentielle, solution analytique
Observation de la résonance en

amplitude, définition de
excitateur résonateur amplitude
période
CHIMIE
NOTIONS COMPETENCES ET CONTENUS
EXIGES AU LYCEE COMMENTAIRES
ATOMISTIQUE-
MOLECULES
• Constitution d’un atome, électroneutralité de l’atome
(2nde)
• Connaissance de Z, de A (2nde)
• Connaissance des règles du duet et de l’octet (2nde)
• Représentation de Lewis de quelques molécules
simples (2nde)
• Rendre compte de la géométrie de CH4, NH3 et H2O en
se basant sur la répulsion électronique des doublets
d’électrons (2nde)
• Position de la famille des alcalins, des halogènes et des
gaz rares dans la classification périodique des éléments
(2nde)
Comme le programme de
L1 au S1 démarre par de
l’atomistique, il est
opportun de rappeler ces
contenus et compétences
exigibles au lycée mais
essentiellement vus en
2nde
C
H
I
M
I
E
DES
S
O
L
U
T
I
O
N
S
GENERAL • Notion de soluté, solvant (2nde)
• ni = i
i
m
M
, ni = i
m
V
V, définition de la concentration
molaire, de la concentration massique, de la densité d’un
corps, de la masse volumique d’un corps (2nde)
• Description de l’évolution d’un système chimique à
l’aide de l’avancement x de la réaction. (CT)
• Utilisation d’un tableau d’avancement pour décrire
l’évolution d’un système chimique (CT)
• Savoir définir et identifier le réactif limitant (CT)
• Savoir que les ions en solution sont solvatés (CT)
• Caractère dipolaire de la molécule d’eau (CT)
• Connaître la relation entre la conductance mesurée et la
conductivité d’une solution électrol
y
ti
q
ue
(C
T
)
x (y) au lycée correspond
au ξ (x) du supérieur
τ au lycée correspond au
α du supérieur
Rigueur dans le
vocabulaire :
- Nombre
stoechiométrique au
lieu de coefficient
stoechiométrique
Transfo
rmation

• Equilibre chimique = équilibre dynamique. (CT)
• Savoir exprimer le quotient de réaction Qr à partir de
l’écriture d’une équation chimique. (CT)
• Savoir de Qr,eq = K et que sa valeur ne dépend que de la
température. (CT)
• Connaître la réaction d’autoprotolyse de l’eau. (CT)
• Savoir prévoir le sens d’évolution spontanée d’un
système chimique en comparant la valeur du Qr dans
l’état initial à la constante d’équilibre K. (CT)
ions spectateurs par
exemple, …) avec les
bons états physiques
(solide (s), liquide (l),
gazeux (g), aqueux (aq)).
ACIDE BASE
• Définir un acide et une base au sens de Brönsted (CT)
• Savoir écrire l’équation d’une réaction acido-basique
(CT)
• Connaître la définition du pH pour les solutions diluées.
(CT)
• Connaître la définition du taux d’avancement τ =
max
x
xf
et savoir le déterminer à partir d’une mesure de pH. (CT)
• Connaissant la valeur du pH à une température donnée,
savoir si la solution est neutre, basique ou acide. (2de et
CT)
• Savoir exprimer la constante d’acidité KA d’un couple
acide/base. (CT)
• Savoir exprimer la constante d’équilibre assosciée à une
réaction acido-basique à partir des valeurs des constantes
d’acidité des couples mis en jeu. (CT)
• Savoir établir la relation : pH=pKA + log
[
]
[]
acide
base .(CT)
• Savoir qu’une espèce A prédomine sur une espèce B si
[A]>[B] (CT)
En lycée, une espèce A
prédomine sur une
espèce B ssi [A] > [B]
alors que dans le
supérieur c’est le cas si
[A] > 10*[B]
OXYDO-
REDUCTION
• Définir un oxydant et un réducteur (CT)
• Reconnaître l’oxydant ou le réducteur dans un couple
rédox (CT)
• Savoir écrire l’équation d’une réaction
d’oxydoréduction (CT)
• Savoir schématiser une pile. (CT)
• Interpréter le fonctionnement d’une pile à partir d’une
information parmi les suivantes : sens de circulation des
porteurs de charge, f.é.m, réactions aux électrodes,
polarité de la pile, (CT)
• Savoir relier les quantités de matière des espèces
formées ou consommées à I, à Δt, dans une pile ou lors
d’une électrolyse. (CT)
• Savoir qu’une électrolyse est une transformation forcée.
(CT)
• Savoir : Anode / Oxydation
Cathode / réduction (CT)
La notion de degré ou
nombre d’oxydation n’a
pas été abordée.
Rigueur dans l’écriture
des équations chimiques
(si c’est Fe2+(aq) qui est
réactif alors on n’écrit
pas FeSO4 par exemple).

CINETIQUE
• Savoir que la vitesse de réaction augmente en général
avec la température et avec la concentration des réactifs.
• Compréhension de l’influence de ces facteurs à partir
d’un modèle microscopique. (CT)
• Interpréter qualitativement l’évolution de la vitesse de
réaction à partir d’une courbe d’évolution. (CT)
• Connaître la définition du temps de demi-réaction et
savoir le déterminer à l’aide d’une courbe d’évolution.
(CT)
• Savoir utiliser la loi de Beer-Lambert pour une
longueur d’onde donnée en cinétique mais pas seulement.
(CT)
CHIMIE
ORGANIQUE
• Définition d’une molécule organique (CT)
• Reconnaître une chaîne carbonée saturée linéaire (CT)
• Nomenclature des alcanes (jusqu’à 6C) (CT)
• Donner les formules : brute, semi-développée et
développée, d’une molécule simple (CT)
• Prévoir les isomères de constitution d’une molécule à
partir de sa formule brute (pour les alcanes jusqu’à 6C)
(CT)
• Polyaddition à partir d’un monomère du type
CH2=CHA (CT)
• Reconnaître les familles de composés suivantes :
amine, composé halogéné, alcool, aldéhyde, cétone et
acide carboxylique(CT)
• Au cours de la réaction d’un alcool, reconnaître s’il
s’agit d’une réaction d’oxydation, d’élimination ou de
substitution (CT)
• Ecrire la réaction d’oxydation d’un alcool par le
permanganate de potassium en milieu acide(CT)
• Reconnaître dans la formule d’une espèce les groupes
caractéristique suivants :-OH, -COOH, -COOR, -RCO-
O-COR. (CT)
• Ecrire l’équation des réactions d’estérification et
d’hydrolyse. (CT)
• Savoir nommer les esters jusqu’à 5C. (CT)
• Connaître la définition d’un catalyseur et savoir q ‘un
catalyseur agit de manière sélective. (CT)
• Savoir comment améliorer le rendement d’une réaction
d’estérification (ajout d’un excès d’un des réactifs, ou
élimination de l’un des produits). (CT)
• Ecrire l’équation de la réaction d’un anhydride d’acide
sur un alcool et de l’hydrolyse basique d’un ester et
connaître les caractéristiques de ces réactions. (CT)
• Savoir identifier la partie hydrophile et hydrophobe
d’un ion carboxylate à longue chaîne carbonée. (CT)
Pas de notion de
mécanisme réactionnel
THERMOCHIMIE • Donner la définition de l’énergie de liaison (CT)
• Notion d’énergie de cohésion d’un solide (CT)
 6
6
1
/
6
100%