UE8-Roquebert-Virus et grossesse (word)

UE8 – De l’agent infectieux à l’hôte
Dr Roquebert
Date : 18/04/2016 Plage horaire : 14h-16h
Promo : P2 2015-2016 Enseignant : Dr Bénédicte ROQUEBERT
Ronéistes : SCHOTT Zoé
HOARAU Christophe
Virus et Grossesse
I. Introduction
1. Quelques définitions
2. Suivi de grossesse
II. La rubéole
1. Carte d’identité
2. Rubéole congénitale
3. Epidémiologie
4. Démarches diagnostiques
5. Vaccination
III. CMV : Cytomégalovirus
1. Carte d’identité
2. Epidémiologie
3. Transmission intra-utérine du CMV
4. Anomalies échographiques repérables en cours de grossesse
5. Démarche diagnostique
6. Surveillance de la grossesse en cas de primo-infection
7. Prévention
IV. Erythrovirus B19
1. Carte d’identité
2. Epidémiologie
3. Infection fœtale
4. Démarche diagnostique
5. Prévention
V. VZV : Virus de la Varicelle et du Zona
1. Carte d’identité
2. Epidémiologie
3. Infection congénitale

4. Varicelle périnatale
5. En pratique
6. Diagnostic biologique
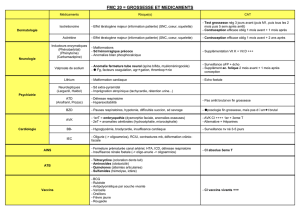
VI. Hépatite B
1. Carte d’identité
2. Dépistage obligatoire d’AgHBs
3. Traitement anti-VHB et allaitement
VII. VIH
1. Carte d’identité
2. Dépistage en cours de grossesse
3. Comment l’éviter ?
4. Accouchement
VIII. Autres virus
1. Entérovirus
2. HSV
3. Hépatite C
4. Hépatite E

II. Introduction
1. Quelques définitions
Une transmission materno-fœtale peut avoir plusieurs conséquences pouvant être graves avec l’atteinte
particulièrement sévères de l’embryon, du fœtus ou du nouveau-né. Ces infections ont des conséquences
majeures en termes d’épidémiologie et en termes d’évolution ultérieure des enfants qui ont été infects
pendant la grossesse.
Il faut distinguer 3 périodes de transmission materno-fœtale :
- Prénatale : transmission transplacentaire du fait d’une virémie maternelle (virémie → lors d’une
primo-infection)
- Périnatale : lors du passage de l’enfant à travers les voies génitales infectées ou pendant le travail
par microtransfusions materno-fœtales
- Postnatale : allaitement maternel (exemple : VIH)
2. Suivi de grossesse
Le suivi de grossesse est très bien codifié en France. En effet, il existe un dépistage prénatal obligatoire
pendant la grossesse :
Article du Code de la Santé Public : Lors du 1er examen prénatal (2mois et demi de grossesse), « les
dépistages de la syphilis, de la rubéole et de la toxoplasmose en l’absence de résultats écrits antérieurs
permettant de considérer l’immunité comme acquise (…) doivent être effectués ». Et « Au cours du 4ème
examen prénatal (6ème mois de grossesse), un dépistage obligatoire de l’antigène HBs doit être réalisé ».
En ce qui concerne le VIH, son dépistage sérologique est systématiquement proposé à l’occasion du 1er
examen prénatal. Et afin de détecter toute séroconversion pendant la grossesse, il est recommandé de
proposer aux femmes exposées à un risque accru de faire un nouveau test au 6ème mois et à l’accouchement.
NB : les femmes exposées à un risque accru sont les femmes qui viennent de « pays de la zone » ?, pays à
risque (exemple : Madagascar)
Au cours du suivi de grossesse, le dépistage se fera par sérologie → recherche de la présence d’Ac, IgG
seules (pour rubéole) ou IgG + IgM (pour CMV et VZV). Si la sérologie montre la présence d’Ac/Ig dans
le sérum, cela signifie que la patiente a déjà rencontré le virus et qu’elle est donc protégée. Par contre, si
l’on trouve de l’Ag dans son sérum (exemple : AgHBs), cela signifie qu’elle est porteuse du virus et donc
malade.
Si on se trouve devant une suspicion d’infection ou une notion de contage (exemple : femme enceinte ayant
un premier enfant ayant la varicelle) on fait :
- Soit des sérologies à la recherche IgG et IgM pour la mise en évidence d’une séroconversion
(patiente négative qui se positive en IgG et/ou IgM) + mesure de l’avidité des IgG
- Soit une PCR : rechercher directement la présence du génome du virus dans le liquide amniotique
Bien voir la différence entre dépistage néonatal chez une femme en bonne santé qui vient pour faire suivre
sa grossesse et dépistage-suspicion d’infection chez une femme pour laquelle il y a eu une notion de
contage.

II. La rubéole
1. Carte d’identité
Famille : Togaviridae
Genre : Rubivirus
Taille : 60-70nm (petit virus)
Génome : ARN sb de 10kb
Virus enveloppé et strictement humain
Pouvoir pathogène : - transmission par voie respiratoire
- période d’incubation varie de 13 à 20j
- éruption dans seulement 50% des cas (ce n’est pas parce qu’il n’y a pas d’éruption
que la patiente n’a pas la rubéole !)
- la virémie précède l’éruption d’une semaine
NB : les cartes d’identité ne sont pas à connaitre par cœur
La rubéole est une maladie bénigne sauf en cas de grossesse ! Notons que c’est une maladie qui est
quasiment éradiquée par la vaccination.
2. Rubéole congénitale
Le virus peut toucher n’importe quel organe : yeux, cœur, cerveau, oreilles, vaisseaux sanguins, …
L’infection par ce virus entraine une nécrose non inflammatoire et un ralentissement des mitoses →
inhibition du développement des organes. Il y a également une destruction cellulaire via processus
apoptotique qui est du à la réplication virale dans les cellules des différents organes.
Ce qui est embêtant avec la rubéole c’est qu’en plus les anomalies peuvent ne pas être visibles du tout sur
les échographies.
Le risque d’infection fœtal (applicable aux autres virus) est défini selon l’âge gestationnel :
- Pré-conceptionnel → aucun risque de transmission materno-fœtale du virus
- < 11 SA → 90% de risque d’infection
- 23-26 SA → 25% de risque d’infection
- Fin de grossesse → 100% de risque d’infection
Fréquence des malformations congénitales pour la rubéole :
- S’il y a infection avant 11 SA → malformation dans 70-90% des cas pouvant entrainer un
avortement, des embryopathies et fœtopathies très importantes
- S’il y a infection entre 11 et 18 SA → 15-80% des cas présente une surdité
- S’il y a infection après 18 SA → risque nul de malformation

3. Epidémiologie
En France, la vaccination des filles adolescentes à débuter dès 1970.
En 1996, les campagnes de vaccinations ont instauré 2 doses vaccinales systématiques pour être sûr de
protéger la majorité, si ce n’est la totalité, des jeunes filles. Et elles ont également rajouté la vaccination des
garçons.
Grace à cette vaccination systématique, on a eu une diminution importante des cas d’infection rubéoleuse
pendant la grossesse en France : 1984 → 29,5 cas/100.000 naissances
1988 → 15,4 cas
1992 → 4,6 cas
2006 → <10 cas d’infection (soit < 3 cas de rubéole congénitale)
On a aussi pu diminuer les cas d’IMG annuelles (interruption médicale de grossesse) : 1995-2005 → 10-20
2003-2008 → < 5
NB : ici diminution des IMG causés par infection rubéoleuse
Attention aux populations récemment immigrées de pays sans programme de vaccination
4. Démarches diagnostiques
• Au moment du 1er examen prénatal (obligatoire pour toute femme enceinte), on fait une sérologie sur tube
sec pour rechercher les IgG rubéoliques.
Description du schéma :
Si le taux IgG rubéolique > seuil de
protection → la femme est immunisée, on
ne contrôle pas (sauf si doute au niveau de
l’étiquetage du prélèvement)
Si le taux IgG rubéolique < seuil de
protection → patiente non immunisée →
2ème test à 6 mois de grossesse (contrôle en
cas de séroconversion)
Dans le cas d’une femme non immunisée
contre la rubéole (et donc séronégative pour la
rubéole), il faut absolument la vacciner juste
après son accouchement et avant sa sortie !
Diagramme d’apparition des anticorps.
A J0, la patiente a un contage/rencontre avec
le virus.
On a une incubation qui dure 7-10j.
Elle est contagieuse assez rapidement (J4) et
très contagieuse pour son enfant (considérée
comme contagieuse à partir de la virémie)
A partir de J16, son système immunitaire va
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%