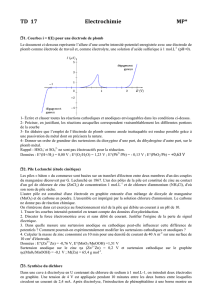
cinétique électrochimique

Electrochimie et applications 136
CHAPITRE 8 : LES REACTIONS D’ELECTRODES
ASPECTS CINETIQUES
A. INTRODUCTION
1. Les étapes d'une réaction d'électrode
Une réaction d'électrode est composée de plusieurs étapes élémentaires dont l'une au
moins est un transfert de charges.
D'une manière générale (figure VIII.1), on a successivement :
* un transfert de matière de la solution vers l'interface ;
* un transfert électronique à la surface de l'électrode
* des réactions chimiques qui précèdent ou suivent le transfert électronique
ex : - protonation, dimérisation, complexation (processus homogènes)
- décomposition catalytique à la surface de l'électrode (processus
hétérogènes)
* d'autres réactions à la surface de l'électrode telles que adsorption, désorption ou
cristallisation (électrodépôt).
Figure VIII.1. : Etapes d’une réaction d’électrode.
Les réactions les plus simples impliquent seulement le transfert de matière d'un réactif
vers l'électrode, un transfert électronique hétérogène suivi d’un transfert de matière du
produit vers la solution.
La réaction globale étant une succession de plusieurs étapes élémentaires, et chaque
étape étant caractérisée par sa propre vitesse, la vitesse de la réaction globale est
Désorption
Désorption
Adsorption
Adsorption
Réactions
chimiques
Rsolution
Transferts
de masse
Réactions
chimiques
Osurf
O’
Rsurf
R’
Transfert
électronique
Electrode
Interface électrode-solution
Sein de la solution

Electrochimie et applications 137
imposée par l'étape la plus lente; cette dernière est appelée "étape déterminante". Il
est clair que les étapes les plus faciles sont alors effectuées à une vitesse inférieure à leur
vitesse maximale.
Comme la vitesse de la réaction globale est en relation directe avec le courant circulant
dans le circuit, on peut imaginer que chaque étape introduit une résistance au passage
du courant.
E = RI et Eappl = Eéq + (R1 + R2 + ...) . I + Rsol . I
(chute ohmique)
Rsolution Rtransport Rtransfert Rcristallisation Rréaction
On peut écrire que :
transport = R transport . I surtension de transport ou de diffusion
transfert électron = R transfert . I surtension de transfert
etc,...
La surtension correspond au surplus d'énergie qu'il faut fournir pour que la réaction
puisse s'effectuer avec une vitesse observable, elle est liée à l'énergie d'activation de la
réaction.
A chaque étape élémentaire de la réaction globale, on peut associer une surtension
particulière:
- surtension de décharge ou d'activation, ou de transfert de charge ;
- surtension de diffusion, ou de transfert de matière ;
- surtension de réaction chimique ;
- surtension de cristallisation.
( force contre la force électromotrice localisée à l'interface métal-solution)
Remarque : suivant que le système électrochimique fonctionne en pile ou en électrolyseur, on
a :
en pile : Ebornes pile E éq.
en électrolyseur : Eappliqué E éq.

Electrochimie et applications 138
Le schéma électrique équivalent d'une cellule électrochimique complète (2 électrodes +
solution) donne :
Z Z'
R
CC'
polaris polaris
solut
dd
Les objectifs de la cinétique électrochimique sont :
- Etudier les différentes étapes des réactions d'électrodes ;
- Déterminer les lois donnant les résistances de polarisation.
Il est important de remarquer que ces résistances de polarisation varient avec
le courant et ne sont malheureusement pas constantes.
2. Recherche des lois liant les surtensions et le courant
Les variables affectant la vitesse d'une réaction électrochimique sont nombreuses.
Pour un système donné, on essaiera de déterminer les relations : f (E , i ,C , t ) = 0
On distingue essentiellement :
le régime stationnaire
On attend que l'équilibre soit réalisé entre les variables (i, E, C ) et que celles-ci ne
dépendent plus du temps.
On recherche alors les lois f ( E, i,
C
) = 0 ;
C
étant la concentration de l'espèce au sein de
la solution.
La relation : i = f (E/ref) à
C
constante est appelée courbe de polarisation
potentiocinétique.
Pour la réaction Men+ + ne Me , il se peut :
- que l'étape de transport soit l'étape lente. Dans ce cas, il y a apparition d'un gradient
de concentration (fonction de l'agitation de la solution). La surtension correspondante
sera appelée surtension de diffusion et on recherchera la loi correspondante ;
- que l'étape de transfert de charges soit l'étape lente. La surtension correspondante
sera appelée surtension d'activation; elle sera fonction du potentiel et de la nature
du métal.

Electrochimie et applications 139
le régime transitoire
Les surtensions ne s'établissent ni ne cessent instantanément lors de l'enclenchement ou
de la coupure du courant. Les phénomènes transitoires sont intéressants pour étudier le
mécanisme des réactions; on peut les utiliser dans des buts analytiques.
En régime transitoire, on exploite des relations dans lesquelles on suit l'évolution au
cours du temps de l'une des deux variables électrochimiques (Eélect/réf, I) lorsque l'on
impose une valeur constante à l'autre.
On distingue : - la chronoampérométie : courbes I = f (t) à E = constante
- la chronopotentiométrie : courbes E = f (t) à I = constante
On peut également réaliser des électrolyses en régime alternatif ou étudier le mécanisme
des réactions d'électrodes par superposition de signaux alternatifs ou autres à un signal
continu. C’est l’objet de la spectroscopie d’impédance qui actuellement, a pris une place
importante dans l’étude des cinétiques réactionnelles. Cette méthode permet d’associer
des schémas électriques équivalents aux phénomènes se passant aux électrodes.
3. Relation courant - vitesse de réaction
Pour une réaction écrite dans le sens de la réduction
. S + ne produits
coefficient stoechiométrique positif pour tous les réactifs situés du côté de l'oxydant.
L'expression générale de la vitesse peut s'écrire :
vdC
dt k S.
lleréactionnespécifiquevitessek
àrapportparréactionladeordre
réactifenionconcentratS
scmmolenfluxouvitessev
.. 12
Remarque : k = k0 .
eEact RT/
; Eact étant l'énergie d'activation caractéristique de chaque
étape.
La loi de Faraday nous permet d'écrire :
QnF Pi
.

Electrochimie et applications 140
n nombre d’électrons échangés
Pi nombre de moles d'une substance qui réagissent
Q charge correspondante qui passe au travers de l'interface électrode/électrolyte.
En dérivant par rapport au temps, on a :
dt
dP
nF
dt
dQ
Ii
avec
dP
dt
i
étant la vitesse de réaction (mol.s-1)
La vitesse d’une réaction d’électrode est proportionnelle à l’intensité du courant
électrique à travers l’interface électrode-électrolyte.
On peut écrire aussi que l’intensité de courant est égale au flux multiplié par la charge
transportée :
i = flux charge =
nF vnF k S. . .
i intensité de courant (A/cm2)
n nombre d'électrons échangés
F Faraday (C/eq)
coefficient stoechiométrique de S
k vitesse spécifique en (cm.sec-1)
[S ] concentration en espèce électroactive (mol/cm3)
Il est important de faire remarquer que si [S ] n'est pas uniforme, c'est la concentration
[S ] à la surface de l'électrode qui fixe le courant i.
4. Mode de transport d'une espèce électroactive dans une électrolyse
L'apport de matière à une électrode peut se faire par l'intermédiaire de trois processus :
Diffusion : Déplacement sous l'effet d'un gradient de concentration. La diffusion n'existe
que s'il y a consommation ou production d'une espèce, c'est-à-dire essentiellement au
voisinage de l'électrode.
Migration : Déplacement sous l'effet du champ électrique.
Convection : Transport sous l'effet d'un mouvement d'ensemble de l'électrolyte (agitation).
 6
6
 7
7
1
/
7
100%