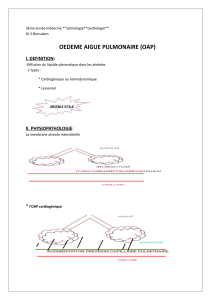
Télécharger le texte intégral - Thèses
publicité

ECOLE NATIONALE VETERINAIRE D’ALFORT Année 2004 L’ANESTHESIE GENERALE DU CHIEN SOUFFRANT D’ENDOCARDIOSE MITRALE CHRONIQUE THESE Pour le DOCTORAT VETERINAIRE présentée et soutenue publiquement devant LA FACULTE DE MEDECINE DE CRETEIL le par Sébastien André Jacques GALLET Né le 29 octobre 1974 à Lille ( Nord ) JURY Président : M Professeur à la faculté de Médecine de CRETEIL Membres Directeur : M. MAILHAC Maître de conférences de chirurgie à l’E.N.V.A. Assesseur : M. POUCHELON Professeur de médecine à l’E.N.V.A. 1 2 Au Président du Jury Mes plus sincères remerciements pour avoir bien voulu présider ce jury. A mon Directeur de Thèse Ma plus grande reconnaissance au Docteur Mailhac, Pour son soutien tout au long de la réalisation de ce travail. A mon Assesseur de Thèse Toute ma gratitude au Professeur Pouchelon, Pour avoir accepté de participer à l’élaboration de ce manuscrit. 3 4 A ma Mère, 5 6 L’ANESTHESIE GENERALE DU CHIEN SOUFFRANT D’ENDOCARDIOSE MITRALE CHRONIQUE GALLET Sébastien RESUME : Anesthésier un chien souffrant d’endocardiose mitrale est un acte fréquemment entrepris par le praticien du fait de la forte incidence de cette affection dans la population canine et de la relative augmentation de la durée de vie des animaux. La démarche permettant d’assurer le moins de risques consiste, tout d’abord, à évaluer la gravité de l’affection par un examen clinique et des examens complémentaires dont l’échocardiographie reste le plus utile. Cette étape permet de définir l’état du système cardiovasculaire du patient ainsi que sa capacité à endurer une anesthésie et par conséquent de choisir le protocole anesthésique le mieux adapté à la situation. Les stades les plus avancés de l’affection nécessitent l’emploi des molécules les plus sûres telles que les benzodiazépines, les morphiniques et l’étomidate , et comme agents volatils, l’isoflurane ou mieux encore le sévoflurane ou le desflurane. Les risques anesthésiques sont ainsi minorés ce qui n’empêche pas les accidents per-opératoires. Le monitorage offre la possibilité de contrôler à tout moment les fonctions cardiovasculaire et respiratoire et d’intervenir rapidement en cas de trouble. Il est d’autant plus complet que la situation cardiovasculaire du patient est critique. Ainsi il reste assez sommaire pour des animaux de stade I mais nécessite rapidement matériel et compétence spécifiques pour des stades évolués ( III et IV ) du fait du caractère invasif de certaines techniques ( cathétérisme artériel et veineux, analyse des gaz sanguins ). Il convient également de connaître les effets des substances antiarythmiques et inotropes positives afin de les employer à bon escient. Mots clés : - anesthésie - chien - endocardiose mitrale - évaluation du stade - protocole anesthésique - monitorage JURY : Président Pr Directeur Dr MAILHAC Assesseur Pr POUCHELON Adresse de l’auteur : 735 avenue de dunkerque 59160 LOMME 7 ANESTHESIA FOR DOGS WITH MITRAL VALVE ENDOCARDIOSIS GALLET Sébastien SUMMARY : Anesthetize a dog with mitral valve endocardiosis is an act currently undertaken by pratitioners because of the great incidence of this affection in canine population and its increasing lifetime. The less hazardous method is, first, to assess the severity of the affection with physical and complementary examinations among which echocardiography is the more interesting. This step offers to define the status of cardiovascular system and its capacity to endure anesthesia and, then, choose the best anesthetic protocol. Critical statuses of the affection require the use of safier drugs as benzodiazepines, opioids and etomidate or, as inhalants, isoflurane, desflurane or sevoflurane. Anesthetic problems are, then, decreased but not eliminated. The monitoring offers to control cardiovascular and respiratory systems at any time and act quickly in case of troubles. The more critical is the status of the patient, the more complete is the monitoring materials. For patient of category I, the monitoring is basic but for category III or IV it requires materials and specific knowledges because of invasive techniques (arterial and venous catheterism and blood gas analysis). The pratitioner also has to know effects of antiarythmic and inotrope substances to use them in the right way. Key words : - anesthesia - dogs - mitral endocardiosis - status assessment - anesthetic protocol - monitoring JURY : President Pr Director Dr MAILHAC Assessor Pr POUCHELON Author’s address : 735 avenue de dunkerque 59160 LOMME 8 SOMMAIRE INTRODUCTION.......................................................................................................7 EVALUATION DE LA GRAVITE DE L’ATTEINTE CARDIAQUE.................9 I. I - PATHOGENIE ET PHYSIOPATHOLOGIE DE L’IMC .......................................11 I. A - PATHOGENIE ......................................................................................................................11 I. A. 1 - lésions primitives .............................................................................................................11 I. A. 2 - lésions secondaires...........................................................................................................11 I. B - CONSEQUENCES PHYSIOPATHOLOGIQUES.............................................................13 I. B. 1 - activation du système adrénergique...............................................................................13 I. B. 2 - rein et système rénine – angiotensine – aldostérone ( SRAA ) ....................................13 I. B. 3 - modification de la morphologie cardiaque ....................................................................15 I. B. 4 - le FAN ...............................................................................................................................16 I. C - EVOLUTION DE L’IMC .....................................................................................................16 I. C. 1 - le volume régurgité..........................................................................................................16 I. C. 2 - la contractilité du myocarde ...........................................................................................17 II. II - ANAMNESE ET EXAMEN CLINIQUE .................................................................18 II. A - ANAMNESE .........................................................................................................................18 II. B - EXAMEN CLINIQUE .........................................................................................................19 II. B. 1 - considérations générales ................................................................................................19 a - observation .....................................................................................................................19 b - palpation ........................................................................................................................20 II. B. 2 - appareil respiratoire ......................................................................................................20 II. B. 3 - appareil cardiovasculaire ..............................................................................................24 III. III - LES EXAMENS COMPLEMENTAIRES..............................................................26 III. A - LA RADIOGRAPHIE........................................................................................................26 III. A. 1 - signes radiographiques cardiaques de l’IMC ............................................................27 III. A. 2 - signes radiographiques pulmonaires de l’IMC .........................................................30 III. B - L’ECHOCARDIOGRAPHIE............................................................................................32 III. B. 1 - mode bidimensionnel ( 2D ) .........................................................................................32 a - principales coupes anatomiques utilisées ......................................................................32 b - modification engendrées par l’endocardiose.................................................................35 III. B. 2 - Mode TM .......................................................................................................................39 a - Principales « coupes » utilisées .....................................................................................39 b - Modifications structurelles et fonctionnelles liés à l’IMC.............................................41 • épaisseur et volume......................................................................................................41 • indices de la fonction ventriculaire gauche..................................................................41 III. B. 3 - mode doppler ................................................................................................................46 a - doppler continu et pulsé .................................................................................................46 • doppler continu ............................................................................................................46 • doppler pulsé ................................................................................................................46 • analyse des signaux doppler.........................................................................................48 • Modifications liées à l’IMC .........................................................................................48 b - doppler couleur ..............................................................................................................50 • principe.........................................................................................................................50 • renseignements fournis ................................................................................................50 III. C - L’ELECTROCARDIOGRAPHIE....................................................................................52 III. C. 1 - dilatation des cavités ....................................................................................................52 a - dilatation de l’atrium gauche.........................................................................................52 b - hypertrophie du ventricule gauche ................................................................................52 III. C. 2 - dysrythmies et IMC......................................................................................................55 a - dysrythmies supraventriculaires ....................................................................................55 • tachycardie sinusale .....................................................................................................55 • tachyarythmies supraventriculaires..............................................................................56 b - les dysrythmies ventriculaires........................................................................................61 • les extrasystoles ventriculaires : dépolarisations ventriculaires prématurées ..............61 • la tachycardie ventriculaire ..........................................................................................63 • la fibrillation ventriculaire ...........................................................................................64 III. D - LES EXAMENS BIOLOGIQUES ....................................................................................65 EFFETS CARDIOVASCULAIRES DES PRINCIPAUX AGENTS ANESTHESIQUES ...................................................................................................69 IV. I - LES PREANESTHESIQUES ET AGENTS DE LA PREMEDICATION ..........................................................................................................71 I. A - LES ANTICHOLINERGIQUES .........................................................................................71 I. B - LES TRANQUILLISANTS ..................................................................................................72 I. B. 1 - Les tranquillisants mineurs : les anxiolytiques.............................................................72 I. B. 2 - Les tranquillisants majeurs : les neuroleptiques ..........................................................73 a - les phénothiazines ..........................................................................................................73 b - les butyrophénones.........................................................................................................74 I. C - LES ANALGESIQUES CENTRAUX .................................................................................74 I. C. 1 - Les analgésiques centraux : morphiniques ou opiacés.................................................74 I. C. 2 - Les analgésiques sédatifs : α 2 agonistes .......................................................................76 V. II - LES ANESTHESIQUES INJECTABLES ...............................................................79 2 II. A - LES DISSOCIATIFS ...........................................................................................................79 II. A. 1 - la kétamine......................................................................................................................79 • Association kétamine – benzodiazépines.....................................................................81 • Association kétamine – acépromazine.........................................................................81 • Association kétamine - α2 agonistes ...........................................................................81 II. A. 2 - tilétamine - zolazépam ...................................................................................................82 II. B - LES BARBITURIQUES ......................................................................................................83 II. C - LE PROPOFOL ...................................................................................................................84 II. D - L’ETOMIDATE ...................................................................................................................84 VI. III - LES ANESTHESIQUES VOLATILS .....................................................................85 III. A - LES HALOGENES ............................................................................................................86 III. A. 1 - Considérations générales .............................................................................................86 III. A. 2 - l’halothane.....................................................................................................................86 III. A. 3 - l’isoflurane ....................................................................................................................87 III. A. 4 - l’enflurane .....................................................................................................................87 III. A. 5 - le méthoxyflurane.........................................................................................................88 III. A. 6 - le desflurane et le sévoflurane .....................................................................................88 III. B - LE PROTOXYDE D’AZOTE ...........................................................................................88 VII. IV - FACTEURS INFLUENCANT LES EFFETS CIRCULATOIRES......................91 LE MONITORAGE DE L’ANESTHESIE ET LES MESURES D’URGENCE.............................................................................................................94 VIII. I - LE MONITORAGE RESPIRATOIRE DE L’IMC..................................................96 I. A - MONITORAGE RESPIRATOIRE CHEZ L’IMC DE STADE I ET II..........................96 I. A. 1 - Fréquence respiratoire et auscultation..........................................................................96 I. A. 2 - Le monitorage de la ventilation par un respiromètre ..................................................98 I. B - MONITORAGE RESPIRATOIRE CHEZ L’IMC DE STADE III .................................98 I. B. 1 - Evaluation de la PaCO2 par un capnographe ..............................................................98 I. B. 2 - Monitorage de l’oxygénation du sang par un oxymètre ............................................101 a - Taux d’hémoglobine.....................................................................................................101 b - Sa02 et Pa02 ................................................................................................................101 c - l’oxymétre à IR .............................................................................................................101 I. C - MONITORAGE RESPIRATOIRE CHEZ L’IMC DE STADE IV ...............................101 I. C. 1 - Mesure des PaO2 et PaCO2 par analyseur sanguin ..................................................102 I. C. 2 - Le statut acido-basique .................................................................................................103 a - Matériel ........................................................................................................................103 b - Techniques de prélèvement d’un échantillon de sang artériel ....................................103 c - Statut acido-basique et données de l’analyseur...........................................................104 3 d - troubles acido-basiques et interprétation des données................................................104 • troubles d’origine respiratoire....................................................................................107 • troubles d’origine métabolique ..................................................................................109 I. D - LES ACCIDENTS RESPIRATOIRES..............................................................................112 I. D. 1 - Origines ..........................................................................................................................112 I. D. 2 - Conduite à tenir .............................................................................................................112 IX. II - LE MONITORAGE CARDIOVASCULAIRE DE L’IMC ..................................113 II. A - MONITORAGE CARDIOVASCULAIRE DE L’IMC DE STADE I ET II................113 II. A. 1 - Evaluation de la perfusion tissulaire..........................................................................113 II. A. 2 - Mesure indirecte de la pression artérielle..................................................................115 a - le détecteur de flux à effet doppler ...............................................................................116 b - la technique oscillométrique ........................................................................................116 II. A. 3 - Mesure de la fréquence et du rythme cardiaques .....................................................119 II. B - MONITORAGE CARDIOVASCULAIRE DE L’IMC DE STADE III ET IV............122 II. B. 1 - Mesure de la PVC ........................................................................................................122 a - matériel et méthode ......................................................................................................122 b - mesure ..........................................................................................................................125 c - indications ....................................................................................................................125 d - facteurs influençant la PVC .........................................................................................126 e - valeur clinique de la PVC ............................................................................................126 • attitude à avoir devant une diminution de la PVC .....................................................126 • attitude à avoir devant une augmentation de la PVC .................................................127 f - complications................................................................................................................127 II. B. 2 - Mesure directe de la pression artérielle .....................................................................128 a - matériel et méthode ......................................................................................................128 b - mesure ..........................................................................................................................128 c - renseignements apportés par l’étude de la courbe (fig 28) .........................................128 d - complications ...............................................................................................................131 e - valeurs cliniques de la PA............................................................................................131 • la profondeur de l’anesthésie .....................................................................................131 • la gestion de la fluidothérapie ....................................................................................131 • la perfusion tissulaire .................................................................................................131 • la consommation du myocarde en 02.........................................................................134 II. B. 3 - Mesure directe du débit cardiaque et de la pression pulmonaire............................136 II. C - COMPLICATIONS ET URGENCES CARDIOVASCULAIRES................................136 II. C. 1 - Les troubles du rythme peropératoires .....................................................................136 a - diagnostic .....................................................................................................................136 b - les bradycardies : bradycardie sinusale et blocs auriculo-ventriculaires...................136 • étiologie......................................................................................................................136 • traitement ...................................................................................................................138 c - les tachycardies ............................................................................................................139 4 • étiologie......................................................................................................................139 • tachycardie sinusale et tachyarythmies supraventriculaires.......................................139 • tachycardie et tachyarythmies ventriculaires .............................................................139 II. C. 2 - L’arrêt cardiaque.........................................................................................................142 a - étiologie........................................................................................................................142 b - gestes thérapeutiques ...................................................................................................143 • suppléance des fonctions vitales ................................................................................143 • relance des fonctions vitales ......................................................................................145 • la réanimation complémentaire..................................................................................149 X. III - LES SUBSTANCES UTILISEES CONTRE L’INSTABILITE CARDIAQUE ..................................................................................................................150 III. A - LES ANTIARYTHMIQUES ...........................................................................................150 III. A. 1 - Substances luttant contre les tachyarythmies..........................................................150 a - la lidocaïne...................................................................................................................150 • action..........................................................................................................................150 • indications cliniques...................................................................................................150 • toxicité........................................................................................................................151 b - la quinidine ..................................................................................................................151 • action..........................................................................................................................151 • indications cliniques...................................................................................................151 • toxicité........................................................................................................................151 c - la procaïnamide............................................................................................................153 • action..........................................................................................................................153 • indications cliniques...................................................................................................153 • toxicité........................................................................................................................153 d - les β bloquants .............................................................................................................153 • le propranolol .............................................................................................................154 • l’aténolol ....................................................................................................................155 • l’esmolol.....................................................................................................................155 e - brétylium et amiodarone ..............................................................................................155 • l’amiodarone ..............................................................................................................155 • le brétylium ................................................................................................................155 f - les inhibiteurs calciques ...............................................................................................156 • le vérapamil................................................................................................................157 • le diltiazem.................................................................................................................157 g - les digitaliques .............................................................................................................158 III. A. 2 - les substances luttant contre les bradyarythmies ....................................................160 a - les anticholinergiques ..................................................................................................160 b - les sympathomimétiques...............................................................................................160 III. B - LES SUBSTANCES INOTROPES .................................................................................160 III. B. 1 - les sympathomimétiques ............................................................................................160 a - mécanisme d’action......................................................................................................160 5 b - la dobutamine...............................................................................................................161 c - la dopamine ..................................................................................................................163 III. B. 2 - les inhibiteurs de la phosphodiestérase.....................................................................163 a - principe d’action ..........................................................................................................163 b - l’amrinone....................................................................................................................163 c - la milrinone ..................................................................................................................164 III. B. 3 - les calcium sensibilisateurs ........................................................................................164 CONCLUSION GENERALE ................................................................................166 BIBLIOGRAPHIE ..................................................................................................169 6 INTRODUCTION L’existence d’une atteinte cardiaque est une raison fréquente du refus des propriétaires de laisser leur animal subir une anesthésie générale. En effet, cette dernière n’est pas un acte anodin et soumet le système cardiovasculaire à des perturbations vis à vis desquelles le patient cardiaque est moins tolérant. L’augmentation de la durée de vie des animaux mais aussi la forte incidence de la dégénérescence valvulaire mitrale parmi la population canine expose fréquemment le praticien à anesthésier ce genre de patients. Il convient alors, dans un premier temps, d’évaluer les risques anesthésiques par l’intermédiaire d’un examen clinique mais également par la réalisation d’examens complémentaires. Dans un second temps, il conviendra de choisir le protocole anesthésique le mieux adapté à la vue des risques encourus et de la connaissance des effets cardiovasculaires des principaux agents. Dans un dernier temps, un monitorage plus ou moins complet des fonctions respiratoire et cardiovasculaire, suivant la gravité de l’atteinte, sera mis en place afin de contrôler le bon déroulement de l’anesthésie et intervenir rapidement en cas d’accidents . 7 8 EVALUATION DE LA GRAVITE DE L’ATTEINTE CARDIAQUE 9 10 L’insuffisance mitrale acquise est une affection cardiaque très répandue chez le chien âgé (plus de 75 % des maladies cardiaques (13, 58, 88) ). Selon le stade et la gravité de l’atteinte, elle peut être à l’origine de troubles plus ou moins importants de l’hémodynamique cardiovasculaire. La survie du patient au cours d’une anesthésie générale implique l’intégrité de cette fonction. C’est pourquoi il est nécessaire d’évaluer la gravité de l’atteinte afin d’estimer les risques encourus par l’animal lors de l’anesthésie et également les précautions à prendre tant dans le choix des substances anesthésiques que dans le monitorage. Dans un premier temps, on rappellera la pathologie et la physiopathologie de l’insuffisance mitrale chronique (IMC) et dans un second temps, les moyens mis à disposition du praticien permettant d’évaluer les répercussions de cette affection sur les paramètres cardiovasculaires. I - PATHOGENIE ET PHYSIOPATHOLOGIE DE L’IMC I. A - PATHOGENIE L’endocardiose nodulaire ou dégénérescence myxomateuse de la valve mitrale désigne une affection dégénérative acquise de l’appareil atrio-ventriculaire gauche (13, 21, 22, 58, 61, 88). Elle représente 60 % des cas d’endocardiose valvulaire acquise (10 % pour l’insuffisance tricuspidienne seule et 30 % pour l’association IM et IT) (58, 88). I. A. 1 - lésions primitives La pathogénie s’explique par un épaississement nodulaire, des déformations en plaque aboutissant à une diminution de la largeur et une rigidité excessive des feuillets induisant une incapacité de fermeture de la valve. Les cordages tendineux deviennent également plus rigides, ce manque d’élasticité restreint alors l’affrontement des deux feuillets valvulaires. Ces cordages peuvent même se rompre induisant ainsi une brutale décompensation de l’IMC voire la mort de l’animal (13, 58, 88). Dans certain cas, les cordages sont distendus et lâches autorisant un prolapsus des feuillets dans la cavité atriale gauche (13, 58, 88). Microscopiquement, le premier changement s’observe sur la face atriale des feuillets valvulaires atrioventriculaires. L’endothélium prolifère et on assiste à une croissance du nombre de fibroblastes subendothéliaux. Les fibres élastiques entre atrialis et spongiosa ( 2 des 4 couches constitutives du feuillet valvulaire avec la fibrosa et la ventricularis ) se scindent. Ceci est suivi par l’augmentation de la taille de la spongiosa et d’une dégénérescence de la fibrosa. La spongiosa a, alors, l’apparence d’un tissu mésenchymateux embryonnaire ( d’où le terme de myxomateux ) caractérisé par des cellules étoilées et une matrice extracellulaire abondante, pauvre en collagène et fibres élastiques et riche en glyco-amino-glycanes ( acide hyaluronique et chondroïtine sulfate ). Les fibroblastes prolifèrent dans la spongiosa et donne cet aspect caractéristique de petits nodules (13, 58, 88). I. A. 2 - lésions secondaires Sur l’endocarde atrial se développent des plaques fibreuses d’aspect irrégulier. Ces lésions, encore appelées « jet lesions », résultent de la puissance du flux rétrograde provenant du ventricule durant la systole (6, 13, 58, 88). La paroi de l’atrium peut alors 11 être fragilisée et subir une déchirure, même si c’est rarement le cas (58), se soldant par un hémopéricarde et une tamponnade (6, 13, 58, 88). Figure 1 : origine et effets des mécanismes compensateurs sur les paramètres cardiovasculaires Dysfonction ventriculaire gauche P débit cardiaque P du volume circulant efficace N fréquence cardiaque N activité du système nerveux sympathique P activité du système nerveux parasympathique P du flux sanguin rénal Activation du système rénineangiotensine-aldostérone Vasoconstriction veineuse Vasoconstriction artériolaire N aldostérone N pré-charge N post-charge N réabsorption d’eau et sodium N volume de fluides intravasculaires Œdème pulmonaire D’après DIFRUSCIA et THERRIEN (22) 12 L’atrium et le ventricule subissent des remaniements consécutifs à la surcharge volumique engendrée par l’insuffisance mitrale. Le ventricule subit une hypertrophie excentrique adaptative (13, 33, 58, 61, 88). Une artériosclérose coronaire intramurale a été notée dans certains cas d’endocardiose et serait une hypothèse explicative du développement d’insuffisance du myocarde dans cette affection (13, 58). I. B - CONSEQUENCES PHYSIOPATHOLOGIQUES La dégénérescence myxomateuse se solde par une insuffisance de coaptation des feuillets mitraux voire un prolapsus dans l’atrium gauche. Une partie non négligeable du volume sanguin ventriculaire retourne dans l’oreillette lors de la systole ( ce que l’on nomme régurgitation ). Cette insuffisance mitrale est responsable d’une surcharge volumique et d’une baisse de débit sanguin aortique. Afin d’y remédier, l’organisme met en place plusieurs systèmes compensateurs (figure 1) . I. B. 1 - activation du système adrénergique C’est le plus rapide à se mettre en place. La chute de pression ressentie par les barorécepteurs va induire l’activation du système nerveux sympathique qui se solde par une augmentation de la FC ( N de la fréquence sinusale ), de la contractilité par un effet inotrope β1 et une vasoconstriction des artérioles systémiques ( 22, 55, 58, 61). L’augmentation de la FC et de la contractilité améliore le débit et indirectement la pression artérielle sur laquelle la vasoconstriction agit directement. Cette première réponse se traduit par une compensation rapide et complète (61), cependant on constate rapidement une diminution des réponses inotrope et chronotrope positives par épuisement des réserves cardiaques en noradrénaline (61) mais aussi par un rétrocontrôle sur les récepteurs β1 qui sont internalisés (58). Il apparaît que chez l’IMC, 50 % des récepteurs β1 subissent ce phénomène dans les 3 jours suivant l’activation de ce système compensateur (58). A ce moment, la contractilité est meilleure mais pas suffisante pour assurer un débit cardiaque correct (58). Par conséquent, ce premier système restant temporaire, d’autres moyens permettent d’accroître ce débit, à plus long terme. La surcharge volumique est le mécanisme majeur par lequel le cœur compense cette affection. I. B. 2 - rein et système rénine – angiotensine – aldostérone ( SRAA ) La chute du débit et de pression va stimuler, dans le rein, la production d’hormones et accroître la rétention hydrosodée ( 13, 22, 55, 58, 61 ). Un système d’autorégulation rénal s’active dans un premier temps. La pression sanguine est restaurée grâce à une vasoconstriction réflexe des artérioles périphériques incluant les artères glomérulaires rénales afférentes. Les artères pré-glomérulaires sont très sensibles à la stimulation adrénergique (55, 61) et une part disproportionnée du flux sanguin est détournée du rein. Le flux sanguin rénal et la filtration glomérulaire diminuent alors, mais ceci est partiellement compensé par une augmentation de la fraction de filtration permettant au rein de maintenir sa fonction excrétoire. La capacité des tubes contournés proximaux à résorber la majeure partie des ions Na+ et des fluides isotoniques est conservée voire accrue. A ceci s’ajoute la baisse du volume 13 de filtration et de la perfusion rénale, ce qui est responsable de la rétention de la plus grande partie des fluides de l’organisme. Si le volume sanguin et le remplissage ventriculaire sont restaurés, un nouvel équilibre hémodynamique se met en place (58, 61). Les effets compensateurs rénaux sont amplifiés par le système rénine – angiotensine – aldostérone. La diminution de la perfusion rénale stimule des récepteurs sensibles à la pression et au volume situés dans l’artère afférente, ceux ci sont responsables de la libération de rénine (enzyme protéolytique synthétisée par les cellules juxta-glomérulaires). Cette libération est également stimulée par la baisse de la concentration en Na+ dans les tubes contournés distaux et par une action directe du système adrénergique sur les cellules juxta-glomérulaires (55, 61). La rénine induit la transformation d’une globuline sérique d’origine hépatique (55), l’angiotensinogène, en angiotensine I, elle même métabolisée en angiotensine II par une enzyme lors de son passage dans le poumon (22, 55, 61). L’angiotensine II est responsable d’une vasoconstriction artérielle et veineuse (22, 55, 61). La veinoconstriction améliore le retour veineux au cœur et, par là, accroît la précharge. La vasoconstriction aide à maintenir une pression artérielle satisfaisante mais diminue aussi la perfusion rénale (55, 61). A ce dernier point s’ajoute une diminution de l’ultrafiltration capillaire glomérulaire induite par une contraction des cellules mésangiales dans le glomérule, elle même due à l’angiotensine II. Ceci stimule à son tour le système d’autorégulation intra-rénal avec rétention hydrosodée (61). Parce que l’angiotensine II induit également la vasoconstriction de l’artère glomérulaire efférente, la pression de filtration est conservée malgré une baisse de la perfusion. L’hémodynamique intra-rénale est ainsi moins perturbée qu’on ne pourrait le croire (55, 61 ). En plus de son action vasopressive, l’angiotensine II favorise la rétention hydrosodée en augmentant la réabsorption sodique dans les tubules proximaux et en stimulant la sécrétion d’aldostérone, un minéralocorticoïde responsable de la réabsorption des ions Na+ en échange d’ions H+ ou K+ dans les tubes contournés distaux et les tubes collecteurs (55, 61). Cette augmentation globale de la volémie est entretenue par une sensation de soif qu’engendre l’angiotensine II et la libération de l’ADH (vasopressine) (55). L’ADH est une hormone synthétisée par l’hypophyse postérieure qui perméabilise l’épithélium du tube collecteur. Bien que sa sécrétion puisse être accrue lors d’IMC, celle ci ne joue pas un grand rôle dans la rétention hydrosodée (61). Cependant, pour des stades d’insuffisance mitrale évolués, elle peut être responsable d’une hyponatrémie par dilution (55). Les principaux effets de ce mécanisme sont ainsi une rétention hydrosodée avec augmentation de la volémie, la vasoconstriction artérielle et veineuse soit une augmentation de la précharge et de la postcharge (22, 55, 58, 61). L’augmentation de la volémie peut être telle qu’une hypoprotéinémie par dilution peut se développer avec une chute de la pression oncotique et formation d’œdèmes périphériques (61). 14 I. B. 3 - modification de la morphologie cardiaque La chambre ventriculaire gauche subit des modifications au cours de l’évolution de l’affection. La surcharge volumique, induite par le reflux mitral systolique, va accroître la tension de paroi ventriculaire. Le myocarde va, alors, s’adapter par une élongation et un glissement de ses cellules avec comme résultat une hypertrophie excentrique soit une dilatation de la chambre ventriculaire. L’épaisseur des parois rapportée au volume de cette chambre reste dans les normes voire est un peu diminuée bien que la masse musculaire soit accrue (61). Cette dilatation permet, pour une même pression de remplissage, d’augmenter le volume télédiastolique ventriculaire et ainsi d’améliorer le débit cardiaque (loi de Franck Starling) (22, 33). 15 I. B. 4 - le FAN Le SRAA ainsi que le phénomène d’autorégulation rénale servent, dans un premier temps, à préserver une pression artérielle adéquate ainsi qu’un débit cardiaque normal .Ces mécanismes sont utiles jusqu’à un certain point où leurs effets deviennent délétères sur l’évolution de l’IMC. S’oppose à ces mécanismes compensateurs, le facteur atrial natriurétique. Celui-ci induit une diurèse et une vasodilatation par action directe sur le rein et une inhibition du SRAA (55, 58, 61). Ce peptide est synthétisé par le tissu atrial. Le stimulus responsable de son activation est la dilatation de ce tissu et non l’augmentation de la pression intra-atriale ( 58, 61). Ainsi, lors d’IMC, la dilatation atriale induite par la régurgitation est responsable de la libération du FAN qui peut alors servir comme marqueur de la sévérité de la régurgitation dans l’atteinte cardiaque (58). L’activité du FAN paraît être liée à l’interaction avec des récepteurs spécifiques (NPRA et NPR-B) eux mêmes interagissant avec la guanosine monophosphate cyclique. Sa demi-vie est très courte (quelques minutes) ce qui semble être imputable à une endopeptidase ou à un autre récepteur (NPR-C) (58, 61). Malgré l’augmentation de sa concentration lors d’IMC, le FAN ne permet pas de rétablir l’hémodynamique et la natriurèse que les mécanismes compensateurs sont venus perturber (58, 61). I. C - EVOLUTION DE L’IMC La réduction du flux aortique active une série de mécanismes compensatoires (rénal, hormonal, neural) afin de maintenir une pression artérielle et un volume circulant adéquates. Ces mécanismes sont efficaces et capables de maintenir le débit cardiaque pendant une période plus ou moins indéfinie de temps (88). Cependant, cet équilibre est fragile et instable (13). En effet, ces mécanismes bien que bénéfiques à court terme, participent à accélérer l’évolution de la maladie. I. C. 1 - le volume régurgité Celui-ci dépend de la postcharge, du degré de dilatation de l’anneau mitral et de la déformation des feuillets de la valve (88). Il évolue plus ou moins lentement suivant le rythme de dégénérescence. L’hypertrophie excentrique du ventricule gauche, suite à la surcharge volumique, va se solder par une dilatation de l’anneau mitral et un mauvais alignement des muscles papillaires. Ces deux phénomènes sont responsables de la modification de la coaptation des feuillets de la valve et, ainsi, de l’aggravation de la régurgitation ( 58, 61, 88 ). La compliance ventriculaire ne pouvant s’accroître éternellement, il arrive un moment où la pression télédiastolique ventriculaire va augmenter, accentuant encore le reflux. La vasoconstriction, induite par les mécanismes compensateurs, se solde par une postcharge plus importante donc une plus grande difficulté pour le ventricule à éjecter le sang dans l’aorte et une accentuation de la régurgitation (88). Cette augmentation du volume régurgité se fait, dans la plupart des cas, de façon insidieuse (88). L’atrium gauche subit alors des modifications visant à contenir cette surcharge volumique avec une hausse de pression minime. La pression intra-atriale dépend de la compliance et du volume de l’oreillette (88). C’est ainsi que l’on observe 16 une dilatation de l’atrium gauche dont la sévérité est le reflet de l’importance du volume régurgité (58, 88). Ce mécanisme limite l’apparition d’une hypertension en amont du cœur donc au niveau des veines puis des capillaires pulmonaires responsable d’une densification vasculaire des poumons visibles à la radiographie voire du développement d’un œdème pulmonaire. Dans le cas d’IMC évoluant lentement, les signes de congestion pulmonaire peuvent alors se manifester tardivement (58, 61, 88). A l’inverse, lors d’augmentation brutale de la pression intra-atriale suite à une rupture de cordage d’un feuillet, la pression des capillaires pulmonaires s’accroît rapidement et se solde par un œdème pulmonaire aigu ( 58, 61, 88 ). Cette augmentation de pression rétrograde peut être à l’origine d’une hypertension artérielle pulmonaire (dans le cas d’IMC avancée (88)). Cette hausse de postcharge pour le ventricule droit va induire des modifications, avec une évolution possible vers une insuffisance cardiaque droite (ascite, effusion pleurale, œdème sous cutané) (58, 61, 88). La dilatation de l’atrium peut être telle qu’il peut comprimer la bronche souche gauche induisant l’apparition d’une toux (2, 13, 22, 55, 58, 61, 88). Mais plus grave, cette dilatation atriale, et moins fréquemment celle du ventricule, peut être à l’origine de tachyarythmies notamment des tachycardies supraventriculaires, flutter atrial, fibrillation atriale et tachycardie ventriculaire. Ces tachyarythmies peuvent être elles mêmes responsables d’une chute du débit et contribuer ainsi à une dysfonction du myocarde (58, 61, 88). I. C. 2 - la contractilité du myocarde L’évolution de la contractilité du myocarde, dans l’insuffisance mitrale, est un sujet mal étudié. On sait, cependant, que l’IMC se complique, à plus ou moins long terme, d’une altération de l’inotropisme cardiaque pour les raisons précédemment citées. Toute surcharge mécanique entraîne une baisse de la contractilité participant à la décompensation cardiaque gauche (13, 61). On distingue donc deux phases dans l’IMC, une première au cours de laquelle l’inotropisme est conservé. Cette phase peut être longue, jusqu’à des stades sévères d’insuffisance (2, 58, 61). La seconde, dont on ne connaît pas avec exactitude le moment d’apparition, est caractérisée par un effondrement de l’inotropisme (13, 58, 61). Il est communément accepté que l’inotropisme n’est pas un facteur déterminant dans l’évolution de l’IMC ( 2, 13, 22, 55, 58, 61, 98). Ceci est vrai chez les chiens de petite taille. Au contraire, chez les animaux de grande taille, les études montrent que la baisse de la contractilité est fréquente et plus rapide, de même que chez l’homme (58). Cette différence d’évolution entre petite et grande race est d’origine inconnue (58). L’insuffisance mitrale semblerait évoluer, irrémédiablement, vers l’insuffisance cardiaque. Il faut, cependant, être capable d’estimer le degré d’atteinte de l’appareil cardiovasculaire ainsi que les répercussions de l’affection sur les paramètres hémodynamiques qui vont permettre de juger de la conduite à tenir pour l’anesthésie. 17 II - ANAMNESE ET EXAMEN CLINIQUE II. A - ANAMNESE La connaissance de l’historique du patient et du rythme d’évolution de l’affection cardiaque est primordiale dans l’anamnèse et doit faire l’objet d’une attention particulière (76). C’est ainsi que l’on recueille les signes de maladies intercurrentes, notamment la présence d’atteinte pulmonaire ou rénale, ou de troubles endocriniens (hyper- et hypothyroïdie, hyper- et hypoadrénocorticisme) (76). En dehors de tout problème cardiaque, l’âge et la race trouve aussi leur importance afin de déterminer d’éventuelles précautions anesthésiques. Par exemple, les brachycéphales présentent fréquemment une réaction vagale lors de l’intubation, ils méritent une préoxygénation car leur voile du palais est long et le diamètre de leur trachée faible. Les races miniatures présentent un réel risque d’hypothermie de part leur faible taille par rapport à leur surface corporelle. Chez les lévriers et races apparentées, les barbituriques sont à éviter (7). L’IMC se développe en moyenne vers 6-9 ans chez le chien mais les signes de décompensation cardiaque apparaissent vers 10-12 ans (58, 61, 88, 98). L’évolution de cette affection se fait dans la plupart des cas de manière chronique (55). Mais ceci reste variable, en effet, la décompensation peut se déclarer au bout de 1-2 ans, cas de figure le plus fréquent chez le cavalier king charles spaniel vraisemblablement prédisposé à ce type d’atteinte cardiaque et la développant très jeune, une étude a montré que 10 % des animaux de cette race de moins de 1 an présentaient un souffle d’IM (55). La liste des signes cliniques que présente l’animal, permet d’évaluer grossièrement les répercussions de l’insuffisance mitrale sur l’organisme : présence de toux, fatigabilité accrue voire intolérance à l’effort, syncopes épisodiques, perte de poids, présence d’ascite, dyspnée plus ou moins marquée. Tous ces symptômes peuvent être rattachés à l’IMC. La toux est le plus prompte à se développer lors d’IMC, elle est due à la compression de la bronche souche gauche. L’intolérance à l’effort ou une fatigabilité excessive sont le signe d’une baisse du débit cardiaque de même que les syncopes (résultat d’une arythmie passagère ou d’une vasodilatation prononcée) (55, 58, 88). Lors d’IMC avancées, œdème pulmonaire et ou ascite et épanchement pleural par insuffisance cardiaque droite peuvent venir assombrir le pronostic et surenchérir les problèmes respiratoires. Le traitement mis en place ainsi que son efficacité à faire disparaître les signes cliniques sont aussi à prendre en compte. Un patient recevant des diurétiques à fortes doses quotidiennement sera plus prompt à développer un œdème pulmonaire durant l’anesthésie, un animal sous antiarythmique aura plus de risque de déclencher un trouble du rythme, s’il reçoit des IEC ou des digitaliques, on pourra requérir l’utilisation d’agents inotropes (76). De plus furosémide et digoxine affectent l’hémostase de manière plus ou moins marquée selon la dose et l’individu, les IEC la trouble également du fait de la diminution de la vasoconstriction qu’ils engendrent (7). Suite au recueil des commémoratifs, un examen clinique est pratiqué et permet d’apprécier plus précisément le degré d’atteinte cardiaque et de mettre en évidence d’autres anomalies. 18 II. B - EXAMEN CLINIQUE ( tableau I ) II. B. 1 - considérations générales a - observation Celle-ci est faite à distance afin d’éviter les éventuelles modifications suite au stress induit par la manipulation. On peut estimer, globalement, l’état général de l’animal et s’il compense plus ou moins bien son insuffisance mitrale. Sont évalués sa vigilance, sa fatigabilité, son état d’embonpoint (animal amaigri ou cachectique). Les signes respiratoires telle qu’une polypnée ou une dyspnée voire une discordance peuvent également être notés lors de cette phase. Ce temps observatoire permet déjà de classifier le type de dyspnée en remarquant un déséquilibre entre les phases inspiratoire et expiratoire. Une dyspnée inspiratoire (phase inspiratoire allongée) signe une atteinte de l’arbre respiratoire supérieur de type obstructive ou une atteinte de type restrictive à l’expansion pulmonaire. Une dyspnée expiratoire (phase expiratoire exagérée) est révélateur d’une atteinte respiratoire intrathoracique. 19 L’animal est ensuite posé sur la table d’observation et l’attention portée sur plusieurs points . - La couleur des muqueuses, notamment. Normalement roses, celles-ci peuvent être pâles ou cyanosées dans le cas d’IM décompensée. La couleur dépend de plusieurs facteurs parmi lesquels l’état d’oxygénation du sang, bien sûr, mais aussi de la perfusion de la muqueuse. En cas d’anémie, avec un taux d’hémoglobine inférieur à 5 g / dl, on n’observe pas de cyanose même pour des valeurs basses de HbO2 (76). Lors d’IMC, les mécanismes compensateurs, en particulier la stimulation adrénergique, induisent une vasoconstriction des territoires vasculaires périphériques et ainsi une diminution de la perfusion des muqueuses (gingivales notamment). Par conséquent, il est fréquent d’avoir des muqueuses un peu plus pâles mais aussi des extrémités du corps plus froides (61). - Le temps de recoloration capillaire est un indicateur de la perfusion tissulaire et de la pression sanguine périphérique. Il doit être compris entre 1 et 2 secondes. Un TRC augmenté révèle un déficit du débit cardiaque ou une hypotension marquée. - La recherche de répercussions d’une insuffisance cardiaque droite ( uniquement présente lors d’IMC très avancée ) doit être poursuivie, notamment présence d’œdèmes périphériques, d’ascite ou d’un pouls jugulaire (58, 61, 88). Une distension de la veine jugulaire est notée lors d’IMC avancée avec répercussion droite et hypertension pulmonaire (88). b - palpation Le pouls fémoral est palpé, en même temps que l’auscultation cardiaque est réalisée. On note sa fréquence, son intensité, sa régularité, sa symétrie et son synchronisme avec la systole ventriculaire. Un déficit pulsatile renseigne sur la présence d’une éventuelle arythmie (le temps de diastole ventriculaire est raccourci, le remplissage est faible d’où le déficit pulsatile). Il s’agit fréquemment d’une tachycardie supraventriculaire ou ventriculaire, le diagnostic est vérifié par la réalisation d’un ECG. Dans le cas d’IMC légère à modérée, le pouls est généralement peu modifié. Il est souvent bien frappé, bondissant (6, 57, 58, 88). En effet, lors d’IMC, le ventricule gauche doit se contracter rapidement et violemment afin d’éjecter son contenu dans l’aorte. S’il se contractait lentement, une plus grande partie du sang serait éjectée dans l’atrium gauche (58). La palpation du choc précordial permet d’évaluer la vigueur de la contraction cardiaque mais aussi de noter la présence d’un thrill ou frémissement cataire, utile dans la classification des souffles ( il est associé à une IM plus sévère ou chronique ) (88). La palpation abdominale peut mettre en évidence la présence d’ascite avec un signe du flot positif mais aussi une hépatomégalie éventuellement induite par une insuffisance cardiaque droite consécutive à l’IMC (61). II. B. 2 - appareil respiratoire Une attention particulière doit être portée à ce système car l’IMC s’exprime en partie par des signes respiratoires. C’est même parfois un motif de consultation avant même la connaissance du problème cardiaque (13, 57, 58, 61, 88). L’IMC est à l’origine de modifications cardiaques et hémodynamiques se répercutant sur l’appareil respiratoire du fait de sa promiscuité et étroite relation avec le cœur. L’augmentation de la taille du cœur (suite à l’hypertrophie excentrique) diminue les possibilités d’expansion des poumons, la congestion pulmonaire suite à l’hypertension 20 rétrograde peut induire une réduction du diamètre des voies respiratoires et accroître leur irritabilité. L’œdème interstitiel ou alvéolaire consécutif à cette hypertension diminue la compliance pulmonaire et sa capacité résiduelle fonctionnelle. De plus, l’hypoperfusion (toujours consécutive à l’hypertension pulmonaire) est à l’origine d’une élévation du rapport ventilation / perfusion avec augmentation de l’espace mort anatomique (76). Le premier signe respiratoire à apparaître suite à l’IMC est une toux. Celle-ci résulte de la compression de la bronche souche gauche (13, 57, 58, 61, 88) et ou de celle du lobe accessoire (58), voire de la compression du nerf laryngé récurrent (88). Les individus présentant uniquement cette compression ont une toux paroxystique, plutôt forte, qui s’exacerbe avec l’exercice (88). Ils ne développent pas, dans la majorité des cas, de tachypnée, dyspnée ou orthopnée ni d’intolérance à l’exercice, baisse de forme ou d’appétit (88). La toux peut également provenir d’un œdème interstitiel ou alvéolaire (2, 13, 57, 58, 88) du fait de l’excès de production de mucus et de l’augmentation de pression sur les bronches et les bronchioles. Ces individus manifestent alors une polypnée et une dyspnée (13, 57, 58, 88). Cette toux serait plus fréquente la nuit (ceci est un peu exagéré par rapport à la médecine humaine) et exacerbée à l’exercice. Ces patients sont très souvent moins alertes et hyporexiques (88). L’auscultation pulmonaire de l’IMC donne des résultats variables (58, 88). Chez le patient ne présentant pas de signes cliniques, elle est normale. Pour le chien présenté en consultation pour une toux, elle peut être également normale ou révéler la présence de sifflements et crépitements (58). Le chien présentant un œdème pulmonaire et une polypnée donne fréquemment une auscultation où l’on note uniquement une augmentation des bruits broncho-vésiculaires due à l’accélération des mouvements des gaz au travers des grosses voies respiratoires (57, 58). Certains de ces animaux présentent néanmoins des crépitements fins ou grossiers (2, 57, 58, 88). Ceci est plus fréquent dans le cas d’IMC sévère où le liquide d’œdème remplit les voies aériennes. Malgré tout, il est possible d’obtenir une auscultation normale sur ces mêmes animaux (88). Une étude a permis de montrer que seulement 68 % des animaux développant un œdème sévère, présentaient des crépitements à l’auscultation (58). A noter, également, qu’un épanchement pleural suite à une insuffisance cardiaque droite (suite à l’IMC) peut induire une absence de bruit pulmonaire en région ventrale. Le clinicien doit, cependant, rester prudent car une toux chez un animal présentant un souffle d’insuffisance mitrale ne doit pas faire conclure immédiatement à une origine cardiaque (13, 58). En effet, la toux est une séquelle fréquente de maladies respiratoires antérieures (57, 58, 88) et les chiens âgés de petite taille (malheureusement, ceux présentant le plus fréquemment une IMC) développent souvent une maladie respiratoire concomitante (58, 88). L’auscultation ne permet pas de différencier les deux origines car des atteintes purement respiratoires peuvent donner une auscultation identique (2, 57, 88). Les signes peuvent même résulter d’une synergie. Par exemple, la dilatation de l’atrium gauche ne permet normalement pas de collaber la bronche souche gauche juste par la compression. Cependant, la bronchomalacie est une atteinte fréquente chez le chien âgé de petite taille. L’association de ces deux affections est à l’origine du collapsus et d’une toux réfractaire au traitement (58). 21 L’examen de l’appareil respiratoire permet ainsi de révéler certains problèmes et d’évaluer leur sévérité mais, hélas, ne permet pas de conclure quant à leur origine (respiratoire ou cardiaque). Il faut pour cela recourir aux examens complémentaires, notamment la radiographie (2, 58). 22 Tableau I : insuffisance mitrale et statut clinique Stade d’IMC Intensité de souffle Toux dyspnée Crépitements pulmonaires I (N = 20) II (N = 25) III (N = 43) IV (N = 18) I – III II – IV II – IV III – VI (-) 33% 80% 100% (-) 8% 35% 68% Faiblesse syncope Hépatomégalie des stase jugulaire postérieurs (-) (-) (-) 20% 8% (-) 37% 9% (-) 87% 50% 65% D’après AMBERGER C. GLARDON O. LOMBARD CW (2 ) 23 II. B. 3 - appareil cardiovasculaire Dans un premier temps, l’IM ne se caractérise, cliniquement, que par la présence d’un souffle (2, 13, 21, 57, 58, 88). Il est pratiquement toujours audible si l’IM est assez sévère pour induire une éjection rétrograde significative (58). A l’auscultation, il est d’abord entendu du côté gauche du thorax en région apéxienne (2, 13, 21, 58, 88, 96) en regard des espaces intercostaux 5 à 7 (2, 21, 63). Ce souffle est secondaire aux vibrations créées par le flux sanguin turbulent qui retourne dans l’atrium gauche lors de la systole. Du fait de la direction ventro-dorsale du jet, on pourrait penser le percevoir dans les parties supérieures du thorax. Le tissu pulmonaire se charge d’atténuer le son, c’est pourquoi le souffle n’est pas audible dans ces régions alors qu’il l’est en région de l’apex cardiaque du fait de sa contiguïté avec la paroi costale (58). Le souffle est, dans les premiers stades de l’affection, protosystolique puis évolue en augmentant sa durée et son intensité. En effet, il devient holosystolique (couvre toute la systole) puis pansystolique (couvre toute la systole et le second bruit B2) (2, 21, 57, 58, 88). La régurgitation commence dès que le ventricule se contracte et que sa pression interne surpasse celle dans l’atrium. Par conséquent, elle débute juste après le premier bruit. Elle se poursuit jusqu’à ce que la pression intra-ventriculaire retombe sous celle intra-atriale. Ceci intervient après que la pression dans le ventricule soit passée sous celle dans l’aorte (moment où l’on entend B2). C’est pourquoi, le souffle d’IM couvre fréquemment le second bruit cardiaque (57, 58). Le souffle varie également par son aire d’auscultation. A l’origine très circonscrite, elle peut évoluer très largement, en particulier vers la droite, caudalement et dorsalement (2, 58, 88). Un souffle perceptible à droite peut résulter de l’IM, par une irradiation large de la zone d’auscultation, ou d’une insuffisance tricuspidienne compliquant l’IM. Il est difficile de distinguer les deux types de souffle. La présence d’un pouls jugulaire peut aider au diagnostic. Le souffle d’IM est un mélange de basses et hautes fréquences (88). L’existence de bruits à haute fréquence mésosystolique a été rapportée, particulièrement dans les stades initiaux de l’affection (58, 88). Il s’agit d’un petit bruit sec systolique qui ne doit pas être pris pour un bruit de galop. En effet, il est de sonorité plus aiguë et un phonocardiogramme permet de différencier un bruit diastolique (bruit de galop), d’un systolique. Ce bruit est induit, chez l’homme, par le prolapsus de la valve mitrale. Bien que ceci puisse se produire chez l’animal et être identifié par échocardiographie, il n’a pu être retrouvé chez tous ceux présentant ce bruit systolique (58). Lors de rupture de cordage, un souffle musical ou vibrant peut être entendu (21, 58). Le souffle est classé selon son intensité en 6 grades différents, allant du souffle difficilement audible à celui perceptible sans stéthoscope. Les stades 5 et 6 sont caractérisés par la présence d’un frémissement cataire. Cette classification reste, cependant, subjective (63). Alors que la majorité des cardiologues insistent sur le fait que l’importance du souffle n’est pas corrélé à la gravité de l’affection (2, 13, 63), certains suggèrent qu’elle correspondrait grossièrement à la sévérité de la maladie (58). KITTELSON souligne que, dans une étude, tous les chiens présentant un souffle de grade 2/6 ou moins étaient moyennement atteints alors que pour un grade de 5 ou 6/6 l’insuffisance mitrale était déjà à un stade avancé. Dans cette même étude, l’intensité du souffle augmentait avec l’évolution de la maladie (58). 24 L’intensité dépend toutefois de nombreuses variables, celles-ci incluent l’intensité du même souffle à son origine, la direction du flux turbulent, la nature du tissu entre le flux et la zone auscultée, la fréquence du souffle ( haute ou basse ), la qualité du stéthoscope et les compétences du clinicien. Cette relation entre intensité du souffle et sévérité de l’atteinte n’aurait alors de finalité que pour l’évaluation, par un même praticien, de l’évolution de l’affection chez le même animal sur une longue période (58). Tableau II : classification du stade de l’atteinte cardiaque ( New York Heart Association ) L’atteinte cardiaque n’induit pas de réduction de l’activité physique, une activité normale ne produit ni fatigue ni dyspnée ni toux L’atteinte cardiaque ne produit pas de signes cliniques au repos mais une activité physique ordinaire cause fatigue, dyspnée ou toux L’atteinte cardiaque ne produit aucun symptôme au repos mais une activité minime cause fatigue, dyspnée ou toux Les symptômes de défaillance cardiaque congestive sont présents au repos. ces signes sont exacerbés lors de l’exercice Stade I Stade II Stade III Stade IV D’après MUIR WW (76) 25 L’auscultation cardiaque permet également de déterminer la FC qui donne une indication indirecte de l’état de compensation ventriculaire (2). La FC est généralement accrue par rapport à la normale du fait de la stimulation du système adrénergique (2, 57). Cette tachycardie a un effet direct sur l’organisation des myofibrilles ventriculaires et est en partie responsable de la décompensation (2). De plus, une FC élevée, soutenue, de l’ordre de 240-260 bpm aboutit à une défaillance myocardique car accroît les besoins en O2 du muscle cardiaque tout en réduisant la diastole donc le temps de perfusion de ce dernier (22). Enfin, l’auscultation, aidée par la palpation du pouls fémoral, offre la possibilité de discerner d’éventuelles anomalies du rythme cardiaque (58, 88). La tachycardie sinusale est le rythme dominant chez l’IMC (22). Les tachyarythmies, plus particulièrement des contractions prématurées d’origine supraventriculaire, sont plus fréquentes dans les stades avancés d’IMC (58, 88). Flutter et fibrillation atriaux sont également possibles. Les contractions prématurées d’origine ventriculaire sont plus rarement notées (88). La fibrillation atriale comme les tachycardies ventriculaires se caractérise par des B1 d’intensité variable, des B2 présents ou absents et des B3. Il n’existe pas de méthodes pour différencier, par la simple auscultation, une contraction prématurée d’origine supraventriculaire et ventriculaire, ceci requiert l’utilisation d’un électrocardiographe. Les commémoratifs et l’examen clinique permettent déjà de classer les animaux en 4 catégories. La classification de la NYHA (tableau II) se base uniquement sur les signes cliniques présentés par l’animal ainsi que leur tolérance à l’effort (76). Les recommandations thérapeutiques suivent la même classification. Ainsi, les patients de stade I ne reçoivent aucune prescription alors que ceux de stade IV reçoivent au minimum diurétiques, IEC et substances inotropes. Cependant, on a pu constater que l’anamnèse et l’examen clinique présentaient quelques lacunes dans l’évaluation de l’IMC et de ses répercussions tant cardiaques que sur les autres appareils, en particulier l’appareil respiratoire. Il convient alors d’effectuer des examens complémentaires afin de préciser l’état du patient et ainsi les risques encourus lors de l’anesthésie. On compte parmi ceux-ci la radiographie, l’échocardiographie, l’électrocardiographie et les examens biochimiques. III - LES EXAMENS COMPLEMENTAIRES III. A - LA RADIOGRAPHIE La radiographie est, encore aujourd’hui, l’examen complémentaire le plus fréquemment réalisé dans l’étude des affections cardiaques des carnivores domestiques. C’est une technique peu onéreuse, non invasive, à la disposition de tous les cabinets vétérinaires. L’augmentation de taille de la silhouette cardiaque est le signe radiographique le plus souvent rencontré lors de cardiopathie, la difficulté se pose lors de cardiomégalie légère ou moyenne où il n’est pas aisé de les différencier d’une image normale (4, 53). L’IMC induit des modifications de la silhouette cardiaque dans un premier temps mais se répercute, au cours du temps, sur l’appareil respiratoire. C’est pourquoi l’examen du cœur ainsi que des champs pulmonaires reste essentiel. 26 Tableau III : insuffisance mitrale et modifications radiographiques Stade Aucu dilatatio Cardio Cardio Congestio Œdème È taille de collaps Compre d’IM n nAG n pulmonair la veine cave ustrach s-sion C signe mégali mégali veineuse e caudale et éal de la e e pulmonair hépatomégal BSG gauche droite e ie I 40% 40% 15% 5% (-) (-) (-) 10% 0% II 44% 36% 36% 40% 10% (-) (-) 16% 8% III 29% 81% 81% 58% 75% 60% 60% 12% 23% IV 0% 100% 100% 83% 100% 100% 100% 6% 67% D’après AMBERGER C, GLARDON O, LOMBARD CW (2) 27 Tableau IV : signes radiographiques de cardiopathie gauche ( silhouette cardiaque ) Atrium Ventricule Aorte Profil 1- soulèvement de la partie distale de la trachée 2- compression de la bronche souche gauche ( BSG ) et bifurcation trachéobronchique 3- direction verticale ou caudale du bord cardiaque caudo-dorsal 4- image de forme ovoïde ou triangulaire en arrière de la bifurcation trachéobronchique en continuité avec le bord caudal cardiaque 5- encoche à 2H entre atrium et ventricule gauche 6- trachée devenant parallèle à la colonne vertébrale 7- diamètre du cœur gauche > à ½ diamètre du cœur droit 8- redressement du bord cardiaque caudal 9- bombement du bord cardiaque cranio-dorsal Face 10- ectasie entre 2h et 3h ( auricule gauche) 11- diminution de la distance cœur – paroi thoracique gauche 12- bord cardiaque gauche arrondi 13- apex arrondi 14- projection plus crânial de l’arc aortique ( 11 h à 1 h ) D’après GAILLOT H et BEGON D (30) Fig 2 : modifications radiographiques de la silhouette cardiaque lors de ardiopathie gauche D'après GAILLOT H et BEGON D (30) 29 III. A. 2 - signes radiographiques pulmonaires de l’IMC(tableau V) Cette étape est très importante car elle permet de déterminer la présence de signes de décompensation de l’IM (2, 58, 88). Le premier élément radiographique de l’œdème pulmonaire est la présence d’une hypertension veineuse avec une dilatation des veines pulmonaires centrales. En effet les veines pulmonaires périphériques subissent une dilatation moindre voire aucun changement (53). Normalement les vaisseaux ne doivent pas dépasser le diamètre de la 3ème côte en vue de profil ou celui de la 9ème côte en vue de face à l’endroit où ils les croisent (30). Ces veines deviennent plus évidentes dans les champs pulmonaires, leur diamètre est plus important que celui des artères accompagnatrices (88, 96). L’hypertension veineuse évoluant, les fluides engorgés exsudent des vaisseaux vers les tissus adjacents. Les structures périveineuses que sont les bronches, bronchioles et artères attirent le fluide par capillarité (88). On note alors une augmentation de la densité, de type interstitielle, qui masque les marges des vaisseaux (53, 88, 96) mais souligne les parois des voies aériennes (augmentation de la densité péribronchique) (88, 96). Le stade ultérieur est l’envahissement des alvéoles par le liquide d’œdème donnant comme aspect radiographique, une densité « cotonneuse » (88). Le fluide n’envahit les bronches que dans le cas d’œdème grave, c’est pourquoi, fréquemment, elles sont encore visibles et donnent ces images de bronchogramme (30, 53, 88, 96). Ces changements sont plus apparents et se développent en premier lieu en zone périhilaire des lobes caudal (30, 88) et apical droit (88) donc ils sont plus visible sur la radiographie de profil que sur celle de face. L’existence d’une densité péribronchique ne doit pas automatiquement faire conclure à la présence d’un œdème pulmonaire, en effet, c’est également une modification retrouvée lors de maladies respiratoires chroniques. Si ce type de densification est observé, c’est la mise en évidence d’autres signes d’IM tel que la dilatation veineuse et atriale qui permettra de suspecter une origine cardiaque (53, 88). Un épanchement pleural peut aussi se développer lors d’IMC (2, 13, 53, 88). On observe alors un obscurcissement de la silhouette cardiaque ventrale et de la coupole diaphragmatique. L’espace entre le lobe pulmonaire caudal dorsal et la colonne augmente. Ce fluide, se glissant entre deux lobes, souligne cette scissure sous forme d’une ligne pleurale (30, 53, 88). Plus l’épanchement est important moins le cœur est visible et les poumons plus comprimés. La mise en évidence d’une congestion des artères pulmonaires et ou de la veine cave caudale (voire une hépatomégalie (21, 30, 88)) doit faire penser à une répercussion déjà importante de l’IMC sur le cœur droit (2, 53, 88). 30 Tableau V : signes radiographiques pulmonaires des 3 phases le l’insuffisance cardiaque gauche Phases Congestion pulmonaire Signes radiographiques - Augmentation de la taille des veines pulmonaires par rapport aux artères - Augmentaion de la radiodensité du champ pulmonaire hilaire Œdème pulmonaire Vaisseaux pulmonaires à contour flou interstitiel - Parois bronchiques épaissies et densification péribronchique - Augmentation marquée de la radiodensité pulmonaire Œdème pulmonaire alvéolaire masquant les vaisseaux périhilaires et pouvant s’étendre à la périphérie - Densification pulmonaire floconneuse, en plages coalescentes - Apparition de bronchogrammes de petite taille D’après GAILLOT H et BEGON D (30) 31 III. B - L’ECHOCARDIOGRAPHIE Depuis l’avènement des rayons X et de l’imagerie radiographique, l’imagerie par les ultrasons a changé la vision par laquelle l’anatomie cardiaque était cliniquement évaluée. Par sa capacité à différencier les liquides des structures tissulaires, l’échographie du cœur est complémentaire de la radiographie. Du fait de la rapidité du renouvellement des images (balayage rapide), cette technique autorise l’observation de la dynamique du cœur au cours du cycle cardiaque. Le mode doppler ajoute la possibilité de visualiser la direction des flux, d’apprécier les vitesses et de caractériser leur nature (laminaire ou turbulent). Ainsi l’échocardiographie permet d’évaluer l’anatomie intracardiaque, la fonction cardiaque et de caractériser les flux sanguins. C’est pourquoi, elle a supplanté le cathétérisme cardiaque comme méthode d’évaluation des paramètres cardiaques. Bien qu’elle soit un outil puissant, l’échocardiographie doit être considérée comme une partie de l’examen de l’appareil cardiovasculaire et n’autorise pas à délaisser l’examen clinique. III. B. 1 - mode bidimensionnel ( 2D ) a - principales coupes anatomiques utilisées Les ultrasons sont dispersés par l’air et ne peuvent traverser les os, par conséquent les images ne peuvent être obtenues que via une zone où le cœur est en contact avec la paroi thoracique. Ces zones sont appelées fenêtres du fait de leur étroitesse. Il existe 3 fenêtres anatomiques offrant la possibilité de visualiser le cœur (50). - la voie parasternale droite, entre le 3ème et le 6ème espace intercostal et entre le sternum et la jonction chondro-costale. - la voie parasternale gauche caudale (apicale) entre le 5ème et le 7ème espace intercostal aussi près du sternum que possible. - la voie parasternale gauche craniale entre le 3ème et le 4ème espace intercostal entre le sternum et la jonction chondro-costale. Les coupes obtenues peuvent ensuite être orientées selon le grand axe du cœur (axe ventricule gauche / aorte) ou le petit axe (plan perpendiculaire au grand axe) (figure 3) (15). Les coupes les plus utilisées en voie parasternale droite sont la coupe dite en champignon ( petit axe ), trans-papillaire, visualisant les ventricules, celle visualisant la racine de l’aorte et l’atrium gauche ( elle aussi en petit axe ), la coupe trans-mitrale, la coupe trans-aortique ( figure 4, 5, 6, 7 ) et les coupes visualisant les 4 cavités cardiaques ( VG, AG, VD, AD ) avec ou sans le départ de l’aorte utilisant une coupe grand axe ( figure 8, 9a, 9b ) (15). 32 Fig 3 : grand et petit axe cardiaque Fig 4 : plans de coupe petit axe Fig 6 : coupe petit axe au niveau des cordages Fig 5 : coupe petit axe transpapillaire (dite en champignon ) Fig 7 : coupe petit axe transmitrale D'après CHETBOUL V et POUCHELON JL (15) 33 Fig 8 : plan de coupe grand axe Fig 9 : exemples de coupe bidimensionnelle en grand axe a- coupe cinq cavités b- coupe quatre cavités D’après CHETBOUL V et POUCHELON JL (15) 34 Tableau VI : insuffisance mitrale et modifications échocardiographiques Stade d’IMC I II III IV Echograp AG/AO hie >1 (2D ou normale TM) 20% 8% 1% 20% 64% 75% 100% PLVG (%FE) N N N P Modificatio ESVI n valvulaire ( ml/m2 ) 80% 88% 99% 100% N N N N FR ( % ) N N N/N N/N Cinétique ventricula ire gauche (2D) N 49% N 66% N 80%P 10% N D’après AMBERGER C, GLARDON O, LOMBARD CW (2) 35 b - modification engendrées par l’endocardiose ( tableau VI ) Le mode bidimensionnel autorise le clinicien à examiner l’anatomie des feuillets, noter toute augmentation de l’épaisseur, de l’échogénicité de ceux-ci ainsi que l’apparition d’irrégularités ou de phénomènes fibrosants, apprécier la sévérité de l’atteinte de ces valvules (les sites les plus fréquemment atteints se trouvent sur la moitié dorsale du feuillet septal (85)) et l’état des cordages tendineux (2, 10, 13, 14, 17, 88). Il permet également de vérifier la présence ou absence d’un prolapsus ou l’existence de vibrations d’une partie des valvules (2, 10, 50). Le prolapsus est défini comme une partie de la valve faisant protrusion à l’intérieur de la cavité atriale au cours de la systole. Les vibrations résultent des mouvements d’un bord libre de la valve dans l’atrium gauche lors de la systole, ceci se rencontrant suite à une rupture de cordage. Il arrive, également, de visualiser ces cordages rompus surtout s’ils sont modifiés par l’endocardiose (13, 14, 17, 50, 88). Aucune étude n’a porté sur la relation entre le degré de modification de la morphologie valvulaire et la sévérité de la régurgitation mitrale (86). Cependant, on sait que la dégénérescence des valvules et des cordages mène à un prolapsus de la valve mitrale (85, 86, 94). L’incidence du prolapsus dépend de la durée de l’affection mais aussi de la race. Chez le cavalier king charles spaniel, 84 % des cas IMC présentaient un prolapsus (94), une autre étude révélait environ 60 % de prolapsus chez les IMC (93). La sévérité de ce prolapsus peut être estimée par l 0 7(cer l 0TD0.00ia]TJ-17.924 -1.15 TD0.000 36 respectives. On peut, également, se rendre compte de l’atteinte de la dynamique cardiaque (21, 58, 88). Dans un premier temps, le ventricule gauche est hyperkinétique avec des mouvements amplifiés de la paroi ventriculaire libre. Les espaces péricardique et pleural peuvent aussi être visualisés lors d’épanchements (58, 61, 88). 37 Fig 10 : les quatres coupes de Feigenbaum Fig 11 : coupe 2 de Feigenbaum à partir d'une coupe 2D petit axe Fig 12 : coupe 2 de Feigenbaum ( transventriculaire ) et son mode Temps-Mouvement Fig 13 : coupe 3 de Feigenbaum ( trans-mitrale ) et son mode Temps-Mouvement D'après CHETBOUL V et POUCHELON JL (15) 38 Le mode bidimensionnel permet une bonne évaluation et examen de l’anatomie cardiaque, les volumes et mouvements ne sont que qualitativement estimés. Cependant, il est limité par sa mauvaise résolution surtout pour les petites structures et les mouvements rapides. Le mode TM offre la possibilité de visualiser ces mouvements rapides et fins car sa fréquence de renouvellement des images est plus importante et une meilleure résolution autorise des mesures plus précises. III. B. 2 - Mode TM a - Principales « coupes » utilisées C’est le mode temps – mouvement. Celui-ci requiert un faisceau unique traversant le cœur telle une aiguille. Il permet de visualiser les structures cardiaques : épaisseur des parois, taille des chambres ventriculaires et leur évolution au cours du cycle cardiaque. L’enregistrement simultané d’un ECG sert de référence à ce dernier. Ce mode est appliqué à une coupe petit axe voie parasternale droite transventriculaire dite « coupe en champignon », visualisant la racine des muscles papillaires, le septum interventriculaire et le ventricule gauche. L’identification des structures est basée sur l’image mentale du trajet du faisceau et la connaissance de l’anatomie normale et pathologique du cœur. Un guide permet de repérer le trajet du faisceau (figure 10, 11). Il est optimal lorsqu’il est perpendiculaire au SIV et passe entre les deux piliers des muscles papillaires. Le faisceau traverse alors, successivement, la paroi thoracique, la paroi du VD, la chambre ventriculaire, le SIV, la chambre du VG, la paroi du VG et le péricarde. Le volume du VD est relativement faible et doit être égal à environ 1/3 du volume du VG (88). La 39 Fig 14 : coupe 4 de Feigenbaum( transaortique ) et son mode Temps-Mouvement CCVD: chambre de chasse du ventricule droit D'après CHETBOUL V et POUCHELON JL (15) 40 b - Modifications structurelles et fonctionnelles liés à l’IMC • épaisseur et volume ( tableau VI et VII ) Chez l’animal présentant une IMC de stade clinique I ou II, le ventricule gauche est généralement de taille normale, du moins son diamètre télédiastolique, et son diamètre télésystolique réduit du fait de l’augmentation du tonus sympathique et du volume sanguin régurgité (58). Au cours de l’évolution de l’IMC, ce volume télédiastolique va s’accroître de concert avec la taille de l’atrium gauche et la sévérité de la régurgitation. Cependant le degré de dilatation reste toujours plus faible. L’épaisseur des parois musculaires, tant septale que murale, est habituellement dans les normes (58) voire un peu augmentée (2). Cette augmentation de volume avec conservation de l’épaisseur des parois définit la surcharge volumique et l’hypertrophie excentrique. Chez les animaux de petite taille, le volume télésystolique reste dans les normes même pour des stades tardifs d’IMC contrairement aux animaux de grande taille. KITTELSON et KNIGHT suggèrent que la mesure du volume télésystolique renseigne sur les performances du cœur plus que la fraction de raccourcissement (FR) . L’obtention des diamètres ventriculaires gauches systolique et diastolique permet de calculer les volumes respectifs par l’intermédiaire des formules suivantes (formule de Teichholz) . Volume du ventricule gauche en systole (VVGs) = 7 (DVGs)3 / (2,4 + DVGs) Volume du ventricule gauche en diastole (VVGd) = 7 (DVGd)3 / (2,4 + DVGd) Ces approximations ont été comparées aux méthodes de référence telles que la thermodilution ou méthode de FICK, et ont montré une corrélation de moyenne à bonne (50, 61). Ces différentes mesures d’épaisseur, de diamètre et de volume apportent, déjà à elles seules, des renseignements sur l’état du cœur du patient quand elles sont comparées aux normes. Mais elles permettent également le calcul d’indices de la fonction ventriculaire. • indices de la fonction ventriculaire gauche ( tableau VIII ) c indices d’éjection du VG Aucun de ces indices ne mesure la contractilité du myocarde mais, plutôt, les performances globales du VG. Ils sont autant altérés par la précharge et la postcharge que par la contractilité (17, 50). L’index le plus utilisé est la fraction de raccourcissement (FR). Les autres incluent la vitesse de raccourcissement circonférentiel (Vcf) et la variation de l’épaisseur des parois septale ou murale du VG en diastole et systole. Ces indices n’ont pas d’unité et expriment le pourcentage de variation de dimensions du VG entre les phases du cycle cardiaque. FR = [ ( DVGd – DVGs ) / DVGd ] x 100 Vcf = FR / LVET où LVET = left ventricular ejection time (temps d’éjection ventriculaire du VG) Du fait de sa simplicité, la FR est la plus largement utilisée. Vcf requiert plus de temps sans bénéfice notable. La norme, chez le chien, s’étalonne de 25 à 45 % (17, 50). Lors d’IMC, la FR s’accroît dans un premier temps du fait de la dilatation télédiastolique et d’un volume télésystolique normal ( 10, 50). En effet, durant la systole ventriculaire, le sang est d’abord éjecté dans le système à basse pression que constitue l’atrium gauche, ce n’est 41 que dans un second temps qu’il est éjecté dans l’aorte. Le premier temps permet donc une réduction sensible du diamètre ventriculaire sans gros effort du fait de la faible résistance à l’éjection (2, 61). On peut donc concevoir que la FR puisse être normale alors qu’il y a déjà une altération de la contractilité (10, 14, 98). La FR est alors un mauvais 42 Tableau VII : normes échocardiographiques des différentes strutures cardiaques POIDS (Kg) Dd Ds (en mm) (en mm) PPVGs PPVGd (en mm) (en mm) Sd Ss OG AO (en mm) (en mm) (en mm) (en mm) 2 21 26 31 10 15 20 4,5 7,5 10,5 3,2 5,2 7,2 4,0 6,0 8,0 7,6 9,6 11,6 8,0 13,0 18,0 11,0 15,0 19,0 4 23 28 33 12 17 22 5,0 7,5 10,0 3,8 5,6 7,4 4,0 6,0 8,0 7,6 10,0 12,4 10,0 14,0 18,0 12,0 15,5 19,0 6 25 29 33 14 18 22 6,0 8,0 10,0 4,2 5,8 7,4 5,2 6,6 8,0 8,4 10,4 12,4 11,0 15,0 19,0 14,0 17,0 20,0 8 27 31 35 16 19 22 7,0 9,0 11,0 4,8 6,0 7,2 5,6 6,8 8,0 8,8 10,6 12,4 13,0 16,0 19,0 15,0 17,5 20,0 10 29 33 37 18 21 24 7,0 9,0 11,0 5,0 6,2 7,2 5,8 7,0 8,2 9,2 10,8 12,4 13,0 16,0 19,0 16,0 18,0 20,0 12 31 34 37 19 22 25 8,5 9,5 10,5 5,4 6,5 7,6 6,2 7,4 8,6 9,8 11,2 12,6 14,0 17,0 20,0 17,0 19,0 21,0 14 34 37 40 21 24 27 8,5 9,5 10,5 5,8 6,6 7,4 6,6 7,6 8,6 10,2 11,4 12,6 16,0 18,0 20,0 18,0 19,0 20,0 16 35 38 41 23 25 27 9,0 10,0 11,0 6,0 6,8 7,6 7,0 7,8 8,6 10,6 11,6 12,6 16,0 18,0 20,0 19,0 20,0 21,0 18 37 40 43 34 26 28 9,7 10;7 11,7 6,4 7,0 7,6 7,2 8,0 8,8 11,0 12,0 13,0 17,0 19,0 21,0 20,0 21,5 23,0 20 39 41 43 35 28 31 10,0 11,0 12,0 6,8 7,2 7,6 7,4 8,2 9,0 11,0 12,0 13,0 18,0 20,0 22,0 21,0 22,0 23,0 22 40 43 46 37 29 31 10,0 11,0 12,0 6,8 7,4 8,0 7,6 8,4 9,2 11,0 12,0 13,0 19,0 21,0 23,0 22,0 23,5 25,0 24 42 44 46 28 30 32 10,5 12,0 13,5 6,8 7,8 8,8 7,6 8,6 9,6 11,4 12,6 13,8 19,0 21,0 23,0 23,0 24,5 26,0 26 42 46 50 29 32 35 11,0 12,5 14,0 7,0 8,2 9,4 7,8 8,8 9,8 11,4 13,0 14,6 19,0 22,0 25,0 23,0 25,0 27,0 28 43 47 51 30 34 38 11,0 13,0 15,0 7,2 8,6 10,0 7,8 9,0 10,2 11,4 13,0 14,6 20,0 23,0 26,0 24,0 26,0 28,0 30 44 49 54 31 35 39 11,0 13,0 15,0 7,2 8,8 10,4 7,8 9,4 11,0 11,4 13,4 15,4 20,0 24,0 28,0 24,0 27,0 30,0 32 46 51 56 32 36 40 11,0 13,0 15,0 7,4 8,8 10,2 8,0 9,6 11,2 11,4 13,4 15,4 20,0 25,0 30,0 25,0 28,0 31,0 34 47 53 59 33 38 43 11,0 14,0 17,0 7,4 9,0 10,6 8,0 9,8 11,6 11,4 14,0 16,6 20,0 25,0 30,0 26,0 29,0 32,0 Dd: diamètre télédiastolique du VG ; Ds: diamètre télésystolique du VG ; PPVGs et d: épaisseur de la paroi du VG en systole et diastole ; Sd: épaisseur du septum interventriculaire en télédiastole ; Ss: épaisseur du septum en télésystole ; Ao: aorte ; OG: oreillette gauche D'après BONAGURA JD (8) 43 indice du stade de l’insuffisance mitrale (17, 98) sauf en dernière limite où l’inotropisme est effondré et la FR chute au dessous de limite inférieure (14, 17, 58, 98) .Le volume télésystolique ventriculaire gauche est à lui seul une mesure globale des performances du VG et est un index plus spécifique de la contractilité myocardique que la FR bien qu’il soit, lui aussi, affecté par la postcharge (17, 50, 58, 61, 88). L’indice volumétrique télésystolique (ESVI) est indépendant de la charge ventriculaire. Celui-ci met en relation la dimension interne du VG en systole avec la surface corporelle de l’animal. Il est couramment utilisé en médecine humaine et permet d’estimer la gravité de l’insuffisance myocardique (2, 61). ESVI = ESV (ml ) / BSA ( m2 ) où ESV = end systolic volume et BSA = surface corporelle . La limite supérieure est de 30 ml / m2 (2, 61) et, lors d’insuffisance cardiaque, on atteint 80 ml / m2 (2). Le mode TM visualisant les mouvements de la valvule septale, la coupe TM transmitrale, est riche d’enseignements. En effet, on peut noter l’épaississement des feuillets de la valve mais aussi une pente de la partie EF nettement plus marquée. L’onde E de grande amplitude peut buter sur le septum interventriculaire, image compatible avec un débit atrio-ventriculaire accru. Celle-ci est souvent associée à une hyperkinésie pariétale faisant suite à la baisse de la postcharge liée à la régurgitation et à l’augmentation du taux de catécholamines circulantes et d’angiotensine II (17). L’examen de cette coupe permet également de rechercher des signes de prolapsus. Il en existe deux classiquement décrits. - déformation postérieure méso-télésystolique du segment CD en « cupule » - déplacement postérieur holosystolique de l’écho mitral en « hamac » La distance entre le SIV et le point E (ouverture maximale de la valve au cours du remplissage passif du VG) est inversement proportionnelle au taux de vidange de l’atrium gauche et, donc, au volume d’éjection. Cette mesure, connue sous le nom de EPSS (mitral E Point to Septal Separation) est utilisée comme index de fonction du VG (17, 50, 61). Chez le chien, elle est inférieure à 6 mm sans que la taille n’intervienne (17, 30). Il a été démontré chez l’homme que la taille du VG seule ne modifiait l’EPSS si et seulement si la fonction systolique était altérée (50). En période terminale, la dilatation ventriculaire et la chute du débit aortique se soldent par une augmentation de cette distance au delà du seuil de 10 mm (2, 14). Le volume d’éjection, si intéressant, permettant de calculer le débit nécessite l’obtention des volumes diastolique et systolique ventriculaires mais une inconnue s’intercale, le volume régurgité et rend le calcul spéculatif. Une technique consiste à visualiser le flux aortique en mode doppler et le volume d’éjection serait égal à la vitesse du flot sanguin x l’aire de la valve x (temps d’éjection) / 2 x FC d intervalles de temps systoliques, PEP / LVET Avant l’utilisation de l’échocardiographie, les ITS étaient obtenus à partir d’un ECG, d’un phonocardiogramme et d’un apexcardiogramme. Pour mesurer les ITS par échocardiographie, ceci requiert une visualisation du départ de l’aorte (avec ses cuspides) et un enregistrement simultané de l’ECG. La PEP (période de pré-éjection) correspond à l’intervalle de temps entre le début de la dépolarisation du ventricule (onde Q sur l’ECG) et l’ouverture des cuspides aortiques (2, 50, 61). Elle dépend du délai électromécanique et du temps mis par le ventricule pour atteindre la pression diastolique dans l’aorte (temps de contraction isovolumique systolique corrélé à dP/dT) (50). 44 La LVET (temps d’éjection du VG) est l’intervalle de temps entre ouverture et fermeture de la valve aortique (2, 50, 61). Elle dépend du volume éjecté et de la force d’éjection donc de la contractilité du myocarde (50). Elle est d’ordinaire égale à 205 + / - 15 msec. Cependant, chez le chien présentant une régurgitation sévère la LVET peut être réduite à moins de 100 msec (50). Tableau VIII : indices cliniques de décompensation cardiaque Stade d’IMC ESVI ( ml / m2 ) Indice de volume télésystolique FR ( % ) Fraction de raccourcissem ent PEP / LVET Intervalle de temps systolique AG / AO I II III IV Valeur normale 29+/-6 29+/-12 31+/-22 95+/-16 <30 41+/-4 45+/-10 49+/-10 30+/-14 28-45 0,12+/-0,02 0,19+/-0,04 0,23+/-0,06 0,29+/-00,3 0,24 1,1+/-0,2 1,6+/-0,3 1,8+/-0,2 2,3+/-0,6 1,2 D’après AMBERGER C, GLARDON O, LOMBARD CW (2) 45 L’intervalle PEP + LVET définit la systole électromécanique totale. Ces indices mesurent la performance du VG. Le rapport PEP / LVET est l’ITS le plus utilisé car contrairement à la PEP et la LVET, il élimine l’effet de la FC (2, 50, 61). L’allongement de la PEP seule serait, cependant, un indice précoce d’un dysfonctionnement myocardique systolique. La norme du rapport PEP / LVET est de 0.24 chez le chien (2). C’est le premier indice à se modifier lors de défaillance du myocarde. Il reste que, au même titre que la fraction de raccourcissement, influencée par la précharge et la postcharge, le rapport ne permet pas à lui seul d’évaluer la contractilité du muscle cardiaque . III. B. 3 - mode doppler L’échocardiographie doppler utilise le changement de fréquence d’un faisceau d’ultrasons alors qu’il se réfléchit sur les cellules sanguines en mouvement afin de mesurer leur vitesse. La différence de fréquence entre l’onde émise et celle réfléchie s’appelle fréquence doppler ou glissement de fréquence et il existe une relation entre cette dernière et la vitesse (fig 15). a - doppler continu et pulsé • doppler continu Dans ce mode la sonde se constitue d’un cristal émetteur et d’un autre receveur. Chacun émet ou reçoit un faisceau linéaire choisi sur une coupe bidimensionnelle. Le caractère continu de l’émission et de la réception se solde par l’analyse de l’ensemble des flux existant sur le trajet du faisceau ultrasonore sans distinction de profondeur. C’est l’ambiguïté en distance ou en profondeur constituant un manque de résolution spatiale (16). • doppler pulsé Cette fois-ci un seul cristal émet et reçoit les ondes. Pendant une période très courte, celui-ci va émettre une petite quantité d’ultrasons appelé « pulse » puis se mettra en mode réception, en attente des échos de retour. Sachant que les ultrasons circulent à une vitesse connue dans les tissus (1540 m / sec), la mesure d’une vitesse à une profondeur connue devient facile à calculer car on sait le temps que les ondes mettront pour « aller et revenir » à la sonde : T= 2d / C. L’ambiguïté de distance disparaît alors avec le mode doppler pulsé. En pratique, la fréquence à laquelle la sonde émet des pulses (fr) s’appelle fréquence de répétition ou PRF : pulse repetition frequency, à ne pas confondre avec la fréquence de l’onde émise. A cette fréquence de répétition correspondra une période de répétition Tr = 1 / fr. Cette période Tr doit être égale au temps T calculé plus haut pour que la sonde puisse recevoir les informations spécifiques de la profondeur choisie. Cette dernière est déterminée sur l’image bidimensionnelle sous la forme d’un petit curseur appelé « volumeéchantillon » que l’on peut déplacer sur l’axe de tir doppler. On voit donc que la profondeur d’échantillon choisie détermine et limite la fréquence de répétition PRF. Plus le volume échantillon est éloigné de la sonde et plus la fréquence de répétition est basse (16). Cependant il existe une limite au doppler pulsé qui fait que les vitesses ne seront pas mesurables au delà d’une certaine valeur, artefact analogue à celui rencontré avec l’effet stroboscopique. Un éclair lumineux, caractérisé par une fréquence fi, illumine de façon intermittente un disque tournant à une vitesse fixe à une fréquence fo, si la 46 fréquence d’illumination est supérieure à la fréquence de rotation on aura l’impression de voir tourner le disque à l’envers. La fréquence d’échantillonnage n’est plus à même de représenter la fréquence du phénomène mesuré. Le phénomène d’aliasing repose sur ce principe. Lorsque la vitesse du flux est trop importante (c’est à dire une fréquence doppler supérieure à la moitié de la fréquence de Fig 15 : la détection du flux sanguin artériel par effet doppler Fe : fréquence du faisceau émis, Fr : fréquence du faisceau réfléchi , V : vélocité du sang D'après P PIBAROT , D BLAISET et S CUVELLIEZ (95) répétition : Fd > fr/2) 47 il se produit, sur le graphique, une inversion artéfactuelle de la vélocité du flux, c’est l’ambiguïté en vitesse (16) . Il existe donc une fréquence doppler maximale (Fd max) mesurable sans ambiguïté appelée limite de Nyquist. Elle correspond à une vitesse maximale (Vmax). Pour limiter ce phénomène, on peut d’une part augmenter la fréquence de répétition de manière à respecter la limite fr > 2Fd. Mais la fréquence de répétition est, elle, limitée par la distance de l’échantillon : plus le volume-échantillon est loin de la sonde plus la fréquence de répétition doit être basse et donc plus on sera limité pour la mesure de hautes vélocités par le phénomène d’aliasing. On a affaire à une double contrainte. Pour une même vitesse, l’aliasing sera d’autant plus important que la profondeur sera grande (16). D’autre part, compte tenu de l’équation doppler, on peut augmenter la valeur de la Vmax en diminuant celle de la fréquence initiale d’émission fo. • analyse des signaux doppler Elle peut se traduire par un signal sonore et par un graphique. Il peut également s’agir d’une analyse colorimétrique utilisée dans le doppler couleur. L’analyse auditive est possible car les glissements de fréquence enregistrés sont compris entre 20 et 20000 Hz appartenant au spectre des fréquences audibles. Ce signal peut être amplifié et transmis à un haut parleur. On obtient ainsi un son de tonalité douce pour les flux laminaires et rude pour les flux turbulents (régurgitation). Cette analyse auditive est généralement couplée à l’analyse graphique permettant de guider l’opérateur vers les signaux de plus forte intensité (site exacte de l’insuffisance mitrale) (16) . L’analyse graphique utilise essentiellement une représentation spectrale : on obtient une courbe matérialisant le spectre de l’ensemble des vitesses en temps réel. Les flux antérogrades, se dirigeant vers la sonde, sont au dessus de la ligne du zéro et les flux rétrogrades, s’éloignant de la sonde, en dessous (16). • Modifications liées à l’IMC Afin d’obtenir le flux transmitral, on utilise une coupe apicale quatre cavités par abord parasternal gauche, le volume-échantillon est placé au niveau des valvules mitrales. Le flux normal est un flux diastolique antérograde, de l’atrium vers le ventricule donc positif, composé de deux phases correspondant respectivement au remplissage passif et actif du ventricule gauche (E et A) (16, 17), l’onde E est normalement plus large et haute que A car le remplissage passif est plus important que l’actif (17)( figure 16 ). En cas d’insuffisance mitrale, on enregistre en plus du flux diastolique normal, un flux systolique de régurgitation, négatif car rétrograde, dont la vitesse avoisine souvent les 5 à 6m / sec en doppler continu (58). En cas de fibrillation atriale, la composante A disparaît car il n’y a plus de contraction efficace de l’atrium donc de remplissage actif du ventricule. La représentation du flux transmitral permet d’apprécier aussi la compliance ventriculaire. En effet, lorsque celle-ci diminue, il y a une plus importante sollicitation de l’atrium gauche lors du remplissage actif, ainsi l’onde A devient plus ample que l’onde E (16). Le flux trans-aortique est obtenu à partir d’une coupe apicale cinq cavités par abord parasternal gauche. Celui-ci couplé à l’enregistrement d’un ECG permet de calculer les intervalles de temps systoliques de manière plus aisée que via le mode TM transaortique (figure 17). 48 Fig 16 : flux tranmitral normal ( doppler transmitral ) D'après CHETBOUL V , POUCHELON JL et BONHOEFFER P (16) Fig 17 : flux aortique normal ( doppler aortique ) D'après CHETBOUL V , POUCHELON JL et BONHOEFFER P (16) 49 b - doppler couleur • principe Le mode doppler couleur est une forme particulière de doppler pulsé, le signal n’étant plus analysé sous forme de graphique mais de manière colorimétrique. Le système doppler offre la possibilité de déterminer le sens et la vitesse du flux sanguin à l’intérieur d’un petit échantillon situé sur l’axe de tir doppler. Au lieu de représenter les vitesses par une courbe, on peut choisir d’associer au volume-échantillon une couleur dont la nature donnera le sens du flux et l’intensité, l’amplitude de la vitesse. Le volume est coloré en rouge si le flux est antérograde, bleu s’il est rétrograde. Les flux turbulents seront représentés en vert ou en jaune. Ainsi, on obtiendra sur la coupe 2D, à l’endroit du volume-échantillon, une visualisation du sens et de l’amplitude du flux ainsi qu’une information sur son caractère laminaire ou turbulent. Le faisceau peut balayer une région permettant d’obtenir une représentation du flux sur une portion de la vue bidimensionnelle. Notons, cependant, que le système doppler couleur dérivant du doppler pulsé, est soumis à la même limite pour la mesure des hautes vitesses par le phénomène d’aliasing qui se traduit par une inversion colorimétrique du flux enregistré (il existe, cependant, un nouveau système, quasar, permettant de représenter ces flux sans ambiguïté) (16). • renseignements fournis Ce mode donne une image de la régurgitation mitrale (16, 58). La taille du jet peut être comparée à celle de l’atrium gauche. Cette comparaison est semi-quantitative, un jet de 50 Fig 18 : semiquantification de l'insuffisance mitrale par cartographie 1- IM modérée 2- IM moyenne 3- IM importante D'après CHETBOUL V, POUCHELON JL et BONHOEFFER P (16) 51 III. C - L’ELECTROCARDIOGRAPHIE L’électrocardiogramme (ECG) est l’enregistrement de l’activité électrique du cœur à la surface du corps. Ce n’est pas un enregistrement direct mais une «approximation ». Ceci limite la capacité de l’ECG à déterminer les variations de voltage lors de dilatation des cavités cardiaques. Par contre ceci ne modifie pas la capacité à détecter les dysrythmies et les troubles de la conduction. III. C. 1 - dilatation des cavités ( tableau IX ) Bien que l’ECG puisse permettre d’identifier une dilatation d’une ou plusieurs cavités cardiaques, cette méthode reste peu sensible (beaucoup de faux négatifs) (54, 58, 88). Les faux positifs sont moins communs (2, 54, 88). Dans ce but l’ECG doit être utilisé conjointement à la radiographie et à l’échocardiographie. a - dilatation de l’atrium gauche ( AG ) Les découvertes électrocardiographiques caractéristiques d’une dilatation de l’AG sont une onde P ample parfois crochetée (2, 13, 54, 58, 88). La limite supérieure en durée pour une onde P est de 0,04 secondes. Une durée plus importante signe un temps de conduction atriale plus long pouvant correspondre à une surface atriale plus importante. Cette anomalie est repérée chez 40% des animaux souffrant d’IMC de modérée à sévère (58). Une augmentation de la taille de l’AG de même que celle de l’AD peut engendrer les mêmes anomalies du tracé. Le fait est que l’augmentation de taille ne soit pas la seule responsable des découvertes électrocardiographiques. Il est suggéré que la dilatation de l’AG prolonge ou interrompt la conduction de l’AD vers le gauche se soldant ainsi par une onde P de durée accrue. Une étude chez l’homme avec dilatation atriale secondaire à une IM n’a pas permis de trouver de corrélation significative entre la taille de l’AG mesurée par échocardiographie et la durée de l’onde P. Par contre, elle a révélé une corrélation raisonnable avec le degré de fibrose. Ceci suggère qu’un retard de conduction intramyocardique est responsable de la modification de l’onde P (54). Cette onde P longue est crochetée est appelée P mitrale car les atteintes de la valve mitrale se solde communément par une dilatation de l’AG et ces variations typiques de l’ECG. Les critères de dilatation de l’AG sont peu sensibles mais restent raisonnablement spécifiques (54). b - hypertrophie du ventricule gauche ( VG ) L’hypertrophie du VG accroît l’amplitude du front de dépolarisation dans le même ventricule. Ceci se solde par une augmentation de la taille l’onde R dans les dérivations parallèles à ce front d’onde, notamment DII et aVf, et une augmentation de la durée du complexe qRs. Jusqu’à présent, il n’a pas pu être prouvé de rôle prédominant entre l’augmentation de masse ou un problème de conduction secondaire à une atteinte du myocarde ventriculaire. Il est à noter qu’une augmentation de la durée du qRs sans anomalie de l’axe électrique est une preuve d’hypertrophie du VG chez le chien (ce qui n’est pas vrai chez l’homme). Il a été cependant prouvé que lors d’entraînement, certains animaux voyaient leur qRs augmenter en durée suite à une augmentation de la masse du VG (54). Bien qu’un rapport suggérait que l’on pouvait distinguer, grâce à l’ECG, une hypertrophie par surcharge volumique, d’une hypertrophie par surcharge en pression, le 52 consensus des vétérinaires cardiologues assure que ce n’est pas possible. Ce rapport suggérait qu’une onde R de plus de 3 mV était en faveur d’une surcharge en volume alors qu’une déviation de l’axe électrique à gauche (entre 30 et – 90° ) était en faveur d’une surcharge en pression (54) . 53 Tableau IX : insuffisance mitrale et électrocardiogramme Stade d’IMC ECG normal Pmitrale I (N=20) II(N=25) III(N=43) IV(N=18) 80% 60% 59% 28% 20% 44% 39% 40% PÈ taille È taille Arythmie FC pulmon du VG du VD (FA,ESV) ale (-) (-) (-) (-) 113+/-38 8% 40% (-) 8% 122+/-20 14% 21% 5% 7% 132+/-36 18% 33% 6% 60% 154+/-47 D’après AMBERGER C, GLARDON O, LOMBARD CW (2) 54 Selon une étude conduite par le Dr KNIGHT, les critères discriminants, détectant une dilatation du VG sont : - complexe qRs de durée supérieure à 0,06 seconde (54) - onde R > 3 mV en DII ou aVf (13, 54) (3 mV pour les grandes races, 2,5 mV pour les petites races (2, 88)) - onde R de voltage > 4 mV en DI et aVf combinés (54) - onde R > 1,5 mV en DI (54, 58, 88) Cette méthode est moins sensible pour repérer des dilatations consécutives à une régurgitation mitrale ou une sténose aortique : moins de 50% des animaux souffrant d’IMC et présentant une dilatation significative du VG manifestent de tels signes électrocardiographiques (58). Une augmentation de la durée du qRs ainsi qu’un crochetage de la partie ascendante de R signe une ischémie du myocarde (2). Des variations non spécifiques du segment ST ou de l’onde T peuvent se rencontrer en association avec une hypertrophie ventriculaire gauche. Ces modifications se retrouvant également lors d’autres affections, elles ne doivent pas être utilisées comme preuve d’hypertrophie ventriculaire mais font suite à une atteinte du myocarde secondaire à une hypertrophie (54). III. C. 2 - dysrythmies et IMC L’apparition de dysrythmies est liée aux modifications morphologiques des tissus du cœur : étirement des fibres myocardiques, fibrose. Dans le cas d’insuffisance mitrale chronique, la dilatation de l’atrium gauche, en particulier, prédomine ainsi que les dysrythmies supraventriculaires (13, 59, 88). En fin d’évolution où le ventricule gauche peut être également fortement remanié, des dysrythmies ventriculaires peuvent être aussi observées. a - dysrythmies supraventriculaires Ce sont essentiellement des tachyarythmies (13, 58, 59): tachycardie sinusale, extrasystoles supraventriculaires (dépolarisations prématurées), flutter et fibrillation atriaux. • tachycardie sinusale Tous les critères prouvant un rythme sinusal sont présents, le seul point qui diffère d’un rythme normal est la fréquence élevée. La stimulation du système nerveux sympathique et la douleur sont deux des causes principales. Dans le cas d’IMC, la tachycardie sinusale est liée à la stimulation du système nerveux sympathique dans le but de pallier à la chute du débit cardiaque. Il y a alors disparition de l’arythmie sinusale respiratoire, un des signes de décompensation .Le diagnostic différentiel majeur de la TS est la tachycardie supraventriculaire ( TSV ) dans laquelle un site ectopique se dépolarise à un rythme supérieure au rythme sinusal. La TSV peut se révéler identique à une TS sur l’ECG. Plusieurs facteurs permettent de suggérer l’existence d’une TSV plutôt que d’une TS. Si la FC est vraiment élevée ou si le patient souffre d’une atteinte cardiaque, la TSV sera considérée avec plus de poids (59). Il n’y a généralement pas d’indication à traiter une TS. La cause sous-jacente doit être, cependant, identifiée et traitée. 55 • tachyarythmies supraventriculaires Elles regroupent les dépolarisations prématurées, la tachycardie supraventriculaire, le flutter et la fibrillation atriaux. L’anomalie primitive à toutes ces dysrythmies est la présence d’un ou plusieurs sites ectopiques supraventriculaires à l’origine de dépolarisations prématurées. Ces sites incluent le myocarde atrial et les tissus jonctionnels (faisceau AV proximal, nœud AV et faisceau de His). Les dépolarisations prématurées peuvent être uniques (extrasystoles) ou répétées (tachycardie et fibrillation). La différence entre tachycardie et fibrillation est la fréquence à laquelle le ou les sites se dépolarisent. La TSV donne, chez le chien, une FC entre 150 et 350 bpm. La fréquence atriale lors de fibrillation est généralement supérieure à 500 bpm même si l’activité chaotique rend ce compte ardu. Une autre caractéristique de la fibrillation est qu’elle est due à de nombreux sites de réentrée responsables de l’activité rythmique anarchique (59). c les extrasystoles supraventriculaires ( dépolarisations prématurées ) : ESSV Les ESSV apparaissent lorsqu’un site ectopique se dépolarise à un rythme supérieur au nœud sinusal. Elles sont dues à des phénomènes de réentrée, à une automaticité anormale ou une activité induite. Les phénomènes de réentrée semblent, cependant, en être le mécanisme commun (59). C’est une arythmie très fréquente notamment chez l’IMC où elles prennent naissance dans le muscle atrial endommagé. Elles sont suspectées en percevant une contraction prématurée lors de l’auscultation ou diagnostiquées grâce à l’ECG. Sur ce dernier, les ESSV sont caractérisées par un complexe qRs en apparence normal mais qui est prématuré. Ce complexe a une morphologie supraventriculaire car l’influx électrique emprunte les voies de conduction ventriculaire habituelles et les dépolarise de façon tout à fait standard. Ce complexe qRs peut être ou non précédé d’une onde P positive ou négative. Il n’existe pas de critères absolus permettant de différencier un site ectopique atrial d’un jonctionnel (nodal). Par conséquent, on préfère nommer ce genre d’extrasystole, supraventriculaire. Il existe trois raisons pour lesquelles l’onde P peut ne pas être présente lors d’ESSV. La première est que, si l’ESSV naît dans le myocarde atrial, la dépolarisation peut être si prématurée que l’onde P se fonde dans le complexe qRs précédant. La seconde est que, si l’ESSVnaît dans la région AV (jonctionnelle), la dépolarisation rétrograde vers l’atrium peut ne pas se produire. La dernière est que, si l’ESSV naît dans la région AV, la dépolarisation peut atteindre les atria et les ventricules en même temps et l’onde P se fondre dans le complexe qRs. Par conséquent, l’absence d’onde P ne permet pas de différencier une ES atriale d’une jonctionnelle. Une onde P normalement orientée peut être occasionnellement présente juste avant le qRs. Cette découverte permet de diagnostiquer un site ectopique atrial. Il a été, cependant, montré que, lors d’excitation du ventricule droit chez le chien, la dépolarisation peut traverser, de façon rétrograde, la jonction AV par le faisceau internodal ou le faisceau de Bachmann, dépolariser les atria normalement et produire une onde P positive (59). Pour une onde P négative avant le qRs, il existe deux possibilités. Soit la dépolarisation atriale s’effectue de façon caudo-crânial soit de gauche à droite. Les deux sites ectopiques potentiels sont la jonction AV et l’atrium gauche. Ainsi, la présence d’une P négative ne permet pas non plus de distinguer une origine atriale d’une jonctionnelle. Dans certains cas, une onde P suit le qRs, elle peut être positive ou négative. La plupart du temps, cette onde est associée à un site ectopique 56 jonctionnel. Dans cette situation, le temps de conduction au travers de la jonction AV est plus long vers les atria que vers les ventricules (59). La durée séparant la dépolarisation prématurée supraventriculaire de la dépolarisation sinusale suivante est variable et dépend de plusieurs facteurs. La dépolarisation prématurée peut se produire au moment où le tissu sinusal est déjà repolarisé et ainsi non réfractaire. Celle-ci, initiée par le site ectopique, atteint le nœud sinusal et le dépolarise (dépolarisation sinusale n’engendrant pas d’onde de dépolarisation). Le nœud sinusal rentre ensuite dans un nouveau cycle et se dépolarise à son rythme normal. Sur l’ECG, l’intervalle entre le complexe qRs prématuré et le qRs sinusal précédant est plus court que la normale, et la distance entre le qRs prématurée et le qRs sinusal suivant est le même que l’espace R-R normal. C’est la situation la plus commune et elle est nommée pause non compensatoire. Moins fréquemment, le nœud sinusal ou les voies y menant sont réfractaires. Dans cette situation, le nœud sinusal continue à se dépolariser à son rythme. Si le muscle atrial est réfractaire alors que le nœud sinusal se dépolarise, il n’engendre pas de complexe P-QRS-T. La dépolarisation sinusale, suivant celle non conduite, induit une contraction normale. Sur l’ECG, ceci se traduit par une distance entre le complexe prématurée et le complexe sinusal suivant supérieure à l’espace R-R du rythme sinusal. C’est ce que l’on nomme pause compensatoire. Si la dépolarisation sinusale, suivant la prématurée, peut se propager dans les atria et les ventricules, le complexe prématuré se situe alors entre deux qRs sinusaux d’espace R-R normal (59). Il arrive qu’une ESSV produise un QRS de morphologie étrange. Ceci se rencontre lorsque la dépolarisation prématurée atteint les branches avant qu’une des deux ait pu se repolariser se soldant par un bloc de branche fonctionnel. Si ce phénomène se produit à chaque fois et que l’onde P n’est pas visible, distinguer ces ESSV d’extrasystoles ventriculaires ( ESV ) peut être difficile voire impossible. Généralement, la branche droite possède une période réfractaire plus longue que la gauche. Par conséquent, un bloc de branche droit est plus fréquent dans ce scénario. Par chance, ce phénomène est assez rare (59). Chez l’homme, les ESSV produisent des palpitations contrairement au chien et au chat chez lesquels elles ne se soldent par aucun signe clinique. Par conséquent, on envisage un traitement uniquement si les ESSV semble se précipiter en tachycardie supraventriculaire. Les substances employées afin de supprimer les ESSV sont la digoxine, les β bloquants et les inhibiteurs calciques. Le fait de traiter les ESSV dans le but d’éviter l’apparition de la fibrillation atriale n’a pas démontré d’efficacité significative (59). d la tachycardie supraventriculaire ( TSV ) la TSV est une succession de dépolarisations supraventriculaires prématurées. Comme ces dernières, la TSV peut prendre naissance dans le myocarde atrial et le tissu jonctionnel AV .Chez l’homme, elle est due la plupart du temps à des phénomènes de réentrée même si une automaticité anormale peut en être l’origine. La TSV par phénomène de réentrée est caractérisée par une FC constante (intervalle R-R régulier), celle liée à un trouble de l’automaticité du myocarde peut être irrégulière. Plusieurs études électrophysiologiques ont été conduites chez le chien et la réponse aux différentes thérapies (notamment celle aux inhibiteurs calciques) suggère que les phénomènes de réentrée sont aussi une cause principale de la TSV chez le chien. Chez l’homme, les voies de réentrée sont situées dans le nœud AV ou le tissu jonctionnel AV. Ceci n’a pas été étudié chez le chien mais la plupart des cas 57 de TSV à rythme régulier répondent aux substances altérant la conduction et la période réfractaire du tissu jonctionnel AV. Un cas dans la littérature vétérinaire décrit une TSV incessante due à des phénomènes de réentrée au niveau de l’atrium droit (59). La fréquence de dépolarisation du site ectopique est très variable. On peut rencontrer des rythmes aussi lents que 150 bpm à aussi rapide que 350 bpm. Sur l’ECG, la plupart des TSV sont régulières (R-R constant) et sont prolongées même si certains chiens peuvent présenter de courtes « bouffées » de TSV. Le rythme est rarement irrégulier. La plupart du temps, les qRs sont typiques, supraventriculaires (étroits et positifs en DII). Cependant, parfois, il coexiste des blocs de branche qui rendent difficile la distinction avec une TV. Comme pour les ESSV, une onde P peut ou non accompagnée les qRs et si elle est présente, celle-ci peut être positive ou négative en DII (59). La TSV se rencontre couramment suite à une atteinte cardiaque organique ou à un trouble systémique sérieux. L’animal présentant une TSV à rythme lent ne développe aucun signe clinique contrairement à celui présentant une TSV rapide et soutenue (FC > 300 bpm) qui développe généralement faiblesse et signes de collapsus tels que muqueuses pâles, TRC prolongé et pouls faible. Ceci est imputable à la diminution du temps de remplissage ventriculaire. La TSV est une urgence médicale dans ce cas. La manœuvre vagale (pression sur les globes oculaires, massage du sinus carotidien) est très souvent vouée à l’échec. L’application d’un coup dans la région du choc précordial est intéressante et montre de bons résultats ( 90% de réussite ). L’animal est placé en décubitus latéral droit et la zone du choc précordial repérée. Un coup est alors appliqué à l’aide du poing. La puissance requise pour mettre fin à la TSV dépend de la taille du chien (il doit être fort pour les animaux de grande taille). Cette technique délivre une décharge d’environ 5 joules au myocarde. Dans certains cas, elle induit une dépolarisation ventriculaire prématurée qui brise le circuit de réentrée responsable de la TSV et l’arythmie. Cette manœuvre permet également de différencier la TSV d’une tachycardie sinusale lorsque la FC est de 150-250 bpm : le coup stoppe la TSV pour, au moins, 1 à 2 battements alors qu’il est sans effet sur la TS. La thérapeutique médicamenteuse inclut l’utilisation des inhibiteurs calciques. Le vérapamil est administré en bolus de 0,05 mg / kg sur 3 à 5 minutes, l’administration peut être renouvelée deux fois. Si la dose est trop élevée ou si le patient atteint d’une insuffisance cardiaque modérée ou sévère, une injection trop brutale peut induire un collapsus cardiovasculaire. Afin de contrer ces effets délétères, on peut administrer du calcium en IV ou des catécholamines. Le diltiazem est aussi efficace à la dose de 0,05 – 0,25 mg / kg IV sur 5 à 15 minutes (59). Les β bloquants (propranolol 0,02 mg / kg IV en bolus lent jusqu’à un maximum de 0,1 mg / kg ou esmolol 0,25 – 0,5 mg / kg IV en bolus lent) peuvent être efficaces. L’insuffisance myocardique modérée ou sévère est une contre-indication relative à leur utilisation .La thérapeutique à long terme requiert l’administration de digoxine, β bloquants et / ou inhibiteur calcique, ces trois classes d’antiarythmiques prolongeant le temps de conduction et la période réfractaire du tissu jonctionnel AV. Les antiarythmiques de classe I tels que la quinidine et la procaïnamide peuvent être utilisés lorsque les substances précédemment citées restent inefficaces ou lorsque la TSV semble liée à un trouble de l’automaticité. La TSV induite par un site ectopique atrial peut être irrégulière et rester réfractaire aux thérapeutiques usuelles (59). - la fibrillation atriale (FA) 58 Cette arythmie est liée à l’action de nombreux sites de réentrée qui se traduit par un rythme de dépolarisation très rapide et complètement désorganisé. Il n’y a plus de contraction efficace des atria. Le rythme dépasse fréquemment 500 dépolarisations par minute, même si la multitude de configuration des ondes et le rythme élevé rendent ce compte difficile. Ces multiples dépolarisations « bombardent » le nœud AV qui agit comme un filtre et ne permet pas à toutes celles-ci de passer vers les ventricules. Le rythme de passage est complètement aléatoire : il peut se passer 1 ou 2 dépolarisations atriales avant qu’une ne passe vers les ventricules. La fois suivante, la conduction peut se produire après 3 ou 4 dépolarisations atriales (59). De nombreuses dépolarisations n’activent qu’une petite partie de l’atrium (car les autres sont réfractaires) et ainsi n’atteignent pas le nœud AV. D’autres y arrivent mais ne sont pas assez puissantes pour en dépolariser la totalité. Celles-ci affectent les propriétés de conduction du tissu jonctionnel AV responsable de la conduction aléatoire des dépolarisations et du rythme ventriculaire irrégulier. Le nombre total d’influx atteignant les ventricules dépend de la période réfractaire du nœud AV et de ses caractéristiques de conduction. Ces variables sont influencées fortement par le tonus autonome. Si le tonus vagal est fort et le sympathique faible, un moindre nombre de dépolarisations atriales est transmis aux ventricules. Par contre si le tonus vagal est faible et le sympathique élevé (comme pour les patients en insuffisance cardiaque) un grand nombre de dépolarisations est transmis aux ventricules (59). La FA est l’une des arythmies les plus rencontrées en médecine des petits animaux. elle se développe, le plus souvent, secondairement à une atteinte cardiaque sévère : cardiomyopathie dilatée et régurgitation mitrale. La raison en est que la FA requiert une certaine surface ou masse atriale pour se propager .Dans les études expérimentales où une FA est présente, le fait de diminuer la surface atriale permet de mettre fin à l’arythmie . On distingue deux types de FA. La FA primaire est une affection rare atteignant les chiens de grande taille sans anomalie cardiaque ou avec une atteinte moyenne. Ils ne sont pas en insuffisance ainsi le tonus sympathique est faible et le tonus vagal prédomine, par conséquent le rythme ventriculaire est de 100 à 140 bpm. La FA secondaire se rencontre chez les animaux malades cardiaques sévères. Dans ce cas, le tonus sympathique est élevé et le tonus vagal faible. Par conséquent le rythme ventriculaire est élevé et situé entre 180 et 240 bpm, chez le chien (59). Sur le tracé ECG, la FA secondaire est caractérisée par un rythme supraventriculaire, rapide et irrégulier. Aucune onde P n’est visible, la ligne de base peut être plate ou présenter de petites trémulations (onde F), révélant l’absence de contraction efficace des atria. De ce fait, le remplissage ventriculaire diastolique est moindre, le volume d’éjection et le débit cardiaque diminuent (diminution du volume d’éjection de 50 % et de l’index cardiaque de 25 %) (59). Il est fréquent de voir des patients se détériorer cliniquement suite à l’apparition d’une FA du fait de l’altération de l’hémodynamique. L’augmentation de la FC se solde, en plus, par une détérioration de la fonction myocardique. Ainsi il apparaît que l’un des buts principaux du traitement est de diminuer la fréquence cardiaque (jusqu’à, au moins 150-160 bpm) afin de diminuer le travail du cœur mais aussi de rallonger le temps de remplissage ventriculaire. Même si le débit cardiaque dépend de la fréquence, l’expérience clinique de la plupart des vétérinaires suggère que réduire la FC lors de FA ne se solde pas par une détérioration de l’état clinique (59). 59 Convertir la FA en rythme sinusal reste l’idéal mais est futile chez l’animal souffrant d’un problème cardiaque sévère ou d’une dilatation atriale sérieuse. Même si la conversion réussit, le rythme cardiaque ne reste sinusal que quelques heures ou quelques jours. Les substances utilisées dans ce but sont la digoxine, les β bloquants et les inhibiteurs calciques (59, 88). La digoxine augmente le tonus vagal sur le tissu jonctionnel AV, prolonge sa période réfractaire et son temps de conduction. Le résultat net est un plus faible nombre de dépolarisations atriales à atteindre les ventricules. Les β bloquants agissent de la même manière en diminuant le tonus sympathique. Vu que le tissu jonctionnel AV se dépolarise via les canaux calciques lents, les inhibiteurs calciques prolongent également le temps de conduction et la période réfractaire du tissu jonctionnel AV (59). Rem : le traitement de la FA primaire requiert l’emploi de quinidine et d’une cardioversion électrique : application d’un choc électrique trans-thoracique à un moment précis du cycle cardiaque, habituellement durant le complexe qRs. Il convient d’éviter de délivrer le choc durant l’onde T ce qui pourrait précipiter le patient en fibrillation ventriculaire. 60 b - les dysrythmies ventriculaires Lorsque le myocarde est endommagé (mauvaise irrigation, hypertrophie, artériosclérose intramurale (13)), les lésions engendrées peuvent induire des troubles de conduction, perturber l’activité automatique des cellules spécialisées ou développer, dans une région donnée, une capacité à se dépolariser spontanément. Les modifications ventriculaires, de même que les arythmies de ce type, interviennent tardivement dans l’évolution de l’IMC. Les tachyarythmies sont le type de trouble du rythme ventriculaire le plus fréquemment rencontré chez le chien et le chat (59). • les extrasystoles ventriculaires : dépolarisations ventriculaires prématurées ( ESV ) Une ESV est caractérisée par un complexe QRS plus large et ample que la normale, prématuré, accompagné d’une onde T elle aussi élargie et de polarité inverse au QRS. Il n’y a pas d’onde P associée. Prématurée, l’ESV apparaît trop rapidement sur l’ECG (l’espace entre le dernier qRs sinusal et le celui engendré par l’ESV est plus court que le R-R sinusal). Les tachyarythmies ventriculaires naissent distalement à la bifurcation du faisceau de His, dans la partie distale du système de conduction et dans le myocarde ventriculaire. De fait, la dépolarisation n’emprunte qu’une petite partie du système de conduction normal voire un chemin complètement en dehors avec un déplacement de cellule en cellule. Ceci requiert plus de temps pour dépolariser les ventricules, se soldant par un QRS plus large. La repolarisaton est, elle aussi, anormale ( onde T élargie ). Celle-ci est souvent prise pour une partie du QRS car elle commence immédiatement après ( il n’y a pas de segment ST ou il est très réduit ) . Une ESV peut avoir comme origine n’importe quelle partie du myocarde. Si elle naît dans le ventricule droit, l’onde de dépolarisation chemine de la droite vers la gauche dans le sens positif des dérivations I, II, III et aVf. Le complexe QRS est alors positif et l’axe électrique principal normal. Ces QRS sont identiques à ceux engendrés lors d’un bloc de branche gauche. Inversement, si l’ESV naît dans le myocarde ventriculaire gauche, la vague de dépolarisation se propage de gauche à droite, le complexe QRS est négatif en DI, DII, DIII et aVf et une déviation de l’axe électrique à droite se manifeste pour ces complexes anormaux. Ces QRS sont identiques à ceux engendrés lors de bloc de branche droit (59). L’intervalle entre les dépolarisations sinusales et l’ESV est variable. Dans le cas le plus fréquent, l’ESV dépolarise le myocarde ventriculaire et ne remonte pas au travers de la jonction AV pour dépolariser les atria et le nœud sinusal. Dans le même temps, l’onde de dépolarisation initiée par ce dernier ne peut parvenir aux ventricules car elle est bloquée soit par le nœud AV ou le myocarde qui sont réfractaires. Le nœud sinusal continue de se dépolariser à son rythme et la dépolarisation suivante produit un P-QRST normal. La distance entre les 2 complexes sinusaux ( de part et d’autre de l’ESV ) est ainsi égale à 2 espaces R-R normaux. Celle entre l’ESV et le qRs sinusal suivant est plus longue que le R-R normal, c’est ce que l’on nomme une pause compensatoire. Dans certains cas, la dépolarisation initiée dans le myocarde parvient à traverser la jonction AV et dépolariser le nœud sinusal et il n’y a pas de pause compensatoire (de même qu’il a été décrit pour les ESSV). Pour finir, le myocarde peut se repolariser assez rapidement pour être stimulé par la dépolarisation sinusale suivante. Dans cette situation, l’ESV n’interrompt pas le rythme cardiaque normal, c’est ce que l’on nomme une dépolarisation interpolée (59). Il existe différents types d’ESV. La plus fréquente est le bigéminisme : chaque complexe sinusal est suivi d’une ESV pendant une période plus ou moins longue. Le 61 trigéminisme (1 ESV pour 2 complexes sinusaux) est plus rare. Elles peuvent également se produire par paire (59, 64). Le rythme des ESV peut être complètement indépendant du rythme sinusal (fait inhabituel). Ce phénomène est appelé parasystole. Ceci se produit lorsque le site ectopique ventriculaire est entouré d’un tissu qui l’empêche d’être dépolarisé par l’influx sinusal (bloc d’entrée). Ce tissu adjacent peut ne pas laisser passer toutes les dépolarisations ventriculaires (bloc de sortie). Ainsi, à un certain moment les ESV sont séparées par un intervalle constant et à d’autres elles sont séparées par une distance égale à 2 fois cet intervalle, voire plus. Une autre caractéristique fréquente est la présence de complexes de fusion qui se produisent lorsque l’ESV et la dépolarisation sinusale atteignent en même temps le myocarde. Le QRS engendré possède alors une configuration hybride. Ces complexes ne sont pas l’apanage exclusif de la parasystole et se rencontre dans les autres types d’ESV. Lorsqu’il existe un intervalle constant entre les complexes sinusaux et les ESV, on pense qu’elles sont liées à un phénomène de réentrée. Cependant, une activité induite ou une automaticité anormale peuvent induire cette même régularité. Plus le site ectopique a un rythme de dépolarisation élevé, plus l’intervalle avec le complexe sinusal est court. L’ESV peut alors apparaître durant la phase descendante de l’onde T (phénomène R sur T). C’est une période très vulnérable car une dépolarisation durant cette phase peut précipiter le patient en fibrillation ventriculaire (59). Déterminer la cause des ESV par l’ECG reste impossible. Elles sont fréquentes chez les animaux hospitalisés pour traumatisme, après une chirurgie (dilatation-torsion de l’estomac) ou secondaire à une affection systémique grave. L’atteinte du myocarde lors de cardiomyopathie dilatée s’accompagne couramment de telle arythmie. L’emploi de certains produits anesthésiques (thiobarbituriques) peut induire un bigéminisme (59). Les animaux présentant des ESV isolées ne manifestent aucun signe clinique. Des syncopes ou une faiblesse épisodique peuvent se produire en cas de crise de tachycardie ventriculaire évoluant en même temps que les ESV. L’auscultation permet de révéler l’existence de contractions prématurées mais pas de distinguer une ESSV d’une ESV. L’intensité des bruits cardiaques dépendent du temps de remplissage ventriculaire avant l’extrasystole. Si elle est très prématurée, elle n’autorise qu’un faible remplissage ventriculaire et B1 est plus doux. Dans ce même cas, peu de sang est éjecté et B2 est faible voire imperceptible. La contraction suivant l’ESV est souvent plus forte que la normale (potentialisation post-extrasystolique), ceci est lié à une période de remplissage plus longue durant laquelle le réticulum sarcoplasmique stocke le calcium. Cette contraction plus forte se traduit par un B1 plus intense et, chez l’homme, est ressentie par une palpitation (59). La mise en place d’un traitement des ESV dépend de la situation dans laquelle elles sont identifiées. Des ESV isolées, chez un animal hospitalisé pour une affection systémique, ne nécessitent généralement pas de traitement. L’arythmie disparaît en traitant la cause sous-jacente. Chez l’animal souffrant d’une atteinte du myocarde, l’existence d’ESV est souvent une preuve d’une arythmie plus grave sous-jacente et réclame l’enregistrement ECG plus long ( Holter ). Chez l’homme, les ESV sont traitées afin de supprimer les symptômes tels que les palpitations, la dyspnée, la fatigue ou la douleur thoracique. Le chien et le chat démontrent rarement ce genre d’anomalie, par conséquent, traiter les ESV afin de prévenir ces signes n’est généralement pas nécessaire. La raison majeure reste la prévention de mort subite (59). Les substances utilisées sont les mêmes que pour la tachycardie ventriculaire (cf infra). 62 de la lidocaïne). En cas d’échec, le second choix est l’amiodarone bien que celle-ci ait une longue période de demi-vie et des effets indésirables (59). • la fibrillation ventriculaire Cette arythmie implique de sérieux troubles électriques des ventricules. Elle se traduit sur l’ECG par des ondulations de contour et d’amplitude irréguliers de la ligne isoélectrique. Il n’y a plus de complexe P-QRS-T visible. La FV est le stade terminal qui se solde par la perte de contractions efficaces des ventricules, c’est une forme d’arrêt cardiaque. Cette arythmie est due à de multiples circuits de réentrée situés dans le myocarde ventriculaire. Le seul traitement efficace de la fibrillation ventriculaire est le choc électrique par défibrillation. Même si des épisodes peuvent être contrôlés par le sotalol, lorsque la fibrillation atteint un animal malade cardiaque, l’emploi d’agents médicamenteux reste futile (59). 64 Le diagnostic précis des modifications de l’ECG, que celles-ci concernent la morphologie ou le rythme, est capital pour évaluer le risque anesthésique qu’encourt le patient. Cette évaluation permet de classer les troubles du rythme en trois catégories (17). Les extrasystoles rares et monomorphes font partie du 1er groupe pour lequel les risques sont nuls ou limités. Les extrasystoles fréquentes (< 30 par minute), polymorphes ou interpolées ainsi que les TSV font partie de la seconde classe pour laquelle les risques sont indéniables et réclament des précautions particulières (agents anesthésiques, monitorage). Les extrasystoles fréquentes avec phénomène R sur T et les TV font partie de la 3ème classe pour laquelle l’anesthésie est contre indiquée tant que la dysrythmie n’est pas corrigée. III. D - LES EXAMENS BIOLOGIQUES C’est une étape nécessaire à l’évaluation d’un patient en pré-opératoire. La classification des animaux en fonction de leur âge et de leur affection et celle des chirurgies en fonction de leur durée permet de définir avec précision la nature des examens à entreprendre (25). La classification du patient comprend 5 stades, de l’animal en parfaite santé à celui moribond dont l’espérance de vie est estimée à moins de 24 heures. L’IMC compensée fait partie du stade 3 alors que l’insuffisant cardiaque est inclus dans le stade 4 (tableau X). L’intervention chirurgicale est, quant à elle, classer selon sa durée et l’état clinique de l’animal. Elle est dite mineure si elle n’excède pas les 30 à 45 minutes et majeure si elle les dépasse. Quoiqu’il en soit, elle sera toujours majeure pour un patient de stade 4 ou 5 (25). Ainsi on définit aisément le bilan biologique à effectuer (tableau XI). Pour le patient cardiaque, les examens à entreprendre comprennent au minimum un hémogramme, l’urémie, la créatininémie, les phosphatases alcalines, le taux sériques des SGPT et la glycémie. Ceux-ci permettent de sonder les fonctions rénale et hépatique afin de déceler un problème supplémentaire venant alourdir les risques. Une augmentation des constantes rénales peut traduire une mauvaise perfusion et un éventuel état à bas débit. Une augmentation des constantes hépatiques peut être induit par une stase sanguine. On distingue ainsi que l’analyse de ses constantes peut renseigner sur l’efficacité de la fonction cardiaque. Au fur et à mesure de l’évolution de l’IMC, le bilan s’enrichit d’un ionogramme et du calcul de la réserve alcaline. Deux paramètres importants du fait du rôle de constante telle que la kaliémie et l’équilibre acido-basique sur la fonction cardiaque. Les variations de l’un ou de l’autre sont susceptibles de perturber la stabilité de la fonction cardiovasculaire (25). Ainsi, ces examens ont pour finalité d’estimer, d’une part, les répercussions éventuelles de l’affection cardiaque sur l’organisme et l’existence de problèmes supplémentaires, et d’autre part de mettre en place une thérapeutique adaptée et prendre des mesures préventives pour que l’anesthésie se déroule de la meilleure façon possible . 65 Tableau X : bilans préopératoires pour la chirurgie type de chirurgie Examen clinique Age 5 – 10 ans B < 5 ans > 10 ans Stade 1 A C Mineure Stade 2 B C Stade 3 C D Stade 1 B C Stade 2 C D Majeure Stade 3 C D Stade 4 D Stade 5 E Stade 1 : animaux en bonne santé Stade 2 : affection n’empêchant pas une activité normale Stade 3 : animaux présentant des signes cliniques associés et une atteinte de l’état général Stade 4 : animaux présentant une affection mettant leur vie en danger Stade 5 : animaux moribonds D’après DUPRE G (25) Tableau XI : détails des cinq bilans biologiques Bilan A Bilan B Bilan C (bilan minimum) ( bilan ordinaire ) ( bilan général ) • hématocrite • protéinémie (réfractomètre ) • urée sur bandelette • • • • • hémogramme protéinémie urémie créatininémie bandelette urinaire • • • • bilan B + SGPT PAL glycémie Bilan D Bilan E ( bilan ( bilan d’urgence ) d’extension) • bilan C + • bilan minimum + • ionogramme • glycémie sur bandelette • réserve alcaline • ionogramme • ( FeLV, test de coagulation ..) D’après DUPRE G (25) 66 L’évaluation du degré de l’atteinte cardiaque est établie en grande partie au vue de l’examen clinique de l’animal. Les examens complémentaires se révèlent, cependant, très utiles dans l’évaluation de la fonction cardiovasculaire ou des répercussions de cette atteinte sur l’organisme, notamment l’échocardiographie qui reste l’examen de choix. Muir présente une table évaluant le risque anesthésique en fonction de l’état général de l’animal, de la sévérité de l’atteinte cardiaque basée sur l’échographie, de la présence d’éventuelles arythmies et leur gravité, de l’existence de problèmes pulmonaire ou rénale, des constantes biologiques et de la thérapeutique en cours (tableau XII) (76). Bien que cette table soit relative à des animaux devant subir une chirurgie thoracique ou cardiovasculaire, elle reste utile afin de quantifier la sévérité de l’atteinte et le risque, somme toute relatif, encouru quelque soit la chirurgie. Les examens pré-opératoires, tant clinique que complémentaires, permettent au praticien d’avoir une vision globale suffisamment précise de la fonction cardiovasculaire et de sa stabilité. Il peut alors choisir le protocole anesthésique le mieux adapté à la situation au vue des effets cardiovasculaires des différentes substances. 67 Tableau XII : risque relatif à l’anesthésie des patients subissant une chirurgie thoracique ou cardiovasculaire facteur risque Etat général 1 Bon 2 Agé ( > 8 ans chez le chien ) 5 Mauvais Mode d’évolution de l’atteinte cardiaque 1 Chronique 5 Aigu Sévérité de l’atteinte cardiaque (légère= 3, modérée= 5, sévère=10) 1-10 Shunt gauche-droite 1-10 Shunt droite-gauche 1-10 Régurgitation 1-10 Sténose (pulmonaire ou aortique) 1-10 Tamponnade Arythmie cardiaque 1 Bénigne (ESSV ou ESV peu fréquentes) 5 Potentiellement létale (ESV fréquentes) 10 Létale (TV) Atteinte pulmonaire 2 Aucune ou minime 5 Congestion pulmonaire 10 Œdème pulmonaire Atteinte rénale 1 BUN > 0,5 g / l 5 Créatinine > 25 mg / l Maladie coexistante Hypothyroïdisme ou hypo-adrénocorticisme 1 Hyperthyroïdisme ou hyper-adrénocorticisme 2 Détresse respiratoire (pneumonie ) 3 Insuffisance rénale 3 Electrolytes K+ < 3 ou > 6 mEq / l 2 Mg2+ < 1 mEq / l 1 Statut acido-basique 1 PaCO2 > 50 mmHg 2 PaO2 < 60 mmHg 3 PH < 7,2 Thérapeutique en cours 2 β bloquants et / ou IEC 3 Antiarythmiques 5 Inotropes 5 Diurétiques 0 = risque minime ; 10 = risque modéré ; 20 = risque sévère ; 40 choc cardiogénique BUN : blood urea nitrogen D’après MUIR WW (76) 68 EFFETS CARDIOVASCULAIRES DES PRINCIPAUX AGENTS ANESTHESIQUES 69 70 I - LES PREANESTHESIQUES ET AGENTS DE LA PREMEDICATION Ces molécules ont un intérêt dans la réalisation de l'anesthésie car ils visent à faciliter la contention de l'animal par un effet calmant ou sédatif (83, 112), à prévenir certaines réactions néfastes (83) et éventuellement à réduire les quantités d'agents anesthésiques nécessaires à l'induction et au maintien de l'anesthésie générale (83). 3 catégories de substances sont employées à cet effet : les Anticholinergiques, les Tranquillisants et les Analgésiques. I. A - LES ANTICHOLINERGIQUES L'atropine et le glycopyrrolate sont les 2 molécules utilisées en médecine vétérinaire. Elles s'opposent aux effets muscariniques de l'acétylcholine (médiateur du parasympathique) et de ses agonistes par compétition vis à vis des récepteurs (83, 110, 112). Elles n'ont aucune action sur les récepteurs nicotiniques (ganglionnaire) de l'acétylcholine (112). Les principaux effets de l'atropine sont une diminution des sécrétions bronchique et gastro-intestinale, une dilatation des bronches et un accroissement de l'espace mort respiratoire par relâchement des muscles lisses bronchiques (ceci pouvant accentuer une hypoxémie post-opératoire avec une diminution du rapport ventilation / perfusion). On observe aussi un relâchement des muscles lisses intestinaux avec une diminution de la motricité (83, 110, 112) et une dépression du centre du vomissement (83). L'effet dépresseur du tonus vagal de l'atropine se solde par une élévation de la FC (71, 76, 77, 83, 112, 117). Cependant, on peut noter, surtout lors d'emploi en IV, une bradycardie initiale liée à une stimulation transitoire des noyaux vagaux de la moelle allongée ou à une action agoniste sur les récepteurs périphériques avant leur blocage (83, 106, 110, 114). Cette bradycardie peut être accompagnée d'arythmies telles que des blocs atrio-ventriculaires du 1er et 2ème degré (110). La tachycardie sinusale qui suit est accompagnée d'une augmentation de la consommation en oxygène du myocarde. Celle ci couplée à une diminution du temps de perfusion du muscle cardiaque, induite par la hausse de la fréquence peut être à l'origine de tachyarythmie comme des dépolarisations ventriculaires prématurée (23, 24, 77, 82, 110, 112) voire une ischémie myocardique et d'une décompensation cardiaque brutale chez le sujet dont le cœur est déjà fonctionnellement éprouvé (77). L'utilisation d'atropine en IV est aussi accompagnée d'une diminution du seuil de fibrillation ventriculaire (77, 82, 110). Elle est employée, chez le chien, à la dose de 0,02 à 0,05 mg/kg IV. Le glycopyrrolate est un anticholinergique de synthèse (ammonium quaternaire). Il présente les mêmes effets que l'atropine en ce qui concerne les sécrétions. Son action est plus longue, employé à la dose de 0,11 mg/kg IV, IM, SC (110). Il présente cependant l'intérêt d'avoir des effets cardiovasculaires moindres (23, 102, 110, 114). Il n'induit pas de bradycardie transitoire, du fait de son haut poids moléculaire il ne passe pas la barrière hémato-méningée (106, 112). A la dose de 5 à 10 µg/kg, la FC, la pression artérielle et la respiration ne sont pas affectées (112). 71 Au vu de leurs effets cardiovasculaires, les anticholinergiques sont à éviter en première intention chez le patient atteint d'IM dont la fonction cardiaque est déjà éprouvée (stade d'IM évoluée : III et IV) . Cependant certains auteurs suggèrent qu'ils peuvent être administrés si la chute de fréquence induite par d'autres agents se solde par une FC inférieure à celle antérieure à la sédation (3, 77) ou chez les patients dont le débit cardiaque dépend en grande partie du maintien de FC élevées : tamponnade, sténose pulmonaire ou aortique (77). Enfin, l'emploi d'anticholinergiques est recommandé chez les brachycéphales dont le tonus vagal est important. I. B - LES TRANQUILLISANTS I. B. 1 - Les tranquillisants mineurs : les anxiolytiques Ce sont les benzodiazépines, diazépam (Valium ND) et midazolam (Hypnovel ND) qui sont utilisés à cet effet (le zolazépam est uniquement utilisé en combinaison avec la tilétamine) . Ils ont une action calmante, myorelaxante et anticonvulsivante. L'effet sédatif est surtout flagrant chez l'homme qui semble beaucoup plus sensible que l'animal. Paradoxalement, on peut rencontrer une excitation suite à l'injection de valium (36 % des cas) (37). L'emploi des benzodiazépines est surtout recommandé pour éviter les crises épileptiformes et réduire le tonus musculaire induit par la kétamine (37, 83, 106, 110, 112, 114). Ils potentialisent l'effet des neurotransmetteurs inhibiteurs que sons8 Tw..7( que son)5.5(,Are l8.356 72 I. B. 2 - Les tranquillisants majeurs : les neuroleptiques Ces derniers regroupent les phénothiazines et les butyrophénones et se comportent comme des antagonistes de la dopamine vis à vis des récepteurs centraux et périphériques. Ils induisent une sorte de somnolence : ataraxie (indifférence vis à vis du milieu environnant) ainsi qu'une diminution de l'activité motrice spontanée (110, 112, 114). Ils potentialisent l'effet analgésique d'autres agents (analgésiques centraux, hypnotiques, anesthésiques locaux et généraux) sans pour autant avoir d'effet analgésique propre. Ils sont anti-émétiques de par leur action anti-dopaminergique sur la zone chémosensible de la moelle allongée (83, 110, 112, 114). a - les phénothiazines L'acépromazine est la molécule la plus employée, viennent ensuite la chlorpromazine, la pipéracétazine, la lévopromazine et la prométhazine. L'acépromazine est un agent neuroleptique de faible toxicité, il est utilisé à la dose de 0,03-0,1 mg/kg SC, IM ou IV sans toute fois dépasser 3 mg (112) . Il induit une bonne tranquillisation et myorelaxation, il diminue l'activité motrice spontanée et provoque, à haute dose, un état sédatif. Utilisé comme préanesthésique, il permet une induction plus aisée, de diminuer les doses d'anesthésiques requises. Le réveil s'effectue dans de meilleures conditions et l'incidence des vomissements diminue significativement. Il faut, cependant, éviter de l'utiliser chez des individus sujets à des crises épileptiformes car il en diminue le seuil d’apparition. Les effets neurologiques sont dus un l'action anti-dopaminergique mais aussi à un effet antagoniste sur les récepteurs adrénergiques inhibant ainsi le système nerveux sympathique en réduisant la mobilisation centrale et périphérique des catécholamines (82, 83, 114) . Les effets délétères cardiovasculaires de l'acépromazine, pour une dose de 0,1 mg/kg, sont les suivants : - une diminution de la pression artérielle d'environ 21% (107) expliquée par l'inhibition des centres vasomoteurs (hypothalamus), un effet anti alphaadrénergique (surtout alpha 1), un effet direct sur les fibres musculaires lisses vasculaires et un effet cardiodépresseur (82, 110, 112, 114). Ceci induit une baisse de la post-charge. - une baisse du débit cardiaque ( Q ) de l'ordre de 26% attribuée à une chute du volume d'éjection systolique d'environ 25% et une diminution des performances du cœur gauche (107). En effet, des moyens non-invasifs ont permis de mettre en évidence une baisse de la fraction de raccourcissement et du flux aortique révélant une atteinte de la fonction ventriculaire gauche. La baisse de la pression artérielle s'accompagne normalement d'une tachycardie réflexe sauf chez les brachycéphales : l'acépromazine peut induire une bradycardie d'origine vagale qui accentue alors l'hypotension et la chute du débit pouvant conduire à une syncope (110, 114). Les doses à employer doivent, alors, être diminuées (0,02-0,04 mg/kg IM) (110) et une prémédication avec des anticholinergiques est recommandée. L'hypotension peut être combattue par l'administration de noradrénaline, norépinéphrine, phényléphrine ou éphédrine qui possèdent une action béta-adrénergique très faible. Au contraire, l’adrénaline et l'épinéphrine, à activité bêta, sont contre indiquées car pourraient aggraver la chute tensionnelle (110, 112). A ceci on ajoute une fluidothérapie agressive. 73 La baisse de performance du ventricule gauche, quant à elle, serait imputable à un effet inotrope négatif et à une diminution du retour veineux (baisse de la précharge) (71, 107). L'effet cardiodépresseur est moindre avec la chlorpromazine. Outre ses effets cardiodépresseurs, l'acépromazine possède des propriétés antiarythmiques qui protègent le myocarde de l'action néfaste des catécholamines (91, 106, 114). Une étude conduite par GLYSON et GLENN (26) sur l'antiarythmogénicité de l'acépromazine a montré que, pour une dose de 0,025 mg/kg IV la dose d'épinéphrine nécessaire à l'apparition d'arythmies était multipliée par 3 . La raison en serait l'effet alpha 1 bloquant de l'acépromazine qui, couplé à une résistance vasculaire moindre, protégerait le myocarde. Il est connu qu'une augmentation de la résistance vasculaire, du travail du cœur et du besoin en oxygène du myocarde sont impliqués dans le développement des arythmies. Cet effet anti-arythmique a aussi été démontré à haute dose (0,4-1 mg/kg) sur des animaux anesthésiés aux barbituriques, à l'halothane et au méthoxyflurane (112). Enfin, l'acépromazine n'est pas dénué d'effets respiratoires. A la dose de 0,1 mg/kg, il produit une chute de 60% de la FR. Cependant, l'analyse des gaz sanguins ne montre pas de modification, suggérant alors une augmentation du volume courant ou une ventilation alvéolaire adéquate En dernier lieu, l'action de l'acépromazine sur l'hypothalamus supprime les phénomènes de thermorégulation exposant le patient à l'hypothermie qui s'aggrave par l'hypotension et la vasodilatation périphérique. b - les butyrophénones La seule à être utilisée en anesthésiologie vétérinaire est le dropéridol. Il induit, chez l'animal, à la dose de 1 mg/kg, une quiétude et une tranquillisation similaire à l'acépromazine (112, 114). A forte dose, 10-20 mg/kg IV, il engendre trémulations, spasmes musculaires et hyperirritabilité. Il antagonise l'effet stimulant des amphétamines et les vomissements induits par l'apomorphine (114) et les opiacés (110). Sa durée d'action est plus brève que celle de l'acépromazine (2 h contre 3 à 10 h). Comme cette dernière, c'est un antagoniste alpha adrénergique donc il est potentiellement hypotenseur (41, 110, 112). Bien que ses effets cardiovasculaires soient beaucoup moins prononcés, il convient de rester vigilant chez le malade cardiaque et le brachycéphale pour qui les doses seront diminuées à 0,5 mg/kg avec selon le cas une prémédication aux anticholinergiques Le dropéridol présente une action cardiodépressive directe moindre que l'acépromazine (110, 114) et antiarythmique identique (106, 110, 112, 114). Il est souvent utilisé avec un analgésique central : le fentanyl dans Innovar vet pour ses effets sédatif et anti-émétique 1000 fois supérieur à la chlorpromazine. Cette présentation se compose de 0,4mg de fentanyl et 20 mg de dropéridol par ml, 1 ml correspondant à la dose pour un animal de 30 à 60 kg I. C - LES ANALGESIQUES CENTRAUX I. C. 1 - Les analgésiques centraux : morphiniques ou opiacés Ils regroupent l'ensemble des molécules exogènes synthétisées qui se fixent sur les récepteurs des opioïdes endogènes que sont les enképhalines et endorphines. Il existe 3 types de récepteurs aux opiacés : sigma, mu et kappa dont les rôles sont plus ou moins établis. 74 Les morphiniques produisent une très bonne analgésie par dépression de la perception douloureuse ainsi que de son intégration et sa mémorisation (110). Ils inhibent la perception de la douleur au niveau de la corne dorsale, inhibent la sensibilité somatique au niveau supra spinal et activent les voies inhibitrices ascendantes (112). Ceci sans perte de la perception ni de la conscience .En effet la sensibilité tactile et les réflexes spinaux sont conservés (110, 112). La sédation est caractérisée par une indifférence psychique chez le chien. Les opiacés sont classés en 3 groupes. On les différencie par leur activité sur les différents récepteurs mais aussi par leur durée d'action et potentiel analgésique. Ainsi la phénopéridine et le fentanyl sont, respectivement, 70 et 100 fois plus puissant que la morphine. On trouve les Agonistes (morphine, fentanyl, phénopéridine) ; les AgonistesAntagonistes (buprénorphine, butorphanol) et les Antagonistes (naloxone). Les effets indésirables des morphiniques que l'on peut rencontrer sont : - une excitation possible chez le chien si l'injection est trop rapide (83, 110). - une dépression respiratoire d'origine centrale caractérisée par une bradypnée voire une diminution du volume courant (77, 110, 112, 114). Ceci s'explique par une réponse diminuée et retardée des centres respiratoires bulbaires devenus moins sensibles à la PaCO2 (77, 110, 114). Ce qui, à faible dose, engendre une baisse de la FR et, à forte dose, une diminution du volume courant (77, 110). L'apnée est possible lors de surdosage. MUIR insiste sur ce fait car la dépression respiratoire est plus marquée chez le patient inconscient ou anesthésié (77). Certains morphiniques sont moins dépresseurs respiratoires notamment la buprénorphine et le butorphanol au détriment d’autres effets (110) (salivation et vomissement plus importants (110, 112, 114)). Les valeurs hémodynamiques sont peu modifiées. La morphine, à la dose de 0,1 à 0,5 mg/kg IV, n’a pas d’action significative sur le myocarde. La FC et le rythme ne sont que peu affectés (77, 83, 106, 110, 112, 114). La seule modification rencontrée est une bradycardie mais cela dépend de la dose, de la molécule utilisée et de la voie d'administration (77). Ainsi la morphine ne modifie que peu la FC et le rythme, la bradycardie a été reliée à une augmentation de l'activité vagale par stimulation du noyau vagal médullaire (107, 114) et une réduction de l'activité sympathique suite aux effets sédatifs centraux (107). Une étude menée par MARTINEZ (74) a permis de mettre en évidence cet effet bradycardisant qui serait imputable à la stimulation vagale mais aussi à un effet dépresseur sur le nœud sino-atrial ralentissant la conduction de l'influx électrique car la vagotomie bilatérale ne supprime pas totalement la baisse de fréquence. Dans cette étude, l'injection de 16 µg/kg en IV de buprénorphine est suivie d'une chute de 20% de la FC dans les quinze premières minutes puis elle revient lentement à sa valeur d'origine. On constate également une baisse de l'index cardiaque (Q/ PV) due à la bradycardie et à une légère hypotension (74). Les morphiniques produisent en effet une vasodilatation périphérique par dépression des centres vasomoteurs responsable d'une baisse modérée de la pression artérielle (32, 71, 74, 106, 114). Dans une étude conduite par GREENE dans laquelle le butorphanol est injecté à la dose de 0,2 mg/kg chez un chien anesthésié à l'halothane ( 1,2%), la pression artérielle reste supérieur à 70 mm Hg ce qui ne compromet pas la perfusion tissulaire (32). Une vasodilatation plus sévère peut se rencontrer avec l'utilisation de morphine ou de mépéridine (moins fréquemment avec le fentanyl) du fait d'un relargage d'histamine (74, 77, 83, 110, 112, 114) induisant alors une hypotension mais aussi une bradycardie franche, une augmentation de la résistance pulmonaire et une diminution de 75 la compliance des poumons. Cet effet est dose dépendant ainsi l'injection doit être lente et la voie IM préférée. Remarque : l'effet vasodilatateur couplé à l'augmentation de la PaCO2 engendre une augmentation de la production de LCR pouvant se solder par une hypertension intracrânienne (77, 110). Il n'a pas été démontré d'action dépressive propre des morphiniques sur le myocarde. Au contraire, la morphine (0,1-0,5 mg/kg IV) a un effet inotrope positif (71, 83, 110). MUIR l'explique par un relargage d'épinéphrine ou de norépinéphrine par les terminaisons nerveuses sympathiques et adrénergiques (83). La buprénorphine n'induit pas de modification de la contractilité myocardique chez le chien anesthésié à l'isoflurane (74). La même expérience reconduite sur des animaux anesthésiés à l'halothane a, cependant, permis de mettre en évidence une diminution du volume d'éjection systolique de 17% due vraisemblablement à une potentialisation de l'effet de l'halothane sur la contractilité par le dérivé morphinique. Cet effet est à prendre en compte lors d'association avec d'autres anesthésiques. Il permet, en outre, de diminuer les doses requises, par exemple la méthadone ( 1 mg/kg ) permet de diminuer de 50% la dose de barbiturique (112), le butorphanol (0,1-0,3 mg/kg ) diminue la CAM de l'enflurane. L'association des morphiniques et des neuroleptiques est courante et produit une neuroleptanalgésie (notamment fentanyl et dropéridol) mais il faut bien garder à l'esprit que les opiacés potentialisent l'effet hypotenseur de ces neuroleptiques (74, 112). L'utilisation de l'antagoniste, la naloxone, est elle aussi sujette à caution. En effet, elle permet d'éviter toute action néfaste d'une éventuelle overdose mais son action réversible brutale n'est pas dénuée de danger. Ainsi GREENE constate qu'en réponse à l'injection de 0,04 mg/kg IV chez des chiens ayant préalablement reçu 0,2 mg/kg IV de butorphanol, 2 animaux sur 6 développent, simultanément à l'augmentation du rapport FC/ pression, des contractions ventriculaires prématurées. Il rattache ce fait à une augmentation du besoin en oxygène du myocarde et une hausse brutale de la FC induisant une hypoxie myocardique (32). De pareilles dysrythmies ventriculaires ont été observées après l'utilisation de naloxone chez l'homme en vue d'antagoniser la morphine ou chez le chien anesthésié au thiamylal (32). L'utilisation des morphiniques et leur action euphorisante permet de supprimer l'anxiété et le stress qui contribuent à accentuer certains effets néfastes, la suppression de la douleur en post -opératoire permet d'éviter la tachycardie et l'hypertension inhérente à cette sensation. Ainsi les changements hémodynamiques propres aux morphiniques, bien que significatifs, ne sont pas assez importants et trop transitoires pour craindre leur emploi chez des sujets sains. Par contre, leur effet synergique dépresseur avec d'autres agents doit être pris en compte chez des animaux dont la fonction cardiaque est compromise. I. C. 2 - Les analgésiques sédatifs : α 2 agonistes La xylazine (Rompun ND) et la médétomidine (Domitor ND) en sont les 2 chefs de file. Les α2 agonistes sont des médiateurs de l'analgésie, de la sédation et sont de plus anxiolytiques et anticonvulsivants (à faible dose). Ces effets sont induits par l'action sur le SNC (112). Ils provoquent une diminution de la libération centrale et périphérique de noradrénaline par la stimulation des récepteurs α2 adrénergiques présynaptiques (20, 31, 77, 110, 112, 76 114) et ceux de la dopamine (114) induisant alors une diminution du tonus sympathique (31, 77, 83, 110, 112, 114). Ils agissent sur différents récepteurs retrouvés dans les mêmes parties du cerveau, couplés au même transducteur : la protéine G. Le mécanisme d'action fait intervenir une hyperdépolarisation par activation de la chaîne du potassium (20, 48). La sédation est induite par action sur un site principal : le locus ceruleus (chez l'homme, l'effet secondaire majeur de la clonidine, un α2 agoniste utilisé dans le traitement de l'hypertension, est la sédation) (20, 112). L'analgésie obtenue est équivalente à celle des opioïdes sans les effets dépresseurs respiratoires et la dépendance (112). Elle résulte de la stimulation de récepteurs de différents sites des voies de la douleur tant au niveau médullaire que supra-spinal (20). La durée d'action est plus courte que celle de la sédation (de10 à 30 minutes pour 1 à 2h pour la sédation) (112). L'effet anxiolytique est, quant à lui, indépendant de l'effet sédatif (la clonidine supprime la réponse noradrénergique au stress d’immobilisation) (112). La myorelaxation obtenue est satisfaisante, un effet anticonvulsivant a été mis en évidence pour des faibles doses et bloque les crises induites par les phénothiazines. A l'inverse, à forte dose, il y a annulation des effets inhibiteurs α2 par activation des récepteurs α1 (112). Les α2 agonistes sont utilisés comme pré-anesthésiques aux doses respectives de 0,20,5 mg/kg IV et 0,5-1 mg/kg IM pour la xylazine et 10-40 µg/kg IV et 40µg/kg IM pour la médétomidine. Outre leurs effets propres (sédation, analgésie et myorelaxation), ils permettent de diminuer les doses des autres agents et potentialisent leurs effets (110, 112, 114). Ainsi une dose de 10 µg/kg de médétomidine permettrait de réduire la CAM d'halothane de prés de 90% (110) et la xylazine à la dose recommandée diminuerait de 1/3 à 1/2 les doses de barbituriques (31, 112). Les effets cardiovasculaires sont conséquents. L'injection d'α2 agonistes induit une bradycardie et une hypotension sévère précédée d'une période d'hypertension (20, 31, 48, 83, 100, 106, 110, 111, 114). Cette hypertension initiale est produite par l'activation des récepteurs adrénergiques postsynaptiques périphériques qui induisent une contraction des muscles lisses vasculaires (20, 31, 100, 110, 112, 114): on note une hausse de 45 mm Hg dans les premières 10 minutes (100). Une prémédication avec une molécule calcium bloquant comme la rifédipine permet de juguler cette hypertension (20, 112). La chute tensionnelle semble, quant à elle, résulter de la diminution du tonus sympathique corrélée à l'action centrale et à l'activation des récepteurs α2 présynaptiques des neurones sympathiques par les α2 agonistes. A ce moment, les effets centraux prédominent sur les effets périphériques. La diminution du tonus sympathique et la stimulation du système vague expliquent la bradycardie ( 20, 31, 48, 77, 83, 112). La fréquence cardiaque, après injection de médétomidine et de xylazine, diminue respectivement de 38 et 34 % (100). On peut noter aussi des blocs du 1er et 2nd degré voire des blocs complets ( la durée dépend de la dose injectée ) (83). Une action directe sur le myocarde n'a pas été prouvée mais est suspectée. Une étude échocardiographique des effets des 2 agents a permis de révéler de sévères réductions de la fonction cardiaque telles que la chute de la fraction de raccourcissement d'environ 77 40%, l'augmentation de la taille de l'atrium gauche (13% pour la xylazine, 19% pour la médétomidine) avec apparition de reflux mitral de modéré à sévère sur des cœurs sans atteinte préalable. On note aussi une diminution de l'épaisseur de la paroi postérieure du ventricule gauche en fin de diastole (100). Ces modifications prouvent l'action inotrope négative des α2 agonistes sur le myocarde (31, 100) dont la cause peut être l'hypertension ou un effet direct sur le muscle cardiaque avec bradycardie et diminution de la contractilité induisant une baisse de débit et de pression. L'augmentation de la taille de l'atrium gauche est en relation avec la chute de la vidange ventriculaire causée par la baisse des performances contractiles du cœur. Cette dilatation soudaine causerait une distension de l'anneau atrio-ventriculaire elle même responsable d'une mauvaise coaptation des feuillets mitraux à l'origine de régurgitations (100). Les effets bradycardisant, hypertenseur initiaux et l'augmentation de la résistance vasculaire périphérique (31) contribuent à réduire fortement le débit cardiaque (de 1/3 à 1/ 2) (77). L'action vasopressive intervient en plus sur les coronaires pouvant alors induire des épisodes d'hypoxie myocardique .Ceci est à prendre en considération chez des animaux dont le myocarde est susceptible de développer des arythmies. L'utilisation d'anticholinergiques afin de prévenir la bradycardie est légitime (20, 77, 112) mais elle s'accompagne en retour de tachycardie et d’hypertension. L'effet de l'atropine peut potentialiser l'action vasopressive initiale des α2 agonistes en bloquant la bradycardie réflexe en réponse à l'augmentation de pression .L'administration d'anticholinergiques avant, simultanément ou après celle de médétomidine (30-60 µg/kg) causerait l'apparition de BAV, de contractions ventriculaires prématurées ou une tachycardie même si l'incidence est plus faible avec le glycopyrrolate (20, 112). Le caractére arythmogène des α2 agonistes est, quant à lui, contesté. Plusieurs études ont montré l'action arythmogène de la xylazine (1,1 mg/kg) sur les ventricules qu'elle soit utilisée seule ou combinée à d'autres molécules. Ainsi MUIR et Coll ont observé que le seuil de fibrillation à l'épinéphrine chez des chiens anesthésiés avec thiamylal et halothane, diminuerait avec la xylazine (31, 67, 81). Lors d'emploi de la xylazine, des morts inexpliquées pourraient résulter de son effet sensibilisateur du myocarde aux catécholamines circulantes (83, 110, 114). Cependant l'utilisation de dexmédétomidine (isomère dextrogyre de la médétomidine) a récemment révélé une action antiarythmique attribuée à la stimulation des récepteurs α2 centraux et à l'action sympatholytique. HAYASHI et al ont aussi démontré une diminution de l'arythmogénicité de façon dose dépendante chez le chien anesthésié à l'halothane. Cet effet serait imputable à l'action centrale des α2 agonistes et la vagotomie bilatérale la supprimerait prouvant le rôle très important de l'activité vagale (68, 77). Les effets cardiovasculaires sont moindres après une injection IM (hypertension initiale moins prononcée et résistance vasculaire atténuée liées aux concentrations sanguines en α2 agonistes diminuées) . D'autres effets secondaires sont à noter lors de l'emploi d'α2 agonistes, notamment une dépression respiratoire d'origine centrale avec baisse de la fréquence et du volume courant pouvant conduire à une acidose et une hypoxémie (ceci se rencontre plutôt pour des doses élevées, 1 mg/kg IV de xylazine, mais peut aussi être observé aux doses recommandées) (77, 83). Des vomissements sont aussi notés, surtout après une injection IM (8 à 20% des cas) (20, 31) ainsi que des fasciculations musculaires et une 78 hypersensibilité aux bruits. Le risque d'hypothermie est accru par action sur les récepteurs α2 de l'hypothalamus (20, 83, 112). Les effets des α2 agonistes peuvent être antagonisés par l'utilisation d'atipamézole ou de yohimbine (l’atipamézole étant 100 fois plus affin pour les récepteurs α2 et n'ayant pas d'effet sur la fonction myocardique selon FLACKE et Coll) (20). L'atipamézole annule rapidement les effets cardiovasculaires de la médétomidine à une dose 4 à 6 fois celle de l’α2 agoniste en IM. On observe une hypotension transitoire (baisse d'environ 8 à 20% de la pression) attribuable au renversement de l'effet périphérique de la médétomidine se soldant par une vasodilatation (20, 48). Son utilisation n'est alors pas dénuée de risque. L'emploi des ces agents comme pré-anesthésiques n'est pas recommandé voire même contre-indiqué quelque soit le stade clinique d'insuffisance mitrale du fait de leurs effets sur le cœur et les constantes hémodynamiques. II - LES ANESTHESIQUES INJECTABLES La réalisation d'une anesthésie générale, avec ou sans prémédication, repose sur l'emploi d'anesthésiques généraux que l'on subdivise en 2 parties : les anesthésiques injectables, administrés par voie parentérale et les anesthésiques volatils, résorbés par les poumons, que l'on développera ultérieurement. Nous nous limiterons aux substances injectables disponibles en France, à savoir, les dissociatifs, les barbituriques, le propofol et l'étomidate II. A - LES DISSOCIATIFS Cette appellation vient du fait qu'ils agissent en interrompant la voie ascendante entre la partie consciente et inconsciente du cerveau. Un électroencéphalogramme met en évidence une interruption des influx entre thalamus et système limbique. L'animal, ainsi anesthésié, se trouve en état de catalepsie dans lequel les yeux restent ouverts avec un léger nystagmus. L'analgésie est superficielle et de courte durée et la myorésolution inexistance. En effet, une hypertonie musculaire se met en place et des mouvements spontanés peuvent être observés par stimulation lors de la chirurgie. Parmi ces agents, on trouve : la kétamine, la tilétamine (associée au zolazépam) et la phencyclidine (plus utilisée à ce jour). II. A. 1 - la kétamine Après une injection IV, celle ci traverse la barrière hémato-méningée et se concentre dans le cerveau en moins d'une minute (l’injection IM est déconseillée chez le chien car très douloureuse du fait du pH de la solution = 3,5) Les effets sur le SNC engendre un état d'inconscience et une analgésie (correcte au niveau des territoires cutanés mais insuffisante pour les viscères) (41, 111). Le principal site d'action est le système thalamo-cortical. On note une dépression de l'axe néocortico-thalamique et du noyau central du thalamus, une stimulation des parties du système limbique dont l'hippocampe, une inhibition de l'activité des cellules nociceptives de la formation réticulée de la moelle allongée (41). Cet effet paradoxal dépression / stimulation est à l'origine de l'appellation dissociatif. 79 L'utilisation de la kétamine chez les épileptiques est déconseillée car elle peut provoquer l'apparition de crises (24, 41, 83, 111), même s'il a été prouvé qu'à faible dose elle avait un effet anticonvulsivant par son action antagoniste sur les récepteurs Nméthyl-D-aspartate. Le mécanisme responsable de l'analgésie est encore mal connu et semble impliquer de nombreuses actions (41): - inhibition du tractus spinoréticulaire - dépression de l'activité du noyau de la formation réticulée de la moelle médiale - interactions avec les récepteurs aux opiacés - dépression de l'activité des relais périphériques des voies nociceptives de la moelle épinière (111) et des relais centraux (thalamo-corticaux) du message douloureux La kétamine induit une augmentation de la pression intracrânienne, du débit sanguin cérébral et de la production de LCR (38, 41, 83, 111) due à une augmentation de la pression sanguine et la vasodilatation. Cependant la PaCO2 semble jouer un rôle important. En effet, si elle est maintenue entre 25 et 30 mm Hg au niveau cérébral, on n’observe pas d'augmentation de la pression intracrânienne Les effets cardiovasculaires de la kétamine se résument à une stimulation indirecte de la fonction cardiaque par un effet sympathomimétique sur le SNC, une inhibition du recaptage intra et extraneuronal des catécholamines, une vasodilatation et une action inotrope positive sur le myocarde (41). On observe, suite à l'injection, une augmentation de la FC et de la pression sanguine (42, 71) dues à la stimulation du SNC et à l'augmentation du tonus sympathique (interviendrait aussi une inhibition de la composante vagale des barorécepteurs) (42). La résistance vasculaire périphérique reste, quant à elle, inchangée. L'action inotrope positive est mis en évidence par une hausse du travail du cœur (37, 41) et de la consommation en oxygène (71, 106). Ce besoin supplémentaire est permis par une augmentation du débit et une dilatation des artères coronaires. Cependant, des études tendent à démontrer que dans certaines situations, ces modifications ne sont pas suffisantes (41). Cet effet inotrope est, de plus, relatif. En effet, la kétamine améliore la contractilité d'un cœur dont la fréquence est gardée constante par stimulation atriale mais a un effet inverse sur un cœur dénervé. COOK et Coll (41) suggèrent que l'effet inotrope de la kétamine serait du à une inhibition de la reprise en charge des catécholamines au niveau de la jonction neuro-effectrice induisant ainsi une stimulation des récepteurs α2 adrénergiques. L'effet direct de la kétamine sur le cœur serait une diminution de la contractilité mais, in vivo, il serait compensé par l'action sur le système autonome cardio-accélérateur (38, 42, 111). Lors d'administration IV rapide, l'effet délétère peut se manifester avant le mécanisme compensateur et être à l'origine d'une hypotension fugace ( 1 à 2 minutes ) et d'une baisse du débit cardiaque surtout chez les malades cardiaques pour qui les possibilités de stimulation sympathique restent très limitées (41, 111). Enfin, la kétamine sensibiliserait le myocarde aux catécholamines circulantes mais de façon moindre que les barbituriques (34, 41, 83, 111). D'autres effets secondaires sont notés, notamment une stimulation des sécrétions salivaire, lacrymale et trachéobronchique (pouvant affecter la fonction respiratoire même si les réflexes laryngés sont conservés) (41, 83, 111) et une diminution de la FR ainsi que du volume courant. A forte dose, les mouvements respiratoires sont 80 superficiels et irréguliers avec une chute de la PaO2 voire une augmentation de la PaCO2 et une baisse du pH sanguin (83). Les effets délétères de la kétamine font qu'elle doit être évitée chez l'hypertendu ou le patient atteint d'insuffisance cardiaque congestive mais peut être utilisée chez l'insuffisant mitral dans les premiers stades ( I et II ) car le cœur peut encore supporter un travail forcé. Cependant, elle est rarement utilisée seule car l'hypertonie musculaire ou les éventuelles crises convulsives recommandent l'emploi d'agents annexes tels que les benzodiazépines, les phénothiazines ou les α2 agonistes (24, 41, 42, 71, 83, 111). • Association kétamine – benzodiazépines L'emploi du valium combiné à la kétamine aux doses respectives de 0,5 mg/kg et10 mg/kg permet de supprimer ou, du moins, de diminuer l'hypertonie musculaire, l'incidence des crises et la salivation (37). L'injection de valium permet une stimulation cardiovasculaire moindre (37, 41, 42). Le midazolam peut aussi être utilisé dans ce but et montre une bien meilleure efficacité (41). L'anesthésie dure 12 à 15 minutes avec une augmentation significative de la FC et une dépression respiratoire plus importante qu'avec la kétamine seule (37). Le valium modère les effets cardiovasculaires (hormis l'augmentation de la FC) mais accentue les effets respiratoires de la kétamine. Il présente, de plus, des propriétés antiarythmiques intéressantes dans ce cas. En dernier lieu, cette association accroît l'incidence des vomissements par rapport à la kétamine seule. • Association kétamine – acépromazine Celle ci, aux doses respectives de 10 à 11 mg/kg et 0,11 mg/kg IV, permet d'obtenir une anesthésie de 10 à 35 minutes (28) avec une bonne myorésolution et un réveil beaucoup plus doux qu'avec la kétamine seule. L'effet hypotenseur de l'acépromazine permet d'émousser l'hypertension et la hausse de la FC induites par le dissociatif (28). L'effet dépresseur respiratoire est plus marqué que lors de l'emploi de kétamine seule (28). • Association kétamine - α2 agonistes Utilisés aux doses respectives de 10 mg/kg IM et 1,1 mg/kg IM, la kétamine et la xylazine permettent d'obtenir une anesthésie de 25 à 40 minutes .La xylazine induit une bradycardie et des blocs atrio-ventriculaires du 2nd degré qui peuvent être minimiser par l'effet stimulateur cardiaque de la kétamine. Si les arythmies deviennent trop inquiétante, l'atropine peut être utilisée (112). L'emploi simultané de kétamine à 5 mg/kg IM et de médétomidine à 40 µg/kg IM induit une anesthésie de 20 à 35 minutes. La baisse significative du débit cardiaque de l'ordre de 50 % dans les 15 premières minutes est due à la diminution du volume d'éjection systolique, à la baisse de la contractilité myocardique et à une augmentation de la postcharge (103). Les changements rapides des valeurs hémodynamiques suivant l'injection d'un mélange kétamine - α2 agonistes, ainsi que l'effet globalement cardiodépresseur, ont convaincu les praticiens de ne pas employer ce mélange chez le patient dont la fonction cardiaque est altérée (112). 81 II. A. 2 - tilétamine - zolazépam ( Zolétil ND - Télazol ND ) La tilétamine induit les mêmes modifications cardiovasculaires que la kétamine, soit une augmentation de la FC et de la pression artérielle mais une action inotrope négative sur cœur isolé (41, 111). La cardiostimulation serait le résultat de l'effet sympathomimétique central (41, 83, 111). Le zolazépam, quant à lui, employé sur l'animal anesthésié au pentobarbital, ne semble pas induire d'effets indésirables sur la fonction cardiaque même à des doses massives (dose cumulée de 61 mg/kg en IV) (41). Chez le chien conscient, l'emploi de zolazépam de façon chronique, à la dose de 2 mg/kg, n'a pas modifié les constantes hémodynamiques. Par contre, pour une dose de 10 à 50 mg/kg, on a noté une diminution de la résistance vasculaire périphérique et de la pression sanguine systémique. En réponse à l’hypotension, une tachycardie réflexe avec baisse du volume d'éjection, ainsi qu'une augmentation de la contractilité myocardique sont observées (41). L'emploi de zolazépam combiné à la tilétamine permet de doubler la durée de l'anesthésie avec la tilétamine seule, mais aussi d'éviter la rigidité musculaire ainsi que les mouvements convulsifs produits par le dissociatif. Les effets cardiovasculaires de cette association, pour des doses allant de 2 à 19,8 mg/kg, chez le chien non prémédiqué, sont une augmentation de la FC attribuée à la stimulation du SNC, du tonus sympathique et diminution du tonus vagal (41, 83). Une prémédication à l'acépromazine permet de diminuer l'ampleur de la tachycardie. Des variations de la pression artérielle et de la résistance vasculaire ont été notées avec une diminution puis une augmentation des 2 paramètres. Ce changement serait imputable, en grande partie à la tilétamine. En effet, l'injection intra-artérielle, chez le chien, se solde par un effet dépresseur sur la pression de perfusion (expliquant l'hypotension initiale) puis vient l'effet sympathomimétique (41). L'association tilétamine / zolazépam n'a que peu d'effet sur le débit cardiaque. On note une légère augmentation suite à la tachycardie (41). De plus, elle ne semble pas sensibiliser le cœur à l'action arythmogène des catécholamines circulantes. Un effet sur la fonction respiratoire n'intervient que pour des doses élevées de l'ordre de 20 mg/kg (111). Ceci se manifeste par de courtes périodes d'apnée d'environ 1 minute suivies d'une respiration lente, irrégulière et superficielle avec chute de la PaO2 sans variation de la PaCO2. Les anesthésiques dissociatifs sont intéressants en ceci qu'ils sont les seuls à stimuler le cœur. Cependant, même utilisés avec une prémédication visant à émousser leurs effets secondaires, l'augmentation de la FC et du travail du cœur qu'ils induisent en font des agents à éviter chez le sujet atteint d'insuffisance mitrale évoluée (stade III et IV). En effet, la tachycardie diminue le temps de perfusion du myocarde (diastole) qui, de son côté, voit ses besoins en oxygène augmenter ceci pouvant se solder par une ischémie myocardique voire une décompensation brutale de son atteinte cardiaque. 82 II. B - LES BARBITURIQUES Ils sont classés en 4 groupes selon leur durée d’action : longue, intermédiaire, courte et ultra-courte. En anesthésie, seules sont utilisées les molécules d’action courte et ultra-courte. Ce sont des agents d’induction par excellence. Les molécules d’action longue et intermédiaire sont réservées au contrôle des crises d’épilepsie. Les barbituriques agissent sur des parties du recepteur au GABA distinctes de celle des benzodiazépines, en diminuant le taux de dissociation GABA-récepteur ce qui induit une augmentation de la durée d’ouverture des canaux Cl- et une hyperpolarisation marquée (113). Les barbituriques sont des hypnotiques / sédatifs regroupés en 2 catégories : - les oxybarbituriques d’action ultra-courte à longue - les thiobarbituriques d’action ultra-courte (de 10 à 20 minutes) Leur emploi se solde par une bonne sédation et myorésolution mais une analgésie de faible intensité (113). Aux doses hypnotiques, il y a peu d’effets respiratoires, par contre aux doses anesthésiques, on note une nette dépression pouvant aller jusqu’à la paralysie des muscles respiratoires et la mort en cas d’overdose. Aux doses anesthésiques, les barbituriques induisent une dépression de la fonction cardiovasculaire lorsqu’ils sont administrés en bolus ou en grande quantité. Ceux ci peuvent être à l’origine d’une hypertension initiale (83, 115) due vraisemblablement à la tachycardie et à une augmentation de la résistance vasculaire, elles mêmes imputables à une augmentation du tonus sympathique (77). D’autres hypothèses ont été avancées afin d’expliquer cette hypertension notamment une dépression de la sensibilité des barorécepteurs ou une vasoconstriction par relargage de Calcium ou de norépinéphrine (115). Les effets hypotenseur et dépresseur cardiaque peuvent se révéler dramatique chez le patient cardiopathe. Il se traduit par une chute du débit de l’ordre de 33 % (115) et un effet inotrope négatif (77, 83, 111, 115). Le second aspect délétère cardiovasculaire des barbituriques est leur arythmogénicité. Ils accroissent, en effet, le tonus sympathique et parasympathique ce qui peut être à l’origine d’arythmie atriale comme une bradycardie sinusale ou des BAV du 1er, 2nd ou 3ème degré voire un arrêt cardiaque (83, 111) mais aussi d’arythmies ventriculaires : tachycardie, extrasystoles, bigéminisme ( 24, 83, 113). C’est pourquoi, il est recommandé de prendre le pouls en même temps que l’injection ce qui permet de noter l’apparition de dysrythmies. Balonner le patient pendant un instant serait suffisant pour faire disparaître cette dysrythmie (24). Les barbituriques potentialisent, de plus, l’effet arythmogène de l’halothane, du méthoxyflurane ou de la xylazine en sensibilisant le cœur aux catécholamines (24, 38, 77, 83, 111, 113). L’emploi de lidocaïne permet de réduire l’effet dépresseur cardiaque et a été recommandé pour l’induction de patients prédisposés aux arythmies (113). Au vue des conséquences cardiovasculaires, ces agents sont à éviter chez l’insuffisant mitral ou à employer avec précaution et juste pour l’induction (71). En effet, les injections répétées se soldent par un réveil très long, du au relargage lent du produit qui s’est stocké dans les graisses, mais aussi par une hypothermie suite à la baisse du 83 métabolisme basal. L’emploi associé d’halothane ou de méthoxyflurane inhibe de façon compétitive l’oxydation du pentobarbital, hexabarbital et amobarbital prolongeant ainsi leur durée d’action. Le thiopental (Nesdonal ND) est utilisé à la dose de 10-12 mg/kg IV stricte. On injecte, dans un premier temps, 1/3 de la dose puis 30 seconde plus tard on poursuit jusqu’à obtenir l’effet désiré. II. C - LE PROPOFOL C’est un dérivé phénolé utilisé uniquement en IV. D’action très rapide, celui ci est un très bon agent d’induction (47, 62, 83, 111, 113). Il est alors employé en bolus de 4-6 mg /kg (25% d’un trait et le reste jusqu’à obtention de l’effet désiré) (113). En perfusion (0,15 à 0,4 mg/kg/minute), il sert au maintien de l’anesthésie (narcose) . L’analgésie est de faible intensité (83, 111, 113), il est donc conseillé de l’utiliser en combinaison avec d’autres molécules (tranquillisants, antalgiques) (62). L’emploi d’acépromazine permet, à la fois, d’améliorer l’analgésie, de réduire la dose d’induction de 30% (111, 113) et celle d’entretien de 50% (effet potentialisateur retrouver avec le fentanyl) (111), mais aussi de diminuer l’incidence des vomissements au réveil de l’anesthésie qui représente, selon les auteurs, de 15 à 16% des cas (111, 113). Une propriété encore intéressante du propofol est le réveil très rapide après l’arrêt de la perfusion sans excitation (62, 77, 113). Ceci provient de la métabolisation très rapide du produit par le foie et le fait qu’il n’existe pas d’accumulation suite aux injections répétées. L’utilisation de cet agent n’est cependant pas dénuée d’effets secondaires. On observe, notamment, une dépression respiratoire modérée, une apnée pouvant survenir suite à une injection trop brutale (83, 106, 111, 113). Celle ci est réversible et facilement contrôlable par assistance respiratoire (100% d’oxygène). Afin d’éviter ce problème, il est recommandé d’injecter le produit en 10 à 40 secondes. Les effets cardiovasculaires sont plus marqués lors d’une anesthésie au long cours (infusion ou bolus répétés de 0,5 à 2 mg/kg). On observe une diminution de la pression artérielle et de la résistance vasculaire ainsi qu’une chute modérée du débit et une tachycardie réflexe (47, 62, 83, 113). Pour un rythme de perfusion de 0,4 mg/kg/min, la pression artérielle diminue de 15% et la RVS de 23% (62). L’hypotension résulte d’une vasodilatation par relâchement des fibres musculaires lisses vasculaires ainsi que d’une dépression de l’activité des centres neuro-végétatifs. Elle est à l’origine d’une baisse de la postcharge (62). La veinodilatation, quant à elle, induit une baisse de la précharge pouvant expliquer la baisse du débit cardiaque (47). Le propofol induirait aussi un effet cardiodépresseur direct sur le myocarde (106, 111) avec une diminution de la contractilité plus importante qu’avec le thiopental (24, 47, 113), et il potentialiserait l’effet arythmogène de l’épinéphrine bien qu’il ne le soit pas lui même (113). II. D - L’ETOMIDATE C’est un dérivé imidazole synthétisé en 1965 et utilisé en induction, chez l’homme, en 1975. Il a un effet hypnotique et la formation réticulée cérébrale semble en être le principal site d’action (83, 113). 84 Tout comme le propofol, l’étomidate a peu d’effet analgésique (24, 78, 83, 113) et réclame l’emploi d’agents annexes si on souhaite une anesthésie sous étomidate. Son élimination rapide par hydrolyse hépatique et excrétion urinaire, rend sa durée d’action assez courte ( 8 minutes pour une dose de 1,5 mg/kg ) et le réveil rapide (78, 113). L’étomidate n’a que peu d’effets cardiovasculaire et respiratoire. On observe uniquement une variation de la FC et une diminution de la FR (pour des doses supérieures à 4 mg/kg) (113). L’effet variable sur la FC est expliqué par une modification de la sensibilité des barorécepteurs, une stimulation de l’activité du système nerveux sympathique et une action dépressive directe minime sur le cœur (78). Dans l’étude conduite par MUIR et MASON, une dose de 4 mg/kg IV induit une diminution de la FC d’environ 20% à 10 minutes puis elle retrouve sa valeur d’origine petit à petit. Une dose plus faible ne provoquerait pas de diminution significative voire même une augmentation (78). Aux doses recommandées pour l’induction (1,5-3 mg/kg), l’étomidate n’induit aucun changement de FC, pression artérielle ou performances cardiaques (24, 83, 113) et l’effet dépresseur respiratoire n’intervient que pour des doses supérieures à 4 mg/kg (78) avec chute de 50% de la FR voire une apnée (78, 83) Sa très large innocuité et le fait qu’il n’induise pas de relargage d’histamine, font de ce produit un agent anesthésique de prédilection pour l’induction du cardiopathe. Il présente, cependant, des effets secondaires qu’il convient de connaître. Outre les myoclonies, les nausées et vomissements per et post-opératoires qu’il est possible de minimiser par l’emploi de valium ou d’antalgiques, l’utilisation d’étomidate s’accompagne d’une inhibition de la fonction surrénalienne. Une injection peut aboutir à une suppression de plus de 3 heures de la synthèse des stéroïdes (113). Cet effet est ambiguë, d’un côté, il atténue le stress du à l’opération, mais d’un autre, il peut induire des crises d’hypoadrénocorticisme suite à une perfusion continue. Cette action est néfaste chez les animaux choqués pour lesquels l’étomidate représente, en lui même, un agent sûr du côté cardiovasculaire (92). En résumé, l’étomidate est peut être l’un des meilleurs agents d’induction chez le patient insuffisant mitral quelque soit le stade même si son coût est élevé. III - LES ANESTHESIQUES VOLATILS Ces agents sont la plaque tournante de l’anesthésie de longue durée. En effet, certains liquides anesthésiques sont suffisamment volatils pour atteindre des concentrations dans l’air inspiré permettant l’induction et le maintien de l’anesthésie. Leur emploi nécessite un appareil comprenant une source d’oxygène (le vecteur) et un circuit respiratoire. Leur popularité vient du fait que leur pharmacocinétique favorise une anesthésie rapidement ajustable. La profondeur de la narcose résulte de l’équilibre entre la résorption et l’élimination de ces agents, par le poumon. Le circuit respiratoire permet, de plus, de diminuer les risques de mortalité car il facilite la ventilation respiratoire et l’oxygénation. Cependant, ce confort relatif ne doit pas faire oublier que ces agents présentent, tout de même, certains effets toxiques qu’il faut avoir à l’esprit. 85 III. A - LES HALOGENES III. A. 1 - Considérations générales Les principaux agents anesthésiques volatils sont les composés halogénés dérivés du méthane ou de l’éthane, dont les poids moléculaires sont suffisamment faibles pour pouvoir traverser les membranes biologiques. Les 2 substances les plus utilisées en France sont l’halothane (Fluothane ND) et l’isoflurane (Forène ND), le méthoxyflurane (Penthane ND ou Métofane ND) en voie de disparition et l’enflurane (Ethrane ND) sont peu utilisés chez l’animal (24). D’autres, plus récents, sévoflurane et desflurane, font encore l’œuvre de tests. L’efficacité d’un agent volatil dépend de plusieurs paramètres : la pression de vapeur saturante, la solubilité dans le sang et la liposolubilité conditionnant la pénétration dans le cerveau sont des facteurs intrinsèques à l’agent. Les 2 premiers conditionnent la rapidité de l’agent à atteindre des concentrations alvéolaires anesthésiques. Plus la pression de vapeur saturante sera élevée et plus on atteindra rapidement les concentrations adéquates. Plus la solubilité est importante, au niveau de l’alvéole, est plus il sera difficile d’atteindre cette concentration car le gaz aura tendance à quitter l’alvéole. Interviennent aussi des facteurs extrinsèques : le débit ventilatoire, le rapport perfusion / ventilation, le débit cardiaque et le débit sanguin cérébral. Mais, en général, le pilier de l’action d’un anesthésique volatil est sa concentration alvéolaire. La maîtriser, c’est maîtriser la profondeur de l’anesthésie. La CAM (concentration alvéolaire minimale) correspond à la concentration nécessaire pour supprimer toute réaction réflexe à un stimulus douloureux chez 50 % des animaux. De même, on calcule l’index anesthésique correspondant au rapport entre la concentration anesthésique nécessaire pour induire une apnée d’une minute environ et la CAM. Cet index représente le potentiel dépresseur respiratoire de la molécule. III. A. 2 - l’halothane L’halothane présente une bonne liposolubilité, meilleure pour le tissu nerveux que pour les graisses et une solubilité dans le sang moyenne. Sa CAM et l’état d’équilibre sont atteints rapidement, sa résorption est bonne et sa distribution vers le cerveau rapide car le sang ne joue pas le rôle de réservoir. La période de réveil est courte et la redistribution tissulaire minime (18, 105). L’halothane induit une dépression du SNC ainsi qu’une myorésolution et une analgésie satisfaisantes. Les effets cardiovasculaires sont, somme toute, pratiquement les mêmes pour tous les anesthésiques volatils mais la différence se fait sur la sévérité de l’atteinte. On note une hypotension plus ou moins marquée avec baisse de la pression artérielle systolique, diastolique et moyenne due à une vasodilatation (diminution de la résistance vasculaire périphérique) ainsi qu’une diminution du débit cardiaque de façon dose dépendante induite par une dépression myocardique directe (effet inotrope négatif : l’index cardiaque, l’index d’éjection et le travail du cœur gauche diminuent) (12, 18, 105). MUTOH et Coll ont étudié les effets hémodynamiques des différents agents à différentes concentrations (84). Pour une concentration de 1,5 CAM, l’halothane accroit modérément la FC et fait chuter la pression de 20%. La baisse de contractilité cardiaque est parfois contrebalancée par la hausse de la fréquence mais le débit reste toujours diminué (12, 18, 84, 105). 86 La vasodilatation peut être considérée comme favorable car concerne, en particulier, le territoire cérébral. Cependant, il faut surveiller que l’hypotension ne deviennent pas trop sévère. Une autre action néfaste des halogénés est leur capacité à induire une sensibilité du myocarde à l’effet arythmogène des catécholamines, l’halothane en particulier. Ils accroient l’automaticité du myocarde et la probabilité d’impulsion propagée depuis des sites ectopiques ventriculaires (12, 18, 77, 84, 105). L’halothane, par exemple, diminue la dose arythmogène de l’épinéphrine à 2,2 µg/kg/minute (84, 105). Les halogénés peuvent induire l’apparition d’extrasystoles ventriculaires voire de dysrythmies plus grave comme la fibrillation. Paradoxalement, l’augmentation de la concentration en halothane diminue l’incidence de ces troubles du rythme (18, 105). Cette sensibilité accrue du myocarde aux catécholamines en présence d’halogénés est moins importante lorsqu’un groupement éther est présent dans la molécule. C’est pourquoi les agents les plus récents ont tous cette caractéristique à la différence de l’halothane (105). L’halothane présente le caractère dépresseur respiratoire le moins prononcé de tous les halogénés (index anesthésique supérieur aux autres). Il a même une action bronchodilatatrice (18). Cependant, il est intéressant de noter que l’augmentation de la PaCO2 joue un rôle important dans l’anesthésie au long cours, notamment des effets bénéfiques sur l’hémodynamique. III. A. 3 - l’isoflurane L’isoflurane présente les mêmes caractéristiques pharmacocinétiques que l’halothane avec, en plus, des bio transformations très limitées (0,2% alors que pour l’halothane cela peut aller jusqu’à 20% (18)). Sa concentration alvéolaire s’établit plus rapidement : en 7 à 8 minutes, elle est égale à la moitié de la concentration inspirée alors qu’il faut 30 minutes pour l’halothane. Son action est plus prompt et son élimination pulmonaire plus brève. L’induction et le réveil sont ainsi plus rapides (18, 77). Les caractéristiques de l’anesthésie sont comparables à celles obtenues avec l’halothane (analgésie et myorésolution satisfaisantes). L’isoflurane est l’halogéné le moins dépresseur du débit cardiaque (105). Certes, on note une baisse de tension sensiblement similaire à celle avec l’halothane (18, 84) mais une dépression du myocarde moindre (18, 84, 105, 114). De plus, l’augmentation de la FC (20% à 1 CAM, 30% à 2 CAM) permet de maintenir un débit constant (84). Autre point positif, il est le moins arythmogène des anesthésiques volatils (18, 77, 105) et ne sensibilise pas le cœur aux arythmies induites par les catécholamines (77). La dose arythmogène d’épinéphrine, chez le chien anesthésié à l’isoflurane, est d’environ 9,8 µg/kg/min (84). L’effet dépresseur respiratoire est l’un des plus puissants parmi les halogénés, avec une chute de la PaO2 et hausse de la PaCO2 voire acidose et hypercapnie (18, 84). Ses effets cardiaques moindres ainsi que sa pharmacocinétique en font un agent séduisant pour une anesthésie de longue durée chez l’animal atteint d’IMC. Seule ombre au tableau, un prix de revient 3 fois supérieur à celui de l’halothane. III. A. 4 - l’enflurane Il présente plusieurs aspects qui en font un anesthésique volatil dangereux. 87 Il est, notamment, le plus dépresseur du débit cardiaque (105) ainsi que de la pression artérielle ( chute de pression moyenne de 17% à 1 CAM, 56 % à 2 CAM et de la pression systolique de 26% à 1 CAM et 56% à 2 CAM ) (84). La baisse de l’index d’éjection (de 31% à 1 CAM et de 52% à 2 CAM) souligne son effet dépresseur sur la contractilité myocardique. On note, aussi, une hausse de la FC (10 à 15%) mais elle n’est pas significative (84). Un des seuls points positifs est son pouvoir arythmogène moindre que l’halothane. L’enflurane est aussi l’halogéné le plus dépresseur de la fonction respiratoire, avec une PaCO2 qui s’accroit d’environ 30% pour 1 CAM et chute de la FR de 40% pour 1 CAM et de 70% pour 2 CAM (84, 105). III. A. 5 - le méthoxyflurane C’est un halogéné peu volatil donc la concentration anesthésique est longue à obtenir, de plus la forte solubilité dans le sang rallonge d’autant plus le temps d’induction et la durée du réveil (18, 77, 105). La surveillance anesthésique est plus délicate et sa toxicité supérieure (libération d’ions fluorures) . Il a, cependant, été préféré dans certains cas, notamment des chirurgies osseuses car il permet d’obtenir une excellente myorelaxation et analgésie (18, 77). Ses effets cardiovasculaires sont une action inotrope négative dose dépendante avec diminution de la contractilité cardiaque et du débit, une hypotension légère à modérée et un effet sensibilisateur du myocarde aux catécholamines moindre que l’halothane (83). Le méthoxyflurane est l’agent volatil le moins dépresseur respiratoire (index anesthésique = 3,4) mais les apnées produites sont très gênantes car, le méthoxyflurane étant très soluble dans le sang, leur réversibilité est plus délicate (18). Le contrôle de l’anesthésie difficile, le réveil lent font de celui ci, un agent à éviter pour le malade cardiaque (77). III. A. 6 - le desflurane et le sévoflurane Ces 2 molécules sont récentes et leur étude encore en cours. Leur faible solubilité (respectivement, coefficient de liposolubilité 0,6-0,7 et 0,42 pour le sévoflurane et le desflurane ) permet une durée d’induction très brève du fait de la rapide installation d’une concentration alvéolaire anesthésique et ceci bien que le desflurane soit le moins puissant des halogénés, avec une CAM de 7,2% (18). Ils ont, tous deux, des effets cardiovasculaires proche de l’isoflurane. Le sévoflurane a, cependant, des qualités qui le rendent plus intéressant, notamment une dépression myocardique moindre et une hausse de la FC moins prononcée. Le desflurane permet une meilleure stabilité de la FC mais induit une baisse modérée de la pression sanguine et de la contractilité (18). Tous deux ne sensibilisent pas le cœur à l’action arythmogène des catécholamines (18). Sévoflurane et desflurane se révèlent être des agents prometteurs dans leur utilisation chez le malade cardiaque, avec un petit plus pour le sévoflurane plus puissant (CAM de 2,4%) et à innocuité plus importante. III. B - LE PROTOXYDE D’AZOTE (N2O) Le N2O est le seul anesthésique gazeux proprement dit. Il a été introduit en clinique il y a plus de 150 ans. Son utlisation très large résulte de nombreuses propriétés intéressantes (18): 88 - une faible solubilité permettant des concentrations alvéolaires élevées en un temps bref - une bonne analgésie induite - des effets cardiovasculaires minimes - une toxicité très faible Malgré cela, il n’est pas un très bon anesthésique car sa CAM est trop élevée (environ 200%) (105) et la sédation qu’il engendre est trop faible (77). Les effets cardio-vasculaires sont minimes par rapport aux anesthésiques volatils. On note une action dépressive sur le myocarde mais aussi une stimulation du système sympathique qui induit, indirectement une action excitatrice sur la fonction cardiaque (18). Cette stimulation peut accroître, en outre, l’incidence des arythmies (18) voire engendrer une ischémie du myocarde. Selon MUIR, FC, débit et pression artérielle sont relativement constantes en plus de ne pas sensibiliser le myocarde aux catécholamines (83). L’utilité de cet agent ne réside pas dans son potentiel anesthésique mais plutôt dans sa fonction de vecteur, avec l’oxygène, de l’anesthésique volatil. En effet, un mélange de 75% de N2O (concentration maximum car ensuite risque d’hypoxie) et de 25 % d’oxygène, comme vecteur, permettrait de diminuer la CAM d’halothane de près de 55% chez l’animal (seulement de 20 à 30% chez l’homme) (105). C’est ce que l’on nomme l’effet second gaz. La forte concentration de N2O dans le mélange induit une hausse du volume inspiratoire, en premier lieu, puis on note un effet de concentration du second gaz dans un plus petit volume ( une grande partie étant occupée par le N2O ) ainsi le gradient de pression augmente et le transfert dans le sang aussi (18). Cet effet permet de réduire les quantités d’anesthésiques inhalées donc l’incidence des problèmes cardiovasculaires. Il faut, cependant, savoir qu’à la fin de l’anesthésie, lors de coupure brutale du circuit, le N2O tend à s’accumuler rapidement dans les poumons afin d’être évacué (ceci du à sa faible solubilité dans le sang ). Ceci pourra induire une chute importante de la PO2 alvéolaire donc une hypoxie transitoire. Tableau XIII : protocoles anesthésiques de patients malades cardiaques en fonction des risques relatifs Protocole 1 Protocole 2 Protocole 3 Risque relatif 25-50 Risque relatif 51-75 Risque relatif 76-100 Prémédication 1. morphine 0.1 mg/kg IM oxygène au moins 75% oxygène au moins 75% 2. acépromazine 0.1 mg/kg IM 1. diazépam 0.3 mg/kg IV 1.diazépam 0.4 mg/kg IV butorphanol 0.2 mg/kg IM oxymorphone 0.1 mg/kg IV oxymorphone 0.1 mg/kgIV 2.fentanyl 0.02mg/kg IV Induction 1. thiopental 6 mg/kg IV 1. kétamine 10 mg/kg IV 1. étomidate 0.5 mg/kg IV diazépam 0.5 mg/kg IV jusqu’à effet 2. propofol 6 mg/kg IV 2. étomidate 1.0 mg/kg IV 2. kétamine 2 mg/kg IV jusqu’à effet 3. kétamine 10 mg/kg IV diazépam 0.5 mg /kg IV Maintenance Oxygène 40%-60% Oxygène 60% Oxygène 100% N20 40%-60% N20 40% 1. isoflurane 0.5%-1% 1. isoflurane 1%-3% 1. isoflurane 1%-2% 89 2. sévoflurane 3. halothane 2%-4% 1%-2% 2. sévoflurane 3. halothane 1%-3% 1% 2. sévoflurane fentanyl midazolam 1%-2% 0.01 mg/kg / 10-15 min, puis perfusion 1-5µg/kg/h 10 µg/kg/min D’après MUIR WW (77) 90 C’est pourquoi, il est conseillé de laisser l’animal sous 100% d’O2 pendant 5 minutes après l’arrêt du N2O (77, 83). Un autre effet de ce gaz est qu’il a tendance à s’accumuler dans les espaces gazeux clos ( du à un échange entre N2O et N2 de l’air ). Ainsi, il est contre-indiqué de l’utiliser dans des cas comme une dilatation / torsion d’estomac ou pneumothorax. IV - FACTEURS INFLUENCANT LES EFFETS CIRCULATOIRES Durant l’anesthésie, les valeurs hémodynamiques sont ainsi modifiées par l’emploi de différentes substances. En effet, un protocole anesthésique requiert l’utilisation de tranquillisants, agents d’induction et ou de maintien de la narcose. Ces produits vont coupler leur action ou, au contraire, atténuer leurs effets délétères. Les agents tels que l’acépromazine, les α2 agonistes ou les thiobarbituriques sont fréquemment utilisés. Ils combinent leurs effets à ceux de l’agent volatil et ainsi peuvent accentuer l’action dépressive (71, 105). Il existe, en outre, des facteurs extrinsèques qui jouent un rôle dans la variation des paramètres hémodynamiques. Notamment, le mode de ventilation et la PaCO2. Lors de ventilation assistée ( à pression positive intermittente ) la fonction cardiovasculaire est déprimée soit par une action mécanique ( retour du sang veineux diminué par augmentation de la pression intrathoracique ) soit par effet du CO2 sur le cœur (71, 105): l’augmentation de la PaCO2 est directement dépressive de la fonction cardiaque, induit un relâchement des fibres musculaires lisses vasculaires et est indirectement responsable d’un effet stimulateur via le système sympathique (71, 105). Ce dernier, chez un animal sain, prend le pas sur l’effet dépresseur ainsi le débit et la pression artérielle augmente . La stimulation douloureuse induit aussi un effet sympathomimétique avec pour résultat une hausse de la pression sanguine artérielle et de la FC. La réponse est liée à la profondeur de l’anesthésie (71, 105). Pour la bloquer, il suffit d’augmenter la dose : 1,5 à 2 CAM pour les anesthésiques volatils (105). La durée de l’anesthésie intervient aussi. Il a été démontré ,chez l’homme, que certains effets cardiovasculaires se modifiaient au cours de chirurgie de longue durée ( 5 à 6h ) avec augmentation de la pression et du débit (105). De pareils résultats ont été noté chez l’animal avec l’halothane et l’isoflurane. Le mécanisme est encore incertain mais des études in vitro montreraient que la dépression du myocarde ne varierait pas avec le temps laissant ainsi pour responsable un effet extrinsèque sympathomimétique 91 Le choix des substances reste à la volonté du praticien. Malgré tout, il est évident que certaines d’entre elles sont à éviter même chez l’insuffisant mitral compensé comme les α2 agonistes. Le protocole anesthésique est établi en corrélation avec la gravité de l’atteinte cardiaque et des répercussions générales. Dans les premiers stades de l’atteinte, des agents comme la kétamine ou les thiobarbituriques peuvent encore être utilisés. Mais plus l’atteinte sera importante et plus le choix devra se reporter sur des substances à relativement large innocuité comme l’étomidate ou, dans les anesthésiques volatils, l’isoflurane ou le sévoflurane. MUIR présente des protocoles à employer selon les niveaux d’atteinte cardiaque et considère les patients de stade I et II comme des patients sains mais préconise, chez les patients à risque élevé (stade III et IV), l’emploi de diazépam, morphiniques comme tranquillisants, d’étomidate en induction et d’isoflurane ou de sévoflurane comme anesthésiques volatils (tableau XIII) (2). Cependant, même en appliquant un protocole où les risques sont minimes, il est toujours possible de devoir faire face à un accident anesthésique. C’est pourquoi il est nécessaire, voire indispensable, de pouvoir à tout moment contrôler les paramètres cardiorespiratoires. La surveillance de l’anesthésie d’un animal malade cardiaque requiert un monitorage plus complexe que celui nécessaire pour un animal en bonne santé, réclamant certaines compétences et connaissances quant au matériel, à sa mise en place et à l’interprétation des mesures. 92 93 LE MONITORAGE DE L’ANESTHESIE ET LES MESURES D’URGENCE 94 95 Les accidents anesthésiques sont malheureusement d’installation rapide et de nature dévastatrice. Le monitorage permet d’informer le praticien sur l’état du système cardiorespiratoire à tout moment et donc de minimiser les dégâts lors d’incidents en autorisant une intervention rapide. Bien que les effets pharmacodynamiques des anesthésiques varient, les mécanismes par lesquels les accidents interviennent sont globalement les mêmes : hypotension sévère, arythmie, dépression du myocarde, vasodilataton, vasoconstriction, hypoventilation, hypoxémie. Le monitorage consiste en l’évaluation et la surveillance des paramétres des fonctions respiratoire et cardiaque. Plus l'insuffisance mitrale sera grave, et par là même plus instable sera la fonction cardiaque, plus le nombre de paramètres à controler sera élevé et plus les mesures devront être précises nécessitant un appareillage adéquat. I - LE MONITORAGE RESPIRATOIRE DE L’IMC La ventilation est altérée par la majorité des agents anesthésiques. Dans certains cas, il est même nécessaire d’assister la ventilation manuellement ou à l’aide d’un respirateur artificiel .L’objectif du monitorage respiratoire est de s’assurer de l’intégrité des fonctions que sont l’évacuation du CO2 (ventilation) et de l’oxygénation du sang (échanges gazeux alvéolaires). I. A - MONITORAGE RESPIRATOIRE CHEZ L’IMC DE STADE I ET II I. A. 1 - Fréquence respiratoire et auscultation Les paramètres respiratoires tels que la fréquence et l’amplitude des mouvements peuvent être facilement appréciés par l’observation de la cage thoracique, du ballon du circuit anesthésique et, lors de ventilation assistée ( respiration à pression positive intermittente ), en vérifiant les mouvements de l’aiguille de la jauge de pression. L’auscultation permet la détection de bruits respiratoires anormaux (développement d’un œdème pulmonaire). Le stéthoscope traditionnel reste de la plus grande utilité lorsque le site chirurgical le permet. Le recours au stéthoscope œsophagien permet de surveiller l’activité respiratoire et les battements cardiaques sans gêner le bon déroulement de la chirurgie. Celui-ci est composé d’un ballonnet déformable relié à l’oreille de l’anesthésiste par un conduit souple mais relativement peu déformable. Sa mise en place s’effectue après l’intubation endotrachéale, le stéthoscope lubrifié est introduit dorsalement à la sonde, dans l’œsophage. On recherche ensuite la meilleure position d’écoute. Il s’agit d’un moyen technique simple, utile et très bon marché qui devrait être utilisé pour toute anesthésie, lorsque l’auscultation classique n’est pas permise. Les sons recueillis peuvent être amplifiés et diffusés par un haut parleur (19). L’intégrité de la fonction respiratoire est alors appréciée par l’intensité, la qualité et la durée des mouvements respiratoires mais aussi par l’appréciation des sons plus ou moins audibles réguliers et distincts (77). Un des premiers signes révélant une ventilation inefficace, est une respiration superficielle (90). Ceci se rencontre le plus souvent une fois la chirurgie terminée, lorsque les anesthésiques font encore effet et que le monitorage ou l’aide respiratoire ont été arrêtés. 96 La fréquence respiratoire doit être au moins supérieure à 10 mouvements par minute (90, 36). Cependant, seule, elle ne donne pas assez d’informations pour pouvoir juger de l’efficacité de la ventilation ni de l’adéquate oxygénation du sang. Tableau XIV : Origines des variations du capnogramme Obstruction des voies respiratoires Déconnection du circuit Insuffisance ventilatoire Obstruction du tube du capnographe Malfonction Fuite du circuit respiratoire Chute brutale à zéro Chute brutale du plateau à des valeurs basses Chute exponentielle du plateau Trouble cardiovasculaire sévère Hyperventilation soudaine Hyperventilation Hypothermie Vasoconstriction Expiration non complète avant l’inspiration ( obstruction partielle, bronchospasme, FR élevée ) Flux des gaz lent Contamination des gaz frais Capnographe mal calibré Espace mort anatomique important Hypoventilation Métabolisme de base accru Cellule d’échantillonage contaminée Re-aspiration Ventilation de l’espace mort Chute lente du plateau Valeurs basses sans plateau bien défini Mesures basses avec plateau bien défini Valeur du plateau accrue Ligne de base surélevée Plateau et ligne de base surélevée P(a-A)CO2 augmentée D’après HASKINS SC (36) CONCENTRATION EN CO2 DANS L’AIR EXPIRE Figure 19: Allure générale du capnogramme et de ses différentes phases 3- Plateau expiratoire 2 - Elévation expiratoire 1- Ligne de base inspiratoire 4- chute inspiratoire 97 CYCLE RESPIRATOIRE D’après HASKINS SC (36) I. A. 2 - Le monitorage de la ventilation par un respiromètre S’assurer de l’efficacité de la ventilation, c’est vérifié l’évacuation du CO2 du sang vers le poumon. Dans les stades débutant d’endocardiose mitrale, on peut simplement vérifier le volume courant ou le volume minute (le premier étant le volume en ml de gaz expiré à chaque ventilation et le second est obtenu en multipliant le volume courant par la fréquence respiratoire) . Dans un second temps, l’emploi d’un capnographe permet d’évaluer la bonne élimination du CO2 et la PCO2 sanguine. Le volume courant peut être mesuré à l’aide d’un spiromètre de WRIGHT. Il donne des mesures précises lors de respiration spontanée, placée alors en série sur les voies respiratoires. Il peut aussi apprécier le débit d’un respirateur mais alors les mesures sont moins précises car elles dépendent du flux des gaz frais, du rapport inspiration / expiration et des paramètres mécaniques de la respiration (compliance pulmonaire dynamique ou statique) (45). Le volume courant correspond au volume gazeux mobilisé lors d’une inspiration ou d’une expiration normale (36, 45, 90). Il se situe entre 10 – 20 ml /kg (19, 36, 45, 90), il faut compter en plus 2 à 4 ml / kg lors de ventilation assistée pour compenser la compliance de l’appareil et du circuit de ventilation (45). La ventilation minute est obtenue en multipliant le volume courant par la FR soit au moins 150-300 ml / kg / min (19, 36, 45). Un volume courant faible peut être alors compensé par une fréquence respiratoire élevée. Cependant, la partie du volume courant qui reste dans les voies respiratoires (larynx, trachée, bronches … ) ne participe pas aux échanges gazeux dans les alvéoles. Ce volume constitue un espace mort anatomique correspondant à 25 à 33% du volume courant (45). Ainsi la partie la plus importante est la ventilation alvéolaire car la seule participant aux échanges. Une ventilation alvéolaire de 100-200 ml / kg / min est habituellement suffisante pour maintenir une PaCO2 et une PaO2 dans des limites acceptables (19). Du fait de la grande variation possible du rapport espace mort / ventilation alvéolaire, une ventilation minute normale n’assure pas l’efficacité de la ventilation. Pour une meilleure estimation de l’efficacité de l’évacuation du CO2, nécessaire dans le monitorage des stades évoluées de l’IMC, il faut pouvoir mesurer la ventilation alvéolaire. La meilleure méthode est encore de contrôler la pression partielle de CO2 dans le sang artériel (PaCO2). I. B - MONITORAGE RESPIRATOIRE CHEZ L’IMC DE STADE III I. B. 1 - Evaluation de la PaCO2 par un capnographe Cette méthode non invasive se base sur la bonne diffusion du CO2 du sang vers les alvéoles. Ainsi la PaCO2 est peu différente de la PACO2 (pression partielle de CO2 dans l’air alvéolaire) (36, 90). En effet la PaCO2 est supérieure de 2 à 5 mmHg car l’air alvéolaire est dilué par les gaz contenus dans les espaces morts (45). 98 Tableau XV : origines de l’hypercapnie Hypoventilation A – troubles neuro-musculaires Profondeur excessive de l’anesthésie Atteintes du SNC Atteinte cervicale Trouble de la jonction neuro-musculaire B – obstruction des voies aériennes : bronchoconstriction C – atteinte restrictive du thorax ou de l’abdomen D – compression pulmonaire Hémothorax Pneumothorax E – maladie du parenchyme pulmonaire ( stade terminal ) F – malfonction du système ventilatoire Ré-aspiration des gaz des espaces morts anatomiques Hyperthermie, augmentation de la production de CO2 Injection récente de HCO3- D’après HASKINS SC (36) 99 Le capnographe mesure la pression de CO2 dans l’air exhalé, il permet d’estimer à tout moment l’efficacité de la ventilation. Il se branche en série ou en dérivation sur le circuit respiratoire recevant alors tout le flux gazeux ou seulement une partie de celui ci. La mesure est continue et faite de façon non invasive. Dans tous les cas, la connection doit se faire le plus proche de l’animal possible afin de minimiser les espaces morts (45, 90). Le capnogramme est la variation de la PACO2 en fonction du cycle respiratoire (fig 19). Le tracé est caractéristique avec une ligne basale inspiratoire où PACO = 0 mmHg puis une brusque montée correspondant au début de l’expiration, un plateau (PACO2 = PaCO2) puis une chute, elle aussi brutale, suite au début de l’inspiration. L’étude de cette courbe est riche d’enseignement et toute aussi importante que la valeur de la PaCO2 (tableau XIV) (36). Le plateau doit se situer entre 35 et 45 mmHg - si la PCO2 est inférieure à 35 mmHg, le patient est en hyperventilation : la chute de PACO2 (sans différence entre PACO2 et PaCO2) est due à une augmentation de l’élimination du CO2. L’hypocapnie doit être évitée car peut engendrer une diminution du débit cardiaque et de la perfusion tissulaire par une augmentation du pH (avec diminution du Calcium ionisé), une action inotrope négative et un décalage de la courbe de saturation de l’hémoglobine vers la gauche et non relargage de l’02 dans les tissus. L’hypocapnie peut aussi être à l’origine d’une diminution du tonus sympathique, du flux sanguin cérébral (45) et d’une apnée voire d’un effondrement du débit cardiaque (29). - si la PCO2 est supérieure à 45 mmHg, le patient est en hypercapnie (tableau XV). Celle ci est fréquemment rencontrée en anesthésiologie du fait de l’effet dépresseur respiratoire de la majorité des agents. L’augmentation de la PaCO2 va stimuler le système sympathique et diminuer la pression sanguine mais aussi atténuer les forces contractiles du myocarde voire engendrer des arythmies. Elle peut, si elle perdure, être associée à une acidose respiratoire importante ainsi qu’à une hypoxémie (en effet, lorsque la PaCO2 augmente de 1 mmHg, la PaO2 diminue de 1,2 mmHg) (90). Si l’hypoventilation devient sévère (> 55 mmHg) et que la cause n’est pas de suite identifiable et corrigible, la ventilation assistée est indiquée (90). La PaCO2 doit être périodiquement mesurée afin de calibrer le capnomètre et de pouvoir interpréter les résultats de la PACO2. Une augmentation de la différence entre PACO2 et PaCO2 peut être due à un changement dans les espaces morts pouvant impliquer un problème de perfusion pulmonaire suite à une diminution du débit ou de la pression artérielle pulmonaire, une embolie pulmonaire, une thrombose ou une pression positive en fin d’expiration (45). L’examen de la différence entre PaCO2 et PACO2 permet aussi d’apprécier la qualité de la ventilation. Une inspiration brève est rapide se distribue dans les territoires non compliants et mal perfusés alors qu’une inspiration lente permet une distribution dans les territoires compliants et mieux vascularisés. En conclusion, l’utilisation d’un capnographe permet au praticien d’obtenir un certain nombre de renseignements quant à l'efficacité de la ventilation et de vérifier l’effet des procédures mises en place lors d’hyper ou d’hypoventilation. Des informations supplémentaires, quant à l’intégrité du circuit mais aussi sur le statut du patient comme une baisse de débit ou un déséquilibre entre perfusion et ventilation, peuvent être obtenues. 100 I. B. 2 - Monitorage de l’oxygénation du sang par un oxymètre Le niveau d’oxygénation d’un patient est apprécié en terme de contenu sanguin en O2 : Ca02 Ce dernier dépend de 3 facteurs : le taux d’hémoglobine (Hb), la saturation de l’Hb et la Pa02. a - Taux d’hémoglobine Grossièrement, l’état d’oxygénation du sang ou Ca02 peut être apprécié par la couleur des muqueuses (gingivale, linguale, vulvaire). Cependant, il est nécessaire d’avoir une concentration en Hb d’au moins 5 g / dl pour observer une cyanose (76), sinon, il n’y a pas de décoloration mais ce que l’on nomme hypoxie anémique. Une concentration élevée en Hb > 17 g / dl ou un volume cellulaire > 50 % accroit la viscosité du sang, le rendant ainsi difficile à éjecter dans les capillaires périphériques (90). C’est pourquoi il est préférable d’avoir un taux d’Hb >7 g/dl afin d’éviter l’hypoxie mais < 15 g / dl pour éviter l’hyperviscosité (76). b - Sa02 et Pa02 L’02 dissous dans le plasma soit Pa02 représente moins de 2% du contenu sanguin en 02. La Ca02 est alors principalement déterminée par le taux d’Hb et le pourcentage de saturation de celle ci en 02 (36, 45, 76, 90). Le taux de saturation en 02 peut être déterminé indirectement par la mesure de la Pa02 et extrapolé à partir de la courbe de saturation de l’Hb, la plupart des analyseurs sanguins font ce calcul. Une autre méthode consiste à évaluer la Sa02 par l’emploi d’un oxymètre à infra rouge basé sur les pulsations. c - l’oxymétre à IR L’oxymétrie consiste en la mesure de la saturation en 02 de l’Hb. Cela peut se faire de façon directe sur un prélévement de sang artériel mais elle a l’avantage de pouvoir, actuellement, se faire de façon non invasive grâce au double principe de la spectrophotométrie et de la pléthysmographie analysant la différence d’absorption de deux longueurs d’onde (rouge et infra-rouge) entre deux pulsations ( 36, 45, 66, 76, 90). Les renseignements apportés par cette technique sont une estimation de la Sa02 continue ainsi qu’un signal sonore de la fréquence pulsatile. Selon LEMAIRE (66), la valeur absolue de Sa02 obtenue par oxymétrie est toujours inférieure à celle calculée à partir de la Pa02 mais cette technique reste très intéressante dans la détection d’accidents hypoxiques (36, 66). La Sa02 idéale durant l’anesthésie est de 96-100%. Si elle a tendance à diminuer, il faut enrichir le mélange en 02, ventiler le patient et remettre la sonde en place. Un autre intérêt de l’oxymétrie est son utilisation au cours du réveil de l’animal qui commence à respirer l’air ambiant ( concentration en 02 moindre ) et dont le volume courant peut être diminué du fait de la douleur à mobiliser les muscles respiratoires (45). I. C - MONITORAGE RESPIRATOIRE CHEZ L’IMC DE STADE IV Il requiert l’emploi des techniques les plus précises de mesure de la PaO2 et de la PaCO2 ainsi qu’une évaluation du statut acido-basique ce dernier étant un bon indice de 101 la fonction respiratoire, mais également car des perturbations du pH sanguin peuvent induire de graves troubles de la dynamique cardiaque. I. C. 1 - Mesure des PaO2 et PaCO2 par analyseur sanguin Ce dernier permet d’obtenir une mesure directe et très précise de la Pa02 et de la PaCO2 mais présente comme inconvénients de ne pas permettre des mesures en continu, d'être invasif et coûteux. La Pa02 est considérée rester entre 80 et 110 mmHg, si elle se situe entre 50 et 60 mmHg, il convient d’enrichir le mélange en 02 et d’assister la respiration. L’hypoxémie est définie par une Pa02 inférieure à 80 mmHg, elle peut être due à une fraction d’02 inspirée faible, à une hypoventilation lorsque l’animal respire l’air ambiant ou à une pathologie pulmonaire (effet shunt) . L’intérêt de l’analyseur est de pouvoir mesurer à la fois la Pa02 et la PaC02. Ces 2 paramètres interviennent dans un calcul permettant de vérifier l’efficacité des échanges gazeux et d’identifier un problème du à un mélange de sang veineux (sang passant du côté droit au gauche sans être oxygéné). Il est basé sur la différence entre la pression alvéolaire en 02 et celle artérielle. Dans des conditions normales, les échanges gazeux entre l’alvéole et les capillaires sont très efficaces et PA02= Pa02. Cependant, chez certains patients dont cette fonction est compromise, on peut rencontrer une hypoxémie du fait d’une inégalité entre PA02 et Pa02 (36, 90). - Pour un animal respirant l’air ambiant La différence PA02 – Pa02 doit être inférieure à 10 mmHg (36, 90). Si elle est supérieure à 30 mmHg, cela signifie qu’il y a une détérioration des échanges : Perturbation ventilation / perfusion, effet shunt du à un collapsus alvéolaire, atélectasie par pneumothorax, effusion pleurale (90). - Pour un animal respirant un air enrichi en 02 (100% 02 par exemple) Si PA02 – Pa02 est supérieure à 100 mmHg, cela indique le même genre de problème que précédemment. Dans de tels cas, l’oxygénothérapie est mise en place afin de conserver une Pa02 > 65 mmHg (masque, cage ou intubation). La supplémentation à long terme ne doit pas excéder une FI02 (fraction inspirée en O2) de 0,4 – 0,5 afin d’éviter une toxicité de l’02 pur. Cette thérapeutique est globalement efficace dans les déséquilibres ventilation / perfusion. Par contre, dans le cas de collapsus alvéolaire, il est nécessaire de mettre en place des pressions positives en fin d’expiration qui vont améliorer la compliance pulmonaire (PEEP = 5 – 15 cm H20, si la pression exercée est trop importante, elle peut compromettre le retour veineux et le débit cardiaque) (90). Le dosage de la Pv02 (pression partielle en 02 du sang veineux) peut être une source de renseignement supplémentaire. L’échantillon est prélevé à la veine jugulaire, dans la veine cave ou dans l’artère pulmonaire (nécessité de pose d’un cathéter de SWANGANZ) (36). La Pv02 est de l’ordre de 40-50 mmHg, une Pv02 inférieure à 30 mmHg laisse supposer une diminution de la perfusion tissulaire (hypoxémie, faible débit, vasoconstriction), une Pv02 supérieure à 60 mmHg pour un animal respirant l’air ambiant suggère une utilisation faible de l’02 par les tissus (shunt, choc septique, toxique métabolique) (36). 102 I. C. 2 - Le statut acido-basique Celui ci est considéré comme faisant parti du monitorage de la fonction respiratoire car cette dernière intervient en grande partie que ce soit comme source de déséquilibre ou dans les mécanismes compensateurs. a - Matériel Déterminer le statut acido-basique d’un patient nécessite de connaître : - le pH sanguin - la PaC02 - la concentration en bicarbonates (HC03-) - l’excès de base L’analyseur des gaz sanguins permet d’obtenir ces paramètres. Cependant son coût, somme toute élevé, le réserve à de grandes cliniques ou des centres universitaires. Il existe, malgré tout, des tests rapides, bon marché et réalisables en clinique qui permettent d’estimer le C02 plasmatique, composé à 95% de HC03-, du C02 dissous dans le plasma et de l’acide carbonique H2C03. Cette mesure, alliée à la connaissance de la physiopathologie des déséquilibres acido-basiques, permet, en général, de mettre en place une thérapeutique appropriée et d’améliorer l’état du patient (89). La méthode de référence reste cependant l’analyseur sanguin, les données recueillies avec les autres méthodes doivent être interprétées avec précaution (51). b - Techniques de prélèvement d’un échantillon de sang artériel Le recueil de l’échantillon requiert une technique exemplaire pour obtenir des résultats précis. Il doit, notamment, être collecté de façon anaérobie afin de ne pas le contaminer par l’air ambiant (enrichissement en 02 car la P02 de l’air ambiant est égale à 156 mmHg ce qui est supérieur à celle du prélèvement et appauvrissement en C02 pour la raison inverse (43, 51, 89)) et constituer un volume suffisant afin de prévenir les modifications de pH dues aux anticoagulants (tube d’échantillon ou seringue remplie au maximum). Les sites standards de prélèvement chez les animaux de compagnie incluent l’artère fémorale, métatarsienne dorsale ou linguale (51, 83, 89, 99). Il n’est pas évident de recueillir une quantité suffisante chez les petites races, d’où l’intérêt de developper une technique permettant les micro-échantillons (99). La technique standard consiste en la ponction de l’artère fémorale à l’aide d’une aiguille 25 G héparinée par une solution saline à 1000 UI / ml, l’échantillon est collecté dans une seringue héparinée (éviter l’héparine ammonium ou EDTA qui peuvent éluder les mesures de pH). Les bulles d’air sont éliminées rapidement, l’échantillon scellé et placé dans un bain de glace afin de diminuer l’activité cellulaire à l’origine d’une production de C02 (43, 89). L’analyse doit être faite dans la demi heure qui suit. La technique de micro-échantillon développée par QUANDT (99) consiste en la section d’une griffe jusqu’à obtention d’un saignement. Les 2 ou 3 premières gouttes sont ignorées afin de réduire la contamination veineuse. L’échantillon est recueilli dans un tube de Natelson hépariné (250 µl) puis scellé et placé dans la glace. Il est recommandé de collecter l’échantillon en moins de 10 secondes et d’éviter les contacts avec l’air ambiant. 103 Les résultats de cette étude ont révélé une bonne corrélation des valeurs de PC02, HC03- et du pH par rapport à la technique standard ( la corrélation est meilleure pour des valeurs de pression systolique supérieures à 80 mmHg ). La Pa02 est assez différente, on suppose que le contact avec l’air ambiant en est la cause (99). Une autre possibilité est suggérée par ABOU-MADI et ROBERTSON : le prélèvement de sang veineux au niveau de la langue, du fait, notamment, de la difficulté de prélèvement de sang artériel. Les résultats ont révélé une bonne corrélation des différents paramètres même en ce qui concerne la Pa02 ( r = 0,92-0,97 ), la raison en serait les anastomoses artério-veineuses localisées sous l’épithélium lingual ( les précautions, lors du prélèvement sont les mêmes que précédemment) (1). Hormis la mise en place d’un cathéter artériel, les prélèvements sont réalisés toutes les 20 minutes afin de donner un bon suivi de l’état du patient au cours de la chirurgie. c - Statut acido-basique et données de l’analyseur Ainsi les paramètres majeurs, permettant d’estimer l’état acido-basique du patient, sont le pH sanguin, la PaC02 et la [HC03-]. Leurs normes respectives sont pour le pH : 7,35 – 7,45 PaC02 : 35 - 45 mmHg HC03- : 22 – 27 mEq / L la PaC02 renseigne à la fois sur l’état acidobasique et respiratoire du patient. Une PaC02 > 45 mmHg indique une mauvaise ventilation pulmonaire rarement une production accrue de C02 (sauf en cas de choc ou d’hyperthermie), avec risque d’acidose. Une PaC02 < 35 mmHg suggère une hyperventilation avec risque d’alcalose respiratoire (79). Ces 3 paramètres sont liés entre eux et une variation de l’un d’eux se répercutent sur les autres (83). Toute variation brutale de 10 mmHg de la PaC02 supérieure ou inférieure à 40mmHg induit respectivement une augmentation ou diminution de 1 à 2 mEq / L de la [HC03-] ainsi qu’une diminution de 0,05 et augmentation de 0,1 unité pH. Pour évaluer l’état acido-basique, il est aussi utile de calculer l’excès ou le déficit en base. Ce paramètre correspond à la différence du pouvoir tampon d’un individu et de sa référence (statut acido-basique normal). Cette référence n’est pas unique car dépend de l’hématocrite de l’individu (l’Hb jouant un grand rôle de tampon chimique). De plus le pouvoir tampon du patient est la somme de toutes les bases conjuguées des substances tampons du sang, ce qui est difficilement obtenu (79, 89). L’excès en base peut alors avoir des valeurs positives ou négatives, une valeur négative indiquant une diminution du pouvoir tampon ( soit par un gain en acide ou une perte en base ) et une valeur positive, une augmentation du pouvoir tampon ( soit par un gain en base ou une perte en acide ). La valeur absolue nous renseigne sur la sévérité de l’atteinte mais pas son origine. d - troubles acido-basiques et interprétation des données ( tableau XVI ) La valeur moyenne du pH sanguin dans les espèces domestiques se situe à environ 7,4. Une valeur inférieure indique une acidémie, une supérieure, une alcalémie. Une distinction doit être faite entre acidémie et acidose d’une part et entre alcalémie et alcalose d’autre part. L’acidose et l’alcalose sont des processus physiologiques 104 anormaux dans lesquels on constate, respectivement, un gain en acide fort ou une perte d’HC03- et un gain en base forte ou une perte en acide fort. Le pH sanguin résultant du rapport entre la composante métabolique (HC03-) et la composante respiratoire (H2C03), acidose et alcalose peuvent être la conséquence d’un trouble respiratoire ou métabolique.Les troubles primaires sont généralement accompagnés de mécanismes compensateurs de l’autre composante. Le déséquilibre acido-basique le plus fréquemment rencontré dans les anesthésies est l’acidose respiratoire (79, 89). 105 Tableau XVI : constantes sanguines et troubles acido-basiques pH Statut normes 7,35-7,44 Ô Métabolique PCO2 (mmHg ) HCO3(mEq/l ) 36-46 - 23-28 Ô Pouvoir tampon ( mEq/l ) 44-48 Ô Excès de CO2Total base (mEq/l ) ( mEq/l ) 0+/-3 22-26 Ô Ô (- ) acidose Respiratoire Ô Ò Ò - - - Métabolique Ò - Ò Ò Ò Ò Respiratoire Ò Ô Ô - - - alcalose D’après ORSINI JA(89) 106 • troubles d’origine respiratoire ( tableau XVI et XVII ) c l’acidose respiratoire Elle résulte d’une diminution de l’évacuation du C02 due à une baisse de la FR et ou d’une mauvaise ventilation alvéolaire avec pour conséquence une augmentation de la PaC02. Le C02 est un produit normal du catabolisme cellulaire. Du fait de l’équilibre entre C02 et H2C03 en solution aqueuse, la production de C02 est équivalente à l’adjonction d’acide dans le torrent sanguin. Chez l’homme, la production quotidienne de C02 est à peu équivalente à 12,5 mEq d’H+. Si la clearance du C02, dans le poumon, n’égale pas la production par les tissus, l’acide s’accumule (89). La concentration en bicarbonates augmente de 1 à 2 mEq / L pour chaque 10 mmHg supplémentaire de la PaC02 au dessus de 40 mmHg. Le pH diminue de 0,05 unité pour la même augmentation de PaC02. Les tampons chimiques, comme l’hémoglobine, s 107 Tableau XVII : origines des déséquilibres acido-basiques Origines respiratoires acidose Alcalose Origine pulmonaire Influences corticales Anxiété Ô de la perfusion embolie pulmonaire Douleur arrêt cardiaque Fièvre Maladie du SNC Ô ventilation OAP Hypoxie bronchopneumonie Shunts pulmonaires obstruction des voies Maladies pulmonaires aériennes diffuses fibrose interstitielle Hypotension Œdème pulmonaire compression traumatisme Stimulus physiques pneumo- hémothorax distension abdominale Iatrogènes Salycilates pathologie musculaire Hormones hypokaliémie thyroïdiennes myasthénie Progestérone Catécholamines Origine centrale Anesthésie Maladies primaires Septicémie Analgésiques Gestation Traumatisme Coup de chaleur Tumeur Hypernatrémie Origine Ventilation assistée périphérique Trauma médullaire ( hyperventilation ) Paralysie du diaphragme 108 Origines métaboliques acidose alcalose TA normal Perte gastrique Diarrhée Vomissements Vomissement Lésion du pancréas Origines rénales Nutrition parentérale Excès en minéralo – Injection rapide de corticoïdes Compensation de Nacl Acétazolamide l’hypercapnie Acidose tubulaire Hypokaliémie rénale Hypochlorémie Hypoaldostéronisme Diurétiques Hypoparathyroïdisme TA Ò IRA Acidocétose (diabète ) Perfusion de HCO3Acidose lactique Toxique : méthanol, éthylène glycol, salicylates d l’alcalose respiratoire Elle est rarement rencontrée au cours d’une anesthésie et même en pratique vétérinaire (89). Le syndrome résulte d’une augmentation de la ventilation alvéolaire et d’une baisse subséquente de la PaC02. Elle peut se développer lors d’hyperthermie ou dans certaines atteintes du SNC avec hyperventilation et dans l’acidose paradoxal du fluide céphalorachidien. La PaC02 ne pouvant diminuer indéfiniment, l’alcalose respiratoire n’est jamais assez sévère pour réclamer une thérapeutique. Il convient, néammoins, de déterminer la cause et d’y remédier. Les modifications rencontrées sont une baisse des bicarbonates, [HC03-] chute de 1 à 2 mEq / L et le pH augmente de 0,15 unités pour chaque diminution de 10 mmHg de la PaC02 au dessous de 40 mmHg. Le pH artériel est normal à légèrement augmenté. Les causes de cette affection sont l’hypoxie qui va stimuler la ventilation, un débit cardiaque faible, une anémie sévère, une atteinte pulmonaire (pneumonie), une hyperventilation par atteinte du SNC (action médicamenteuse, encéphalite, tumeur, atteinte hépatique, douleur). Les données sanguines révèle un pH normal à légèrement supérieur à 7,45, une diminution de la PaC02 (<35 mmHg) et des HC03Lors d’alcalose sévère, on observe une activité spontanée. En effet l’alcalose est caractérisée par une tétanie et des convulsions, les nerfs périphériques sont atteints avant le SNC. Les muscles se tétanisent ou développent des spasmes toniques. L’effet sur le système cardiovasculaire est une irritabilité accrue (89). • troubles d’origine métabolique ( tableau XVI et XVII ) c l’acidose métabolique Cet état résulte d’une augmentation de la charge en acide, d’une perte en HC03- ou d’une incapacité à excréter les acides Les causes sont nombreuses, la plus probable lors de l’anesthésie d’un malade cardiaque est le choc cardiogènique, hémorragique ou septique. La diminution du débit et de la perfusion tissulaire engendre un métabolisme cellulaire d’anaérobiose avec synthèse d’acide lactique, provenant du pyruvate qui ne peut plus être oxydé en C02 et H20 dans le cycle de KREBS du fait de la moindre disponibilité de l’02 . L’analyse du trou anionique aide à établir l’origine de cette acidose. Ce dernier se calcule à partir des concentrations en Na+, K+, Cl – et HC03- . TA = (Na+ + K+) – (Cl- + HC03-) Comme la [K+] est faible par rapport à celle de Na+, son utilisation dans le calcul est omis en général (89). Ainsi TA= Na+ - (Cl- + HC03-) La norme se situe entre 8 et 16 mEq / L (79, 89). L’acidose métabolique secondaire à un gain en acide ( H+ ) est associée à un trou anionique élevé ( hormis le cas où l’acidose est imputable à une augmentation de HCl, dans ce cas la perte en HC03- est remplacée de façon équimolaire par le Cl- ). L’acidose lactique répond à cette condition. L’acidose métabolique associée à une perte de base ne modifie pas la valeur du trou anionique ( lors de pertes rénale ou gastro-intestinale 109 en NaHC03, le rein échange HC03- contre Cl- afin de rétablir l’équilibre hydroélectrolytique ) . Le profil sanguin de ces patients montre un pH inférieur à 7,35, une [HC03-] plasmatique inférieure à 20 mEq / L et un excès de base inférieur à -5 mEq / L. Si la compensation respiratoire s’est mise en place, la PaC02 est diminuée (83). En cas d’acidose modérée, cette compensation respiratoire peut permettre à elle seule de rester dans les limites inférieures des normes. Les conséquences sur l’état du patient sont celles de l’acidose respiratoire soit une dépression du SNC mais beaucoup plus lente à s’installer. La dépression myocardique est une importante complication, en présence d’une acidose, le seuil de fibrillation ventriculaire diminue bien que le seuil de défibrillation ne soit pas affecté (69, 89). L’approche thérapeutique fondamentale est le traitement de la cause sous jacente. Si celle ci ne peut être rapidement améliorée et contrôlée, la restauration d’un statut acidobasique équilibré peut s’obtenir par l’administration d’agents alcalinisant incluant : lactate, citrate, NaHC03 (leader), trométhamine (l’acidose lactique exclue l’utilisation des lactates) . L’emploi des HC03- est largement répandu, cependant LIPPERT et Coll rappelle quelques effets néfastes des bicarbonates lors de leur utilisation dans le cas de réanimation suite à un arrêt cardiaque : dépression cérébrale du à une acidose du LCR, augmentation de la PaC02, hypotension transitoire et hypertension intracrânienne, hyperosmolalité, hypernatrémie et déplacement vers la gauche de la courbe de dissociation de l’Hb avec diminution de la disponibilité tissulaire de l’02. Les HC03peuvent aussi induire une baisse transitoire de la contractilité myocardique (69). Certains investigateurs préconisent l’emploi de substances tampons organiques ne générant pas de C02, comme la trométhamine, afin de traiter l’acidose métabolique suite à un arrêt cardiaque. Celle ci doit être injectée avec précaution (en IV lente) et peut provoquer une irritation. Les bicarbonates sont préférés aux lactates ou citrates car plus directs et actifs sur le pouvoir tampon (89). De plus, l’acidose lactique exclut l’utilisation de lactates (solution de Ringer-lactate à trop faible pouvoir alcalinisant : 28 mEq / L) (89).LIPPERT et Coll suggérent d’utiliser les bicarbonates, dans le cas d’acidose lactique suite à une chute du débit, une fois la ventilation assistée mise en place, le massage cardiaque, l’épinéphrine, la défibrillation et ou les anti-arythmiques utilisés (tout ceci suivant le degré d’atteinte). Les conséquences de l’acidose peuvent être minimisées si un support ventilatoire et circulatoire suffisant est rapidement installé (69, 89). Le but de la thérapeutique est d’augmenter le pH à un niveau sans danger. Un pH supérieur à 7,2 permet de réduire notablement les risques d’arythmies cardiaques et d’améliorer la contractilité du myocarde ainsi que la réponse aux catécholamines. Par la suite, une série de mesure du pH sanguin artériel, de la [HC03-] et de la PaC02 est nécessaire à la bonne gestion de l’état du patient (89). La quantité de bicarbonates à injecter dépend du volume extracellulaire et de la sévérité du déficit en base (excès de base négatif) HC03- (mEq / L) = EB (mEq / L) x PV x % liquide extracellulaire Dans le corps, le liquide extracellulaire représente environ 25 à 30% (79, 83). Cependant ORSINI, estimant que seulement la moitié des bicarbonates se répartissent dans le milieu extracellulaire, préconise un facteur multiplicateur de 0,6 (89). 110 Lorsque l’on ne peut pas calculer l’excès de base, du fait d’un manque de données ou de matériel, on peut l’estimer en soustrayant la [HC03-] mesurée à 23 (concentration moyenne approximative) : EB = 23 – [HC03-] Une seconde méthode est de retrancher le C02 total à 24,2 mEq / L. Il est recommandé de ne donner, dans un premier temps, uniquement la moitié du déficit en bicarbonates puis le reste plus lentement. Une administration trop rapide de HC03- pouvant avoir de sérieuses conséquences comme vu ultérieurement (89). Lors d’acidose métabolique prolongée, une compensation respiratoire intervient avec hyperpnée afin de compenser la baisse des HC03-. Une correction rapide du déficit en base peut ramener le pH à la normale dans les heures qui suivent. Les stimuli respiratoires sont perdus et la PaC02 revient, elle aussi dans les normes. Cependant, du fait de la mauvaise diffusion des HC03- et de l’équilibre rapide de PC02 au niveau de la barrière hémato-méningée, on risque une acidose du LCR qui peut induire un coma. d l’alcalose métabolique Celle ci se rencontre lors de perte en acide au de gain en base. Ces conditions sont réunies, par exemple ,dans le cas de vomissements profus n’intéressant que le contenu gastrique, de pathologies ou utilisation d’agents induisant une hypokaliémie ( l’alcalose est alors due au fait que le rein échange des ions H+ contre K+ ). L’administration excessive de bicarbonates est aussi une cause et notamment la plus rencontrée lors d’anesthésie (89). Le profil des patients se caractérise par un pH supérieur à 7,45, une [HC03-] augmentée et une PaC02 supérieure à 45 mmHg secondaire à une compensation respiratoire. Ces patients développent, en même temps, une hypochlorémie, hypokaliémie, et pafois une hyponatrémie. Les ions Cl- et H+ sont perdus dans les vomissements et les K+ sont excrétés par le rein en échange d’H+. Une acidurie paradoxale peut se rencontrer malgré l’augmentation de la [HC03-] du fait de l’hypokaliémie se développant. Le rein peut être aussi incapable d’excréter l’excès de bicarbonates en l’absence d’ions Cl- à échanger afin de conserver la neutralité électrique. Les symptômes observés, lors d’alcalose métabolique, sont de même nature que ceux de l’alcalose respiratoire, soit une activité neuromotrice spontanée exacerbée (tétanie, convulsions). On peut noter aussi une faiblesse (difficile en cours d’anesthésie) et une PUPD. Les conséquences cardiaques d’une alcalose métabolique sont, notamment, une augmentation de l’incidence des arythmies et une diminution du taux de survie chez des patients ayant reçu une trop forte quantité de bicarbonates suite à un arrêt cardiaque (69). Le traitement est plus difficile que celui de l’acidose métabolique. Lors d’hypochlorémie, l’administration de fluides riches en Cl- va permettre de restaurer la capacité d’excrétion rénale des HC03-. Le Ringer-lactate est adéquate car contient Na+, Cl- et HC03-. Une supplémentation en K+ devrait être mise en place mais à condition d’éviter la potentielle toxicité cardiaque d’une injection trop rapide. Une injection sous cutanée d’une solution à 35 mEq / L est sans effet secondaire. En IV, il ne faut pas dépasser une dose de 0,5 mEq de K+ / kg / heure (69, 79, 83). 111 I. D - LES ACCIDENTS RESPIRATOIRES Une urgence respiratoire est définie comme l’incapacité du patient à maintenir une ventilation efficace et des valeurs des gaz sanguins normales. La dépression respiratoire se rencontre fréquemment durant l’anesthésie causant apnée et hypoxémie. L’hypoventilation ne peut pas être toujours repérée par la simple observation et requiert parfois un monitorage des gaz sanguins. Malgré son potentiel dévastateur, la dépression respiratoire est facilement réversible et contrôlable en rétablissant l’intégrité des voies respiratoires et en procurant un volume ventilatoire suffisant afin d ‘assurer les échanges gazeux. On s’attellera, ici, simplement aux problèmes rencontrés durant l’anesthésie chez les animaux sans problèmes respiratoires antérieurs autres que les conséquences de leur atteinte cardiaque. I. D. 1 - Origines L’insuffisance respiratoire est commune en anesthésiologie. Les causes incluent l’administration des agents anesthésiques (injectables ou volatils) qui agissent en déprimant l’activité des centres régulateurs de la respiration mais aussi en diminuant la sensibilité des chémorécepteurs à la PaC02 ( même si les stimulations chirurgicales et la durée de l’anesthésie tendent à amoindrir cet effet ) et en inhibant la réponse ventilatoire à l’hypoxie (27). Une apnée est possible lors d’induction aux thiobarbituriques ou au Propofol, ou au cours de l’anesthésie avec emploi de kétamine ou d’halogénés ceci étant, généralement, du à une overdose ou une injection trop rapide (27). Intervient également la capacité fonctionnelle résiduelle du poumon qui tend à diminuer durant l’anesthésie prédisposant le patient à l’hypoxie en abaissant le rapport ventilation / perfusion alvéolaire et augmentant les territoires atélectasiés (ainsi que les atteintes pulmonaires induisant un effet shunt). Les autres origines possibles pouvant induire une modification des paramètres de la respiration sont toutes les atteintes respiratoires telles que l’obstruction des voies supérieures, les atteintes du parenchyme pulmonaire et de la cavité pleurale. I. D. 2 - Conduite à tenir Celle-ci vise, exclusivement, à rétablir une ventilation correcte afin d’assurer l’évacuation du C02 et la bonne oxygénation du sang. C’est pourquoi, dans la majorité des cas, l’ajustement de la délivrance d’02, la mise en place d’une sonde trachéale ( si cela n’était pas déjà fait ) et d’une assistance respiratoire manuelle ou à l’aide d’un respirateur artificiel permet de remédier au problème (27, 77, 83). La FR normale est de 8-12 mouvements par minute et le volume courant idéal de 10-15 ml / kg (77). L’application de ces mesures doit permettre de maintenir une Pa02 et une PaC02 dans les normes (27). L’administration de Doxapram, stimulant respiratoire, est controversée. MUIR ne préconise pas son emploi dans les cas d’apnée ou d’hypoventilation car l’hyperventilation transitoire va se solder par une hypocapnie induisant par la suite une autre période d’hypoventilation. Si l’origine du trouble est liée à un mauvais équilibre entre ventilation et perfusion, notamment lors de collapsus alvéolaire et atélectasie, l’application de pressions positives en fin d’expiration entre 5-10 cm d’H20 permet d’améliorer la compliance 112 pulmonaire et l’état hypoxique dus à une diminution de la capacité fonctionnelle résiduelle pulmonaire (27). Si la dépression respiratoire a été induite par l’utilisation de molécules telles que les opioïdes ou les α2 agonistes, les agents antagonistes peuvent être utilisés. Lors de l’anesthésie d’un insuffisant mitral, il y a toujours le risque de décompensation brutale et l’apparition d’un œdème pulmonaire. Le traitement requiert l’oxygénothérapie (40-50%), l’aspiration si possible des exsudats par voie endotrachéale, l’emploi de bronchodilatateur (aminophylline 6-10 mg /kg PO, SC, IV), la nébulisation d’alcool (40%) dans l’02 afin de prévenir la formation de mousse dans les voies respiratoires et le maintien d’une ventilation à pression positive. Ces mesures ont pour but d’améliorer les échanges gazeux (83). D’autres servent à réduire la pression hydrostatique capillaire notamment en : - diminuant le volume circulant par l’emploi de diurétiques (furosémide 2–4 mg / kg IV, IM, SC) (83) - redistribuant le flux sanguin pulmonaire vers d’autres territoires : vasodilatateurs (nitroprussiate de sodium, prasozine) qui vont redistribuer le flux vers les zones périphériques du fait de la vasodilatation et diminuer la résistance au flux (postcharge).Mais aussi le furosémide qui en plus de son action diurétique, va accroître la capacité veineuse (83). - améliorant la fonction cardiaque : emploi d’inotropes positifs (dobutamine, dopamine) ou d’antiarythmiques afin de contrôler les éventuelles troubles du rythme Quoiqu’il en soit le monitorage trouve ici une utilité de choix dans le contrôle de l’efficacité du traitement. II - LE MONITORAGE CARDIOVASCULAIRE DE L’IMC Le monitorage de la fonction respiratoire permet de surveiller et de corriger le contenu sanguin en 02. Le transport de l’02 aux tissus dépend, lui, de la capacité du cœur à expulser le sang dans le réseau vasculaire. Le paramètre principal de cette fonction est le débit cardiaque (Q). Cependant, comme la fonction respiratoire, le nombre de paramètres mesurés ainsi que les méthodes employées seront fonction de la sévérité de l’atteinte cardiaque. II. A - MONITORAGE CARDIOVASCULAIRE DE L’IMC DE STADE I ET II La surveillance de tels patients nécessite, en dehors des paramètres facilement évaluables comme la couleur des muqueuses, le temps de recoloration capillaire et l’auscultation cardiaque, l’évaluation de la perfusion tissulaire, la mesure de la pression artérielle de façon non invasive et un suivi de la FC et du rythme cardiaque par un ECG. II. A. 1 - Evaluation de la perfusion tissulaire La palpation du pouls est subjective et nous renseigne sur peu de choses en ce qui concerne le statut cardiovasculaire. La pression du pouls artériel est la différence entre la pression artérielle systolique et diastolique. Elle est fonction du volume d’éjection et de la compliance des artères. 113 Le pouls artériel est caractérisé par sa fréquence, rythme et intensité, le rythme cardiaque doit être pris simultanément. Des arythmies peuvent être à l’origine d’une variation de l’amplitude du pouls. La prise du pouls est possible en différents endroits (artère fémorale, métatarsienne ou linguale). Une légère pression est appliquée, une trop forte pouvant induire une mauvaise interprétation. Un pouls faible peut impliquer un volume d’éjection ventriculaire moindre résultant d’une précharge inadéquate (hypovolémie), d’une insuffisance ventriculaire, d’une atteinte péricardique ou d’une arythmie sévère responsable d’un faible remplissage diastolique. Un pouls bondissant résulte d’une augmentation de la pression pulsatile due soit à une pression systolique accrue soit une pression diastolique diminuée (vasodilatation) (45). D’autres paramètres nous renseignent plus directement sur la perfusion tissulaire notamment le temps de recoloration capillaire, la couleur des muqueuses ainsi que des organes éventuellement visibles durant la chirurgie (36, 45, 83, 90). Le temps de recoloration capillaire (TRC) est un indice de la perfusion tissulaire et du tonus vasomoteur (45, 83). Il est obtenu en blanchissant la muqueuse gingivale, buccale ou vulvaire par simple pression puis en déterminant le temps nécessaire à la recoloration, il doit être inférieur à 2 secondes. Un TRC prolongé est révélateur d’un tonus sympathique accru et d’une vasoconstriction secondaire à une hypovolémie, aux agents anesthésiques ou à l’hypothermie (45, 83). Un changement de couleur des muqueuses ou des viscères peut être observé, il peut avoir plusieurs causes. La cyanose est associée à un taux d’hémoglobine réduite supérieur à 5 g / 100 ml. Dans le cas d’anémie sévère où il est impossible d’obtenir 5 g / 100ml d’Hb réduite, il ne peut y avoir de cyanose même si le taux D’02 est bas, c’est ce que l’on nomme l’hypoxie anémique (45, 76). Durant une anesthésie gazeuse, la relative hyperperfusion tissulaire (peau et muqueuses) fait de la cyanose un problème postopératoire plutôt que per-opératoire (45). La cyanose peut être d’origine respiratoire (mauvaise oxygénation) ou circulatoire (mauvaise perfusion : baisse du débit, hypoperfusion). L’analyse des gaz sanguins artériel et veineux permet de calculer le rapport 02 utilisé / 02 délivré qui est égale à : (Ca02 - Cv02) / Ca02 veineux où Ca02 est le contenu artériel en 02 et Cv02 le contenu Ceci permet de vérifier l’origine du trouble. Ce rapport doit être de 0,25, toute augmentation signe une réponse adaptative à une diminution de perfusion des tissus. Un rapport supérieur à 0,5 suggère un débit inadéquat (90). La concentration d’acide lactique et la diminution du pH sanguin suggèrent aussi un Q faible par rapport aux besoins tissulaires. Pour finir, l’évaluation de la fonction rénale est un bon indice de la perfusion des organes. On peut l’estimer par le dosage de l’azotémie prérénale. La variation de l’urémie évolue parallèlement au débit cardiaque et peut être utilisée afin de déterminer si une thérapeutique, instaurée pour accroître le débit, est efficace (90). Le débit urinaire est aussi un indicateur sensible du débit cardiaque (45, 83, 90). La production d’urines peut être appréciée, grossièrement, par la palpation de la vessie ou plus précisément par leur récolte au moyen d’une sonde (36, 45, 83, 90). La production doit être d’au moins 1-2 ml / kg / h (36, 45, 71, 83, 90). Ces différentes techniques nous permettent d’estimer plus ou moins grossièrement le débit cardiaque. Une méthode plus précise nécessite la mise en place de matériel invasif et coûteux ainsi qu’une technique et des compétences évoluées. 114 II. A. 2 - Mesure indirecte de la pression artérielle Cliniquement, les variations de la pression artérielle reflètent les modifications de la postcharge (77). Cette approche est raisonnable dans la plupart des cas car les changements de diamètre ou de l’épaisseur de paroi se rencontrent rarement hormis lors d’hypovolémie ou de décompensation brutale. Des changements de volume vasculaire, du tonus du système nerveux autonome ou de la fonction cardiaque associés aux effets des agents anesthésiques, peuvent avoir des répercussions sur la résistance vasculaire périphérique ou l’élasticité de l’aorte. Ceci implique la nécessité de choisir avec précision les substances anesthésiques afin de minimiser les effets délétères sur la postchage et le débit cardiaque. La postcharge est un déterminant majeur du volume d’éjection et ainsi du débit cardiaque, particulièrement chez les patients insuffisants cardiaques. Elle peut être considérée comme la tension de la paroi ventriculaire nécessaire à l’éjection du sang dans l’aorte ascendante et est grandement influencée par la résistance vasculaire périphérique et l’élasticité de l’aorte (77). Les patients avec des ventricules dilatés peu contractiles sont nettement dépendants de la postcharge car ils ne peuvent développer une tension de paroi suffisante à l’éjection d’assez de sang dans l’aorte. Les effets de certains agents comme les α2 agonistes ou la kétamine qui induisent une augmentation de la résistance vasculaire, diminuent le volume d’éjection. La mesure de la pression artérielle ( PA ) est d’autant plus intéressante qu’elle permet d’apprécier la perfusion des tissus. En effet, la PA et l’activité métabolique locale sont les principaux déterminants du flux sanguin cérébral, coronaire et rénal. Cependant, la PA n’est pas l’équivalent du débit, elle est fonction du flux et de la résistance vasculaire, l’augmentation de cette dernière se solde par une hausse de la PA sans pour autant que le débit soit accru. 115 a - le détecteur de flux à effet doppler La sonde est appliquée sur la peau, préalablement rasée, en regard d’une artère périphérique suffisamment superficielle. Les sites les plus propices pour la détection du plux artériel se situent, pour le chien et le chat, dans la région métacarpienne en face palmaire juste sous l'ergot ou dans la région métatarsienne en face plantaire ou dorsale (figure 20) (95). Les ultrasons utilisés ont une fréquence de 4 mégahertz et sont donc inaudibles pour l’homme. Cependant, la différence de fréquence entre l’émission et la réception se situe dans l’intervalle audible (0-5 KHz) pour les vitesses d’écoulement normales du flux sanguin. Ce signal est envoyé à un écouteur soit à un haut parleur. Le positionnement de la sonde se fait par palpation du pouls artériel soit grâce à l’audition du signal doppler. Un brassard gonflable, modèle adulte pour les chiens de grande taille, pédiatrique pour les petites, est ensuite appliqué en amont de la sonde doppler autour du membre puis connecté à un sphygomanomètre. Le brassard doit être choisi de telle sorte que sa largeur corresponde à 40% de la circonférence du membre. Il doit être ajusté étroitement au dessus de l’articulation radio-carpienne ou tibio-tarsienne mais sans trop serrer. La plupart des erreurs de mesure sont dues à un mauvais choix ou positionnement du brassard. Si la largeur est trop faible, le brassard pas assez serré, une pression plus élevée est nécessaire afin d’occlure l’artère sous jacente induisant ainsi une mesure faussement élevée. Inversement, une largeur d’application trop grande occlut le vaisseau sur une distance plus longue offrant une résistance au flux à des pressions au dessous de la pression systolique, les valeurs ainsi obtenues sont faussement basses. La mesure est réalisée de la façon suivante. Le brassard est gonflé jusqu’à disparition du pouls périphérique et, par conséquent, celle du signal doppler. Puis il est dégonflé lentement en surveillant, sur le manomètre, la diminution de presion. La pression systolique correspond à celle dans le brassard lorsque le premier signal doppler est perceptible. Ce signal est audible uniquement en systole ce qui lui confère un caractère discontinu. Au fur et à mesure que le brassard se dégonfle, de plus en plus de sang artériel parvient à passer l’obstacle que représente le brassard. La pression diastolique correspond à la valeur lue sur le manomètre au moment où le signal audible devient continu sur l’ensemble du cycle cardiaque. Cependant cette mesure de la pression diastolique est forte imprécise et délicate (95). C’est pourquoi on utilise cette technique pour mesurer uniquement la pression systolique (36, 45, 90, 95). Pour celle ci, la technique est assez sensible mais il est à considérer que la précision de la mesure est de l’ordre de + / - 10 mmHg et que des artéfacts comme la vasoconstriction ou un débit faible peuvent influencer les valeurs obtenues (45, 95). Quoiqu’il en soit, ce qui importe surtout, ce n’est pas tant la mesure quantitative à un instant donné mais plutôt l’évolution de la pression en fonction du temps (45, 95). b - la technique oscillométrique Cette technique nécessite, elle aussi, la mi 116 Fig 20 : mesure de la pression artériel par système doppler à l'aide d'un brassard D'après ORTON CE (90) 118 même niveau que le cœur sans quoi un facteur correcteur doit être soustrait ou ajouté à la mesure : +/- 2 mmHg pour chaque tranche de 2.5 cm que le brassard se trouve au dessous ou au dessus du plan horizontal du cœur (45). Dans ce cas aussi, la surveillance de la variation de la pression est plus importante que les valeurs absolues (36, 45). L’avantage de cette méthode est son automaticité ainsi que la cyclicité et la facilité d’utilisation. Les désavantages incluent les potentiels ecchymoses ou œdème tissulaire. En effet, les mesures peuvent être faites à une grande fréquence, une ischémie tissulaire peut se développer du fait de l’arrêt de la circulation atteignant jusqu’à 75% du temps (45). Ces techniques non invasives sont moins précises lorsque le vaisseau est petit, la pression faible ou en cas de vasoconstriction. La mesure directe de la pression artérielle est nettement plus précise et continue mais requiert la pose d’un cathéter intra-artériel et un équipement plus coûteux. II. A. 3 - Mesure de la fréquence et du rythme cardiaques Ces derniers interviennent de façon importante dans le débit au même titre que le volume d’éjection systolique. La fréquence cardiaque est le nombre de contractions du cœur en une minute. Elle peut être évaluer de différentes manières. Les plus simples sont la palpation directe de la paroi costale en regard du cœur et la recherche du choc précordial, la palpation du pouls périphérique au niveau de l’artère fémorale, métatarsienne ou linguale. Une méthode indirecte consiste en l’utilisation du stéthoscope œsophagien. Peu coûteux et très utile, il permet d’apprécier la FC et le rythme (permet de repérer d’éventuelles arythmies (83)) ainsi que la fonction respiratoire. Il peut être, en plus, relié à un haut parleur. Le système doppler (pour la surveillance de la pression) donne également une reproduction sonore de la FC mais c’est un dispositif relativement coûteux. L’appareil le plus intéressant permettant d’apprécier simultanément la fréquence et le rythme cardiaque est l’électrocardiographe (ECG). C’est un système à 3 dérivations qui permet une visualisation directe, non invasive et continue de l’activité électrique du cœur. La dérivation en D II est la plus utilisée. Une surveillance continue de l’ECG offre la possibilité de reconnaître rapidement tout changement de l’activité électrique associé à des troubles de la conduction ou de l’excitation. L’ECG est aussi utile dans la détection des arythmies plus graves, mettant en danger la vie du patient. En routine, le coût d’un ECG est minime et les bénéfices apportés pour la surveillance des patients sont substantiels. La mise sous ECG est recommandée pour tout type de patient et d’intervention, elle devient indispensable chez le patient prédisposé aux arythmies comme lors insuffisance mitrale de stade évolué (III et IV) (77). Un ECG normal, ou presque normal, n’implique pas obligatoirement une mécanique cardiaque intacte. L’exemple majeur est celui de la dissociation électromécanique qui se caractérise par un ECG proche de la normale sans pour autant que le cœur se contracte. Ainsi l’ECG joue un rôle important voire indispensable dans la surveillance et le diagnostic peropératoire des troubles du rythme mais il a ses limites qu’il faut savoir 119 apprécier. C’est pourquoi, il est recommandé de surveiller conjointement la pression artérielle, les bruits cardiaques ainsi que la qualité du pouls (45). 120 Fig 21 : dispositif permettant la mesure de la Pression Veineuse Centrale ( PVC ) D'après ORTON CE (90) 121 Chez le chien, la norme de fréquence se situe entre 70-180 battement par minute (bpm). Les limites autorisées lors de l’anesthésie, en dehors desquelles le cœur n’assure plus correctement sa fonction sont < 60 bpm et >200 bpm (83). La relation entre le débit et la FC en fait un important déterminant. Chez l’insuffisant cardiaque, la réponse neurohumorale compensatoire, rend le patient, en grande partie, dépendant de la FC (76). Toute modification sévère doit être évitée ou rapidement corrigée. Notamment la bradycardie (FC < 60 bpm) où le débit est compromis car l’augmentation du volume d’éjection ne permet pas de remédier au peu de contractions ventriculaires (45). La tachycardie est, elle aussi, dangereuse surtout chez l’insuffisant mitral de stade III et IV. En effet, la tachycardie est caractérisée par une diastole très courte donc un temps de perfusion du muscle cardiaque réduit ce qui peut précipiter le patient dans une phase d’hypoxie et induire une décompensation brutale de son problème cardiaque. L’augmentation du travail cardiaque nécessite, en effet, une consommation accrue en 02 donc une perfusion accrue mais le temps de diastole, réduit, se solde par un volume d’éjection réduit, lui aussi, et l’augmentation de la FC ne remédie pas à cette chute (45). II. B - MONITORAGE CARDIOVASCULAIRE DE L’IMC DE STADE III ET IV Du fait de la plus grande instabilité de la fonction cardiaque, le monitorage s’enrichit d’une mesure directe de la pression veineuse centrale et de la pression artérielle. II. B. 1 - Mesure de la PVC La précharge est définie comme l’étirement du muscle cardiaque en fin de diastole (36), qui est fortement corrélé, in vivo, au volume de fin de diastole .Ce dernier est difficilement mesurable (46), c’est pourquoi on l’estime par la pression veineuse centrale (pression intrathoracique dans la veine cave caudale ou dans l’atrium droit) pour le cœur droit (76, 87, 101) ou par la pression capillaire pulmonaire pour le cœur gauche (76, 101). Cependant, c’est une mesure de pression non de volume que l’on obtient. Elle n’est alors pas véritablement représentative de la précharge lors de maladie affectant la compliance ventriculaire (hypertrophie, tamponnade, fibrose). Les performances diastoliques (relaxation du myocarde) peuvent être aussi affectées par certains anesthésiques (36). a - matériel et méthode Le matériel nécessaire se compose d’un cathéter intraveineux d’une longueur suffisante pour atteindre la veine cave voire l’atrium droit (72, 83), celui ci peut être substituer par un tube nasogastrique stérile de 3,5-5 french et un cathéter (14G ou 16G), d’un manomètre, constitué d’une pipette graduée, tubulure et robinet à trois voies et d’un set de fluidothérapie (figure 21) (11). L’animal est placé en décubitus latéral, les membres antérieurs étendus vers l’arrière. La région ventro-latérale est tondue et préparée comme pour un acte chirurgical. Le repérage de la veine jugulaire se fait par compression à l’entrée du thorax, peut s’ajouter à cela une incision de la peau voire une véritable approche chirurgical du vaisseau. Le cathéter intraveineux (ou la sonde naso-gastrique) est introduit jusqu’au cœur au travers du cathéter préalablement posé. Le sang est aspiré dans une seringue de 10 ml afin d’éviter la présence de bulles d’air dans le circuit puis on injecte une solution saline afin de purger le tube et on connecte la 122 tubulure (non compliante et courte), le robinet à trois voies et le cylindre gradué. La tubulure de fluidothérapie est connectée au dernier port du robinet. 123 Fig 22 : courbe de la PVC en fonction du cycle cardiaque D'après JONES JL (46) 124 Le cylindre gradué est suspendu de telle façon que le robinet à 3 voies se trouve sous la ligne de base du cœur. Le point zéro du cylindre correspond à la ligne horizontale passant par la base du cœur, le sternum lorsque le patient est en décubitus latéral et la pointe de l’épaule (83) ou le manubrium en décubitus ventral ou dorsal (11, 36, 46). Le cathéter peut être connecté, via une tubulure, à un transducteur calibré permettant une mesure plus précise et continue ( figure 22 ) (11, 36, 46). Cette courbe est utilisée en médecine humaine dans le diagnostic d’affections cardiaques (11). b - mesure Le robinet à 3 voies est tourné de façon à ce que le fluide remplisse la pipette graduée puis on ouvre le circuit entre pipette et patient, la colonne de fluide tombe au niveau de la PVC (46, 101). La mesure doit être faite en fin d’expiration ou avant l’inspiration (36, 46). Comme les autres techniques, le plus important est de multiplier les mesures afin d’avoir un aperçu des variations de PVC La PVC est un équilibre entre le débit cardiaque : capacité du cœur à pomper le sang de l’atrium droit et le retour veineux : tendance du sang périphérique à regagner l’atrium droit. La norme pour des animaux anesthésiés est de 0-10 cm d’H20 (11, 36, 46). Une étude menée par ONKLEY et Coll révèle une différence d’environ 2,7 mmHg (1 cm d’H20 = 0,75 mmHg) entre les mesures faites au manomètre et celles obtenues avec le transducteur (le manométre étant plus précis) (87). c - indications Hormis la mesure de la PVC, le cathéter central permet le monitorage de la fluidothérapie (11, 46, 83), et un bon site de prélèvement de sang veineux et offre une voie d’administration de substances irritantes, thrombogènes et vaso-actives (11). Rem : Contrairement au ventricule droit, à paroi fine et relativement compliant, le ventricule gauche est constitué d’une paroi musculaire épaisse et peu compliante. Lorsque l’on administre un fluide afin d’accroître la précharge dans le ventricule gauche, l’augmentation du volume en fin de diastole se répercute par une forte élévation de la pression intra-ventriculaire gauche télédiastolique. Du fait de la différence de compliance entre les 2 côtés du cœur, lorsque la précharge est accrue afin d’améliorer le débit, on assiste à une élévation de la pression télédiastolique de l’artère pulmonaire 2 fois supérieure à celle de la PVC. Pour un cœur sain, cette relation entre les pressions de remplissage des ventricules droit et gauche permet à la PVC d’être un index de la fonction du cœur droit et gauche. Cependant, chez les insuffisants mitraux, la fonction cardiovasculaire peut être plus ou moins remaniée et la divergence entre les 2 paramètres (PVC et PCP) s’accentue (46). De tels patients sont alors de bons candidats à un monitorage de la pression capillaire pulmonaire (PCP) . Cette technique requiert la pose d’un cathéter dans l’artère pulmonaire (SWAN-GANZ). Elle présente de très nombreux risques et nécessite des compétences particulières (pose du cathéter, interprétation des résultats). Les risques encourus par le patient peuvent avoir de sérieuses conséquences : pneumothorax, rupture du ballon du cathéter avec embolisation d’air, perforation de vaisseaux et hémorragie, arythmies lors du passage dans le ventricule droit. Sa mise en pratique est pour l’instant réservée aux centres universitaires, à la recherche et à quelques praticiens (11, 46). 125 - - - - d - facteurs influençant la PVC le volume sanguin : l’augmentation du volume sanguin induit une élévation de la PVC (rétention hydrique rénale lors d’IRC ou fluidothérapie trop zélée). la diminution de celui ci induit à l’inverse une baisse de la PVC (hémorragie sévère, déshydratation, séquestration d’une partie du sang : dilatation – torsion d’estomac, volvulus) (72, 83). le tonus vasculaire : ce dernier est régulé par le système nerveux sympathique et des facteurs tissulaires locaux. Il peut être altéré par certains agents anesthésiques. La veinodilatation engendre une baisse de la PVC du fait de la chute du retour veineux, la dilatation artériolaire induit une augmentation de la PVC par diminution de la résistance périphérique au débit cardiaque autorisant un flux plus rapide des artères aux veines (72, 83). la contractilité myocardique, régulée par le système nerveux autonome (le retour veineux joue, là aussi, un rôle : la veinoconstriction accroît la contractilité, certains agents anesthésiques la diminue). Un cœur moins contractile induit une hausse des valeurs de PVC car la pompe cardiaque se trouve dans l’incapacité d’éjecter les quantités de sang au fur et à mesure qu’elles arrivent et on observe une stase sanguine en amont (72, 83). la FC, elle aussi est régulée par le système nerveux autonome. Une hausse brusque de celle ci induit une chute de la PVC. Cependant, elle peut être augmentée lors d’épisodes de tachycardie extrême du fait du temps de remplissage ventriculaire réduit. La bradycardie, les arythmies sont à l’origine d’une augmentation de la PVC car ils diminuent le débit cardiaque (72, 83). des facteurs externes tels que la pression intra thoracique influencent les valeurs de PVC : si elle augmente, le retour veineux chute, la PVC augmente et le débit baisse (interviennent dans ce sens, le cycle respiratoire, la ventilation assistée à pression positive intermittente, le pneumothorax ou la hernie diaphragmatique). une pression intra-péricardique élevée comme lors de tamponnade ou de hernie péricardique, peut compromettre le remplissage ventriculaire et être à l’origine d’une hausse de la PVC . La position du corps joue, également, sur la pression hydrostatique vasculaire (chez le cheval, entre le décubitus dorsal et latéral, il existe une différence de 10-15 cm d’H20) (83). e - valeur clinique de la PVC Trois situations peuvent se rencontrer - diminution du volume sanguin et fonction cardiaque normale (P de la PVC et P Q) - augmentation du volume sanguin et fonction cardiaque normale (N de la PVC et N Q) - patient normovolémique et défaillance cardiaque (N PVC et P Q) • attitude à avoir devant une diminution de la PVC Celle ci est dans la majorité des cas liée à une hypovolémie absolue ou relative (36, 71, 72, 83). Ces patients doivent faire l’œuvre d’une fluidothérapie intraveineuse afin d’amener la PVC à la valeur supérieure de l’intervalle de normalité. Par la suite, la fonction cardiaque doit être appréciée. Elle est estimée adéquate si les signes d’une bonne perfusion sont présents : débit urinaire normal, pouls frappé, muqueuses roses, TRC< 2 secondes. Si, au contraire, l’administration de fluide s’accompagne de signes de perfusion déficiente, d’acidose métabolique et ou d’œdème pulmonaire, un traitement visant à améliorer la contractilité cardiaque est à prescrire (90). 126 • attitude à avoir devant une augmentation de la PVC Celle ci implique, généralement, une hypervolémie ou une défaillance cardiaque avec risque d’œdème pulmonaire et d’acidose lactique due à la mauvaise perfusion tissulaire. L’origine de cette modification peut être une fluidothérapie trop zélée, une maladie cardiaque pré-éxistante ou l’action dépressive des agents anesthésiques sur le cœur. La riposte se constitue de la diminution voire de l’arrêt de la fluidothérapie (71, 83), l’administration de substances cardiotoniques et de diurétiques (furosémide 2-4 mg / kg) (83). f - complications La mesure de la PVC nécessite une technique invasive. Les risques de complication sont élevés et incluent la perturbation de l’hémostase et de la coagulation par une héparinisation excessive des tubulures, la thrombophlébite, la septicémie, l’embolisation de bulles d’air, la ponction vasculaire 127 (36, 46, 83) (tamponnade, hémorragie ) voire les arythmies si le cathéter passe dans le ventricule droit (les contacts avec l’endocarde de l’atrium ou du ventricule sont à l’origine d’activités ectopiques ) (36). II. B. 2 - Mesure directe de la pression artérielle Chez le chien, c’est l’artère métatarsienne dorsale qui est principalement utilisée à cet effet : peau fine, peu de tissu donc les collection ou hématome, lors de la ponction, sont rares (figure 24) (36, 46, 83). a - matériel et méthode Le matériel se compose d’un cathéter intra-artériel, de tubulures non compliantes à paroi épaisse, d’un transducteur et d’un oscillographe ( ou d’un manomètre à mercure ). Après la tonte de la région métatarsienne et la préparation chirurgicale du site, l’artère est repérée par palpation puis la peau scarifiée à l’aide du biseau de l’aiguille. Une autre technique implique l’isolement chirurgical de l’artère. Le cathéter est ensuite placé sur la paroi dorsale du vaisseau, le biseau du mandrin tourné vers le haut. Le bout de l’aiguille et l’artère sont palpés simultanément avec un doigt et le cathéter introduit doucement jusqu’à ce que le bout de l’aiguille ait pénétré dans le vaisseau puis poussé dans le sens longitudinal de l’artère sans transpercer l’autre côté de la paroi. Le cathéter est ensuite poussé entièrement, le mandrin retiré rapidement et on place la tubulure remplie de solution saline héparinée (figure 23, 24). Le cathéter est fixé à la peau par des sutures ou de la colle chirurgicale (36). La tubulure mise en place doit être non compliante à paroi épaisse afin d’éviter les déperditions d’énergie (le diamètre interne doit être de 1.5-3 mm et sa longueur inférieure à 60 cm). Il faut aussi éviter les robinets d’arrêt qui pourraient emprisonner des bulles d’air (46). b - mesure La tubulure relie le patient à un manomètre à mercure ou à un transducteur (alternative plus sophistiquée) qui convertit les mouvements d’un diaphragme en signaux électriques (46). Les pressions systolique et diastolique sont mesurées directement et la pression moyenne est estimée en mesurant l’aire sous la courbe (46, 83). La plupart des appareils le font automatiquement sinon une méthode approximative consiste à diviser la somme des pressions diastolique et systolique par 3 et de rajouter le résultat à la pression diastolique (83). c - renseignements apportés par l’étude de la courbe (fig 25) Le pouls se transmet beaucoup plus rapidement le long de l’arbre vasculaire que le sang. En effet, il est ressenti 200-300 ms après l’éjection au niveau des artérioles. Cette courbe se compose de différentes phases : Phase de début de systole : composante inotrope Phase de déplacement du volume : phase médio-systolique Phase d’atténuation et de réflexion : phase télé systolique et diastolique La première correspond à la mise en tension du ventricule et à l’éjection du sang dans l’aorte, l’inclinaison de la pente est un indicateur qualitatif de la contractilité du myocarde (82, 83). La deuxième correspond à l’éjection continue de sang, la pression continue d’augmenter tant que le volume sanguin apporté est plus important que celui chassé (82, 83). 128 La dernière correspond à la fin de systole où le volume apporté est plus faible que celui chassé et à la fermeture des valves aortiques : la pression diminue. Entre chaque phase, on note une sorte d’encoche, la première signale la discontinuité entre la composante inotrope et la phase d’éjection volumique. La seconde est due à la brutale décélération lors de la fermeture des valves sigmoïdes (83). 129 Fig 23 : cathétérisme de l'artère fémorale D'après ORTON CE (90) Fig 24 : cathétérisme de l'artère podale dorsale D'après ORTON CE (90) 130 Lors du déclin de la pression, durant la diastole, les ondulations de la courbe sont dues à la résonance dans les gros vaisseaux et au phénomène de réflexion dans les vaisseaux périphériques (83). Plus on s’éloigne de l’aorte vers les petites artères et plus l’amplitude de la courbe augmente du fait de la moindre élasticité des vaisseaux. La pression moyenne est relativement constante le long de l’arbre artériel (83). L’étude de la composante inotrope, dépendant de la précharge (retour veineux), de la postcharge (résistance vasculaire) et de la fréquence cardiaque, nous renseigne sur plusieurs points. Une diminution de cette composante peut résulter d’une dépression du myocarde (pathologie pré-existante, anesthésie, inhibition de la stimulation β adrénergique), d’une diminution du retour veineux (hypovolémie, veinodilatation, ventilation assistée) ou d’une baisse de la résistance périphérique (diminution du tonus sympathique, anesthésie ou endotoxémie)(83). Un pic étroit avec chute rapide de la pression indique un faible volume d’éjection. A l’inverse, un volume d’éjection important se soldera par un sommet de courbe large et une composante diastolique à pente douce. Une résistance vasculaire élevée va induire un phénomène de réflexion exagéré et une composante diastolique beaucoup plus horizontale (83). d - complications Les complications du cathétérisme artériel incluent : hématome, embolisation de bulles d’air, thrombose ou occlusion (rare), formation de fistule artério-veineuse ou d’anévrisme, exsanguination, infection (septicémie) (46, 83, 90). Lors du retrait du cathéter, une pression manuelle est appliquée sur le site durant 5 minutes afin d’éviter toute formation d’hématome (46, 83). e - valeurs cliniques de la PA Le monitorage de la pression artérielle permet d’évaluer notamment : • la profondeur de l’anesthésie En effet, l’action des agents, sur le débit et la résistance vasculaire périphérique, peut affecter la valeur de la pression. Si le niveau de l’anesthésie est trop superficiel, l’animal répond aux stimuli douloureux par une augmentation du tonus sympathique et de la pression. A l’inverse, si le niveau est trop profond, la perte des réflexes homéostatiques et la défaillance potentielle du myocarde sont à l’origine d’une diminution de la pression artérielle moyenne avec une composante inotrope de pente plus douce et une pression pulsatile plus faible . • la gestion de la fluidothérapie Un pic de pression étroit peut indiquer un besoin de fluides. Des divergences marquées de la courbe de pression, par rapport à celle de base ,après une ventilation assistée, implique souvent un besoin immédiat en fluide . • la perfusion tissulaire La pression artérielle moyenne doit rester supérieure à 60 mmHg durant l’anesthésie car la pression moyenne requise pour maintenir une perfusion cérébrale, rénale et coronarienne se situe entre 50-60 mmHg. La prévention de l’ischémie tissulaire et de l’acidose métabolique subséquente, repose sur cette valeur limite (pour un contenu sanguin artériel en 02 normal) (36, 46, 83). 131 MUIR va plus loin et suggère de maintenir une pression artérielle moyenne supérieure à 70 mmHg chez les patients dont la fonction cardiaque est plus ou moins compromise, et que toute diminution 132 Fig 25 : allure générale de la courbe de pression artérielle PA Composant e Phase médio systolique Phase télésystolique et diastolique 133 de pression doit faire penser à une diminution du débit car, lors de dysfonction cardiaque, la résistance vasculaire augmente (77). Les normes des pressions systolique, diastolique et moyenne sont respectivement de 100-160, 60-100 et 80-120 mmHg (36). Une pression systolique inférieure à 80 mmHg peut engendrer des troubles de perfusion cérébrale ou et coronarienne et nécessite la mise en place rapide d’un traitement. L’hypotension peut être due à une hypovolémie, une vasodilatation périphérique ou une diminution de la contractilité du myocarde. L’hypovolémie est la cause la plus commune et doit être traitée par l’administration de cristalloïdes et colloïdes (36). La vasodilatation artérielle, avec chute de la résistance vasculaire, va permettre d’augmenter le volume d’éjection en réduisant la postcharge et en améliorant le retour veineux et la précharge. Les agents induisant une vasodilatation artérielle incluent les α bloquants, les inhibiteurs calciques, et les IEC. Le désavantage est qu’ils engendrent une hypotension systémique. Si l’origine de l’hypotension est une chute du débit suite à une baisse des performances du myocarde, le traitement implique l’emploi de substances inotropes (36, 45, 77, 83, 90). Ces agents inotropes améliorent le volume d’éjection et le débit en augmentant la contractilité. La gestion d’une insuffisance cardiaque peut requérir l’utilisation de substances sympathomimétiques ( α2 agonistes )(36). Certains agents, causant moins d’effets vasopresseurs, peuvent être administrés pour un soutien plus long : dobutamine, dopamine, épinéphrine, éphédrine 36, 90). La perfusion intraveineuse continue de dopamine (1-5 µg / kg / min) à un effet inotrope, chronotrope positif et améliore la perfusion des viscères par son effet dopaminergique. La dobutamine est un β1 agoniste et le moins chronotrope et arythmogène de toutes les substances préalablement citées (il est administré en perfusion IV de l’ordre de 1-10µg / kg / min). L’épinéphrine est utile lorsque l’on souhaite obtenir des effets inotrope, chronotrope positifs et une augmentation de pression. Administré en perfusion IV au rythme de 0,10,3 µg / kg / min ou en bolus de 20µg / kg, c’est l’agent le plus efficace dans la réanimation cardiaque mais aussi le plus arythmogène. Une action à plus long terme est obtenue par administration de digitaliques (Digoxine) . Quoiqu’il en soit, face à une hypotension sévère, l’attitude à avoir vise d’abord à diminuer le débit de l’anesthésique gazeux et augmenter le rythme de la fluidothérapie puis, si la pression ne semble pas s’améliorer, utiliser des agents inotropes(46, 83, 90). Les cas où il est indiqué d’accroître la résistance vasculaire sont rares et entrepris en dernier recours. Cet effet peut être obtenu par l’injection d’épinéphrine ou de phényléphrine (0,05-0,1 mg / kg) mais il est de courte durée (90). Les conséquences de l’hypotension prolongée sont : IRA, développement d’arythmies cardiaques et choc (45, 83). • la consommation du myocarde en 02 Cette dernière est directement reliée à la postcharge ventriculaire ( l’augmentation chronique de la tension de paroi, se développant lors de sténose aortique ou pulmonaire, induit une hypertrophie ventriculaire et prédispose le cœur aux ischémies et arythmies ) . Le produit de la FC et de la pression artérielle systolique peut être utilisé afin d’estimer les variations de la consommation en 02 du myocarde durant l’anesthésie (76). 134 Fig 26: cathéter de Swan Ganz D'après ORTON CE (90) Fig 27: position intracardiaque du cathéter La position exacte de la sonde est réalisée en obtenant successivement les courbes de pressions de l'atrium droit, du ventricule droit et de l'artère pulmonaire 135 D'après ORTON CE (90) II. B. 3 - Mesure directe du débit cardiaque et de la pression pulmonaire Du fait du coût de l’équipement, des compétences requises et de la technique développée, la mesure directe du débit n’est pas chose aisée et réservée au stade ultime de l’IMC (77, 90). La technique de thermodilution nécessite la mise en place d’un cathéter de SWANGANZ (fig 26, 27) équipé d’une thermistance, dans une branche de l’artère pulmonaire. Le principe est d’injecter une solution saline à volume et température connus et d’enregistrer les variations de température au niveau de la thermistance (90). On obtient ainsi une courbe de température en fonction du temps. L’aire sous la courbe est inversement proportionnelle au débit cardiaque (figure 27). La norme du débit est de 150-200ml / kg / minute (90). II. C - COMPLICATIONS ET URGENCES CARDIOVASCULAIRES Des troubles de la fréquence ou du rythme cardiaque, avec leur corollaire d’hypotension et de défaillance de la microcirculation périphérique caractérisant l’état de choc, peuvent survenir à tout moment. Le risque augmente avec l’âge et l’état général du patient (5). L’urgence cardiaque est définie comme l’impossibilité de maintenir un débit d’éjection systolique compatible avec la vie. Les causes de cet état de choc sont les troubles du rythme et l’arrêt cardiaque. Pour les premiers, l’urgence est relative et dépend de la gravité de l’atteinte. Le second est une urgence absolue. II. C. 1 - Les troubles du rythme peropératoires a - diagnostic L’utilisation de l’ECG ainsi que sa parfaite maîtrise sont la clef de voûte du diagnostic. L’ECG est interprété en se posant 4 questions : c la fréquence cardiaque est-elle normale ou anormale ? d le rythme est-il sinusal ou non ? Y a-t-il une onde P avant chaque qRs et un qRs après chaque P ? e le rythme est-il régulier ou irrégulier ? ( L’espace R-R est-il constant ? ) f la morphologie de P et du qRs est-elle normale ? ( qRs fin ou élargi ? ) Durant l’anesthésie deux sortes de troubles peuvent compromettre le débit cardiaque, ce sont les bradycardies et les tachycardies. b - les bradycardies : bradycardie sinusale et blocs auriculoventriculaires • étiologie La cause la plus fréquente de bradycardie sinusale, chez les animaux anesthésiés, est la dépression du SNC qui suit l’administration du ou des agents (5). On reconnaît, cependant, d’autres mécanismes étiopathogéniques notamment l’hypothermie, un tonus vagal accru du à des manœuvres chirurgicales (tractions sur les viscères, intubation 136 trachéale, pression sur les globes oculaires), l’hypoxie (dans son stade terminal) ou encore l’hyperkaliémie, l’hypothyroïdie, les maladies affectant la conduction (sick sinus syndrome) (5, 27, 36, 83). Les blocs auriculo-ventriculaires sont les conséquences d’anomalie de conduction et reconnaissent une étiologie comparable. 137 On distingue des blocs de 1er degré (BAV 1) caractérisés par un allongement de l’espace P-R, les BAV 2 consistant en certaines ondes P non suivies de qRs et les BAV 3 définis comme la dissociation entre l’activité électromécanique des atriums et des ventricules (ondes P non suivies de qRs de façon permanente et qRs de morphologie ventriculaire, irréguliers et peu nombreux < 40 / minute) (5). Parmi les agents pharmacologiques, la xylazine et la dobutamine auraient tendance à induire ce type d’arythmies. • traitement L’attitude à avoir face à une bradycardie consiste, dans un premier temps, à diminuer la profondeur de l'anesthésie et à rechercher la cause sous jacente pour la traiter. Selon BERNARDE, dans 80% des cas de bradycardies sinusales (FC < 100 chez le chien), l’arrêt de l’anesthésie gazeuse, pendant quelques minutes, suffit à renverser le processus cardio-modérateur (5). Parallèlement, la lutte contre l’hypovolémie nécessite la perfusion de solutés hydroélectriques au rythme de 10-20 ml / kg / h voire 80 ml / kg / h, tant que le pouls périphérique et le temps de recoloration capillaire n’ont pas retrouvé de valeurs normales. Un traitement pharmacologique spécifique doit être instauré si la FC diminue en deçà de 65 pulsations par minute, chez le chien (5). En premier lieu, on a recours aux vagolytiques. Le sulfate d’atropine, administré en embol intraveineux à la dose de 0,030,05 mg / kg, exerce un effet chronotrope positif pendant 15 à 30 minutes. L’injection est répétée au bout de 2 minutes, à la même dose, si l’effet est jugé insuffisant ou nul. Le glycopyrrolate, injecté à la dose de 0,015 mg / kg IV, à un effet chronotrope positif plus tardif mais de plus longue durée. En cas d’échec, du à une dépression orthosympathique, on utilise les catécholamines qui regroupent l’adrénaline, la noradrénaline, la dobutamine, la dopamine. Parmi celles ci, on préfère la moins arythmogène, à savoir la dopamine, en perfusion à la dose de 5 µg / kg / h diluée dans du glucose à 5%. Son incompatibilité avec les solutés alcalins interdit l’utilisation du Ringer-Lactate. A cette dose, l’action dopaminergique produit des effets inotrope et chronotrope positifs ainsi qu’une vasodilatation des vaisseaux coronaires, mésentériques et rénaux. En cas de surdosage, les effets vasoconstricteurs sont dominants (5). Dans le cas particuliers de BAV 3, le recours à l’isoprénaline peut être salvateur. On l’administre également en perfusion continue à la dose de 0,3-0,8 µg / kg / min : 5 ampoules d’Isuprel dans 250 ml de sérum glucosé à 5%, 1 à 3 gouttes par seconde. La voie sous cutanée reste une voie d’exception mais peut permettre d’attendre la pose de la perfusion si cela n’a pas été déjà fait. Le traitement de choix demeure l’entraînement électrosystolique (5, 97). Une prudence particulière doit être observée en ce qui concerne les déséquilibres acidobasique et hydro-électrolytique du patient. En cas d’acidose ou d’hyperkaliémie, avérée par l’analyse biochimique, on traite spécifiquement ces déséquilibres en accordant la priorité à la correction de l’acidose. Une fois corrigée, celle ci peut permettre de réguler la kaliémie. En revanche, si de tels déséquilibres sont suspectés mais non prouvés, il convient de ne pas se lancer dans des corrections hasardeuses (5). Enfin, un massage cardiaque externe doit être 138 c - les tachycardies • étiologie Les causes de stimulation de l’activité électrique atriale ou ventriculaire incluent le relargage endogène de catécholamines secondaire à un stress ou un apport exogène, l’hypoxie ou l’hypercapnie, l’hypovolémie et l’hypotension l’augmentation de la sensibilité aux catécholamines ( anesthésiques volatils, xylazine, thiopental ), une myocardite ou une stimulation du myocarde par un cathéter central, une insuffisance cardiaque congestive ou hypertrophique, l’hyperkaliémie (potentialisée par l’acidose, l’hypocalcémie ou la succinylcholine ), l’hypokaliémie ( potentialisée par l’alcalose, le glucose et insuline ), la toxicité des digitaliques ( potentialisée par l’hypokaliémie et l’hypercalcémie ), une augmentation de la pression intracrânienne ou l’hyperthermie • tachycardie sinusale et tachyarythmies supraventriculaires En dehors des cas de myocardites traumatiques ou de cardiomyopathie, les tachycardies supraventriculaires, au sens large, incluant la fibrillation atriale, apparaissent le plus souvent à la faveur d’une anesthésie trop superficielle. En règle générale, ces affections n’ont pas de répercussions hémodynamiques majeures (5). La fibrillation atriale (FA) est une tachycardie rapide et irrégulière, les tachycardies supraventriculaires paroxystiques (TSVP) sont très rapides (> 200 bpm) et régulières (la manœuvre vagale peut être un outil utile afin de diagnostiquer voire traiter les TSVP) (90). Le traitement des tachycardies supraventriculaires consiste à arrêter temporairement les manipulations chirurgicales, à renforcer la profondeur de l’anesthésie et le cas échéant, à arrêter l’administration de substances chronotropes (5). Le traitement de la FA peropératoire passe par l’injection IV de quinidine sur 10 minutes à la dose de 4-8 mg / kg (à long terme on emploie une combinaison de différents agents parmi la digoxine, l’aténolol et le diltiazem) (90). Le traitement de la TSVP requiert l’injection d’adénosine en IV à la dose de 05 mg / kg ou d’esmolol à la dose de 0.5 mg / kg, ce dernier peut aussi être utilisé en perfusion au rythme de 15-25 µg / kg /minute (la thérapeutique à long terme utilise la procaïnamide, les β bloquants : aténolol, propranolol ; le diltiazem ou la vérapamil) (90). Si la FC reste élevée, malgré tout, on peut recourir au propranolol en injection IV lente à la dose de 0,04-0,06 mg / kg, avec des réserves pour l’animal anesthésié en raison de son effet inotrope négatif. Le propranolol peut également accroître les résistances respiratoires (les β bloquants sont à éviter lors de bronchospasmes) (5). • tachycardie et tachyarythmies ventriculaires Leur tolérance hémodynamique est très mauvaise et elles représentent une urgence véritable (29). L’extrasystole ventriculaire (ESV) est caractérisée par des complexes qRs prématurés et anormaux, non précédés d’onde P (rythme non sinusal). Les ESV peuvent être isolées, groupées par paires ou en salves plus ou moins longues (on parle alors de tachycardie paroxystique) avant de mener à la fibrillation ventriculaire. Les causes les plus fréquentes sont : - l’élévation du taux de catécholamines circulantes (douleur, excitation avant l’induction, intubation endotrachéale traumatique, hypercapnie, administration de dopamine, dobutamine ou adrénaline, manipulation chirurgicale du cœur, hyperthermie, phéochromocytome) 139 - l’augmentation de la sensibilité du myocarde aux catécholamines en cas de cardiopathie ou sous l’effet d’agents anesthésiques, notamment le thiopental sodique ou l’halothane Le traitement consiste à contrôler la profondeur de l’anesthésie, supplémenter en 02 et au besoin instaurer une respiration assistée. Parallèlement, le maintien de la pression artérielle et de la perfusion tissulaire nécessite d’accentuer la fluidothérapie. L’acidose métabolique, prouvée, doit être corrigée. Si les ESV sont nombreuses ( > 15 par minute ), si elles sont regroupées par paires ou en salves paroxystiques ou si elles sont polymorphes ( qRs de différentes morphologies sur un même tracé indiquant plusieurs sites ectopiques ), on a recours à des agents antiarythmiques spécifiques . La lidocaïne, ou la xylocaïne, est utilisée à la dose de 2 mg / kg en embol IV. L’effet antiarythmique apparaît dans les minutes qui suivent, pour une durée inférieure à 10 minutes, 140 figure 28 : conduite à tenir face à un arrêt cardiaque Absence de pouls fémoral ou choc précordial, Apnée, plus de tonus musculaire, cyanose ou muqueuse anémique Arrêt cardiaque confirmé Fluidothérapie 50-80 ml/kg/h Adrénaline 200 µg/kg ECG Arrêt de l’anesthésie Massage cardiaque externe Libération des voies aériennes et mise en place de la ventilation assistée Pas de pouls Massage cardiaque externe Pas de pouls Fibrillation ventriculaire Asystolie Adrénaline Défibrillation Déxaméthasone électrique ou 3-5 mg/kg lidocaïne 2 Isoprénaline mg/kg Atropine 50 µg/kg DEM Préparation chirurgicale Massage cardiaque interne 80100 bpm Adrénaline Pouls palpable ESV Hypotension Bradycardie Lidocaïne 0.5 Dobutamine Atropine, µg/kg IV 1.5 µg/kg/min adrénaline et IV /ou dopamine D’après HERVE D (39) 141 laquelle peut suffire à corriger la cause initiale. L’administration de la même dose peut être réitérée toutes les 8-10 minutes à concurrence maximale de 8 mg / kg, chez le chien (5, 104). La concentration sérique en lidocaïne peut être maintenue par un relais en perfusion, à la dose de 0,04-0,08 mg / kg / min. La dilution de 12 ml de xylocaïne à 2% dans un flacon de 250 ml de sérum glucosé à 5% permet d’obtenir 1 mg / ml (5, 104). Si la lidocaïne n’apporte aucun bénéfice, il faut rechercher systématiquement une hypokaliémie (5). Il est possible de faire appel à la flécaïnamide par voie IV (5, 97). Il convient, dans ce cas dans changer l’halothane pour de l’isoflurane, moins arythmogène. Ce dernier pourrait supprimer les arythmies ventriculaires engendrées sous halothane, qui ne rétrocèdent pas à la réduction de la profondeur de l’anesthésie ni à l’oxygénation, pas plus qu’aux antiarythmiques spécifiques. Rem : le traitement à long terme des tachycardies ventriculaires peut faire appel à la procaïnamide 38 mg / kg / 8 h ou de tocaïnide 5-10 mg / kg / 8-12 h, en prise orale (83). Les épisodes de tachycardie ventriculaire sont à prendre au sérieux car elle peut précipiter le patient vers la fibrillation ventriculaire qui est une cause de l’arrêt cardiaque. II. C. 2 - L’arrêt cardiaque a - étiologie Qu’il soit antérieur ou postérieur à un arrêt respiratoire, l’arrêt cardiaque est une défaillance circulatoire aiguë qui aboutit à une incompétence hémodynamique totale (39). Les facteurs qui conduisent à l’apparition de ce type d’accident sont multiples et souvent associés. On note : - hypoxie cellulaire d’origine cardiaque ou extra-cardiaque (insuffisance respiratoire, anémie sévère, vasoconstriction) - désamorçage par effondrement du retour veineux (hémorragie), compression de la veine cave caudale, ou surpression intrathoracique - action des agents anesthésiques avec hypotension, brady-tachyarythmies, action inotrope négative - exagération des réponses du système nerveux autonome : troubles d’hyperexcitabilité en cas de douleur intense par relargage de catécholamines, à l’inverse, une stimulation vagale excessive va induire une bradycardie extrême lors de manipulations intempestives - troubles acido-basiques et hydroélectrolytiques : hyper et hypocalcémie, hypokaliémie et acidose - hypothermie - toxines : hyperazotémie, endotoxine de certains sepsis - anomalie physique : tamponnade, obstacle à l’éjection systolique Cette suppression brutale de toute perfusion induit un choc cardiogénique avec une chute brutale puis progressive de la pression artérielle, une égalisation des pressions intracardiaques et une augmentation de la PVC, une anoxie cellulaire aiguë particulièrement grave pour le tissu cérébral et une acidose métabolique (5, 39, 72, 83) 142 b - gestes thérapeutiques Les gestes thérapeutiques consistent à réanimer un animal en état de mort apparente selon un protocole précis de différents actes tant dans leur réalisation que dans leur chronologie (figure 28). 3 étapes successives obligatoires sont à effectuer : • suppléance des fonctions vitales l’animal présente un tableau complet de mort apparente : - absence de pouls perceptible, soit une pression systolique < 60 mmHg - absence de choc précordial (pression intracardiaque < 50 mmHg) 143 - mydriase aréflective (entre 20 à 45 secondes après l’arrêt) - absence de respiration spontanée L’horaire de l’accident doit être noté (To) .Les meilleurs résultats sont obtenus lorsque le protocole est mis en route moins de 4 minutes après la survenue de l’arrêt (5, 39, 83). c assistance respiratoire Dès que le contrôle des voies aériennes est effectué, il convient de mettre aussitôt en route une assistance respiratoire par intubation endotrachéale avec insufflation au ballon en l’absence de circuit respiratoire ou de respirateur, l’idéal étant une ventilation contrôlée mécaniquement (15-25 insufflations par minute) avec de l’02 pur à fort débit (150 ml/kg) (27, 39, 83). On procède, alors, à 4 insufflations profondes et rapprochées et on confirme l’absence de pouls, de choc précordial, signes de l’arrêt circulatoire. d assistance circulatoire - massage cardiaque externe Si aucune pulsation de l’artère fémorale n’est notée, un massage cardiaque externe est entrepris pour assurer l’assistance circulatoire. Il a pour but de suppléer les contractions cardiaques en assurant un débit minimum dans les lits coronaire et vasculaire cérébral. Si deux personnes s’occupent de l’animal, l’assistance respiratoire est fondamentale et prioritaire dans le protocole En revanche, si une seule personne intervient, le massage cardiaque externe est prioritaire (39, 72, 83). Pour un poids de moins de 10 kg, le patient est placé en décubitus latéral droit sur une surface plane et dure avec une contre pression au niveau du thorax droit (linges pliés, poing fermé). La pression est exercée en regard de l’aire cardiaque gauche, entre le 3ème et le 6ème espace intercostal, à l’aide du poig ou du talon de la main. Le rythme est de pression / relâchement est de 1 / 1, le relâchement est brusque pour faciliter le retour veineux .La fréquence est de 80-100 pression / minute (39, 72, 83). Pour des animaux plus lourds (>10 kg), le décubitus dorsal est préféré et la compression exercée de façon sterno-dorsale, ceci n’étant pas toujours chose aisée. Une compression abdominale constante peut également être maintenue et améliore l’hémodynamique (perfusion coronaire et cérébrale) (27, 39). Dans tous les cas, pour qu’il y ait un minimum d’efficacité, la dépression du diamètre thoracique doit être d’au moins un quart, voire un tiers. La compression est simultanée à l’insufflation d’02 afin d’augmenter de façon brutale et importante la pression intrathoracique. La dépression respiratoire doit être nette pour maintenir un gradient élevé entre les circulations veineuses extra et intrathoracique. Ce gradient conditionne les débits capillaires au niveau pulmonaire, cardiaque et cérébral (39). Ce massage cardiaque externe contribue, au mieux, à apporter 5-15 % du débit normal (39). Selon HERVE, cette manœuvre serait suffisante pour assurer une oxygénation minimale des centres nerveux. Cependant, d’autres auteurs suggèrent qu’au bout de quelques minutes infructueuses le massage externe doit être interrompu au bénéfice du massage interne (27, 83). Quoiqu’il en soit le massage doit être accompagné du pulsation fémorale qui permet de s’assurer de la présence d’une ondée sanguine, donc de l’efficacite, somme toute relative, de la manœuvre ( pulsation perceptible > 50 mmHg ) (5, 39). 144 - massage cardiaque interne Il est indiqué lors de l’absence de réponse au massage externe, lors d’un épanchement pleural et/ou péricardique, de lésions des parois thoraciques ou chez un animal obèse. L’ouverture du thorax se fait après une préparation chirurgicale sommaire, au niveau du 5ème espace intercostal gauche, en évitant de léser les vaisseaux ou les nerfs. Le sac péricardique est incisé le long du nerf phrénique. Les avantages, par rapport au massage externe, sont substantiels : visualisation du cœur et sensation du rythme (cœur flasque ou tonique, accès direct des palettes de défibrillation), drainage éventuel de la cavité thoracique (39). La réanimation à thorax ouvert permet aussi d’améliorer les pressions systolique, diastolique et moyenne ainsi que la pression de perfusion coronarienne (avec un meilleur taux de défibrillation car celle ci en est un facteur déterminant (69)), le flux sanguin artériel carotidien et le taux de survie par rapport à la technique à thorax fermé. La perfusion tissulaire est suffisante pour diminuer les répercussions néfastes sur le statut acidobasique (69). En effet, le massage interne offre une suppléance de l’ordre de 50-70% du débit (5). Les inconvénients sont cependant plus lourds avec, notamment, une interruption de toutes les procédures de réanimation lors de l’abord chirurgical, l’obligation d’être en contexte chirurgical, les risques de lésions iatrogènes et surtout les risques septiques majorés (5, 35). • relance des fonctions vitales c perfusion de solutés et administration des substances thérapeutiques - voie d’abord La perfusion des médicaments et des solutés utilise l’abord veineux. La veine céphalique (ou mieux, la veine cave grâce à un cathéter central) est préférée aux veines caudales en raison du volume de la veine cave qui joue le rôle de réservoir. L’impossibilité de réaliser un abord veineux correct peut amener à utiliser la voie intratrachéale (5, 27, 35, 39, 83). Les posologies sont alors multipliées par un facteur 10 (atropine et adrénaline en particulier). La voie intra-osseuse est également utilisée pour les injections massives, impossibles par une autre voie (39). - solutés Du Ringer Lactate est utilisé comme « véhicule » (20-50 ml /kg) pour pousser ou convoyer les substances administrées. Aucun autre n’est employé à ce moment, le glucose est producteur de radicaux libres et d’acide lactique, et les bicarbonates peuvent induire une alcalose (39). L’injection de solutés macromoléculaires est effectuée en cas d’hypovolémie, uniquement et à raison de 20 ml / kg. - adrénaline L’administration d’adrénaline est fondamentale à la dose de 200 µg / kg avant même de faire un diagnostic rythmologique (5, 39). En effet, son action α agoniste augmente les résistances vasculaires périphériques sans, toutefois, provoquer de vasoconstriction des territoires cérébral et coronaire (39), et s’oppose à la vasoplégie secondaire à l’anoxie des centres vasomoteurs (5). 145 Elle améliore les pressions systolique et diastolique au cours du massage cardiaque et, corrélativement, le débit sanguin cérébral et coronarien. Son action β favorise la réapparition de l’activité cardiaque (5), ses effets inotrope et chronotrope positifs joue un rôle important dans la reprise des contractions spontanées (39). La voie intracardiaque est à éviter, il y aurait alors davantage de risques de transformer l’asystolie en fibrillation ventriculaire, d’endommager les voies de conduction cardiaque et de provoquer des lésions myocardiques ou coronaires (5). L’adrénaline est préférée à l’isoprénaline qui est dépourvue d’action α . L’épinéphrine est utilisée à la dose de 0,1 mg / kg jusqu’à 10 kg avec ensuite un maximum de 1 mg en IV. d reconnaissance de la cause de l’arrêt et traitement spécifique Parallèlement, la recherche du trouble responsable de l’arrêt cardiaque est effectuée, dernière étape de la relance des fonctions vitales. Trois possibilités existent (5, 27, 35, 39, 83, 97). - l’asystolie ventriculaire Elle est caractérisée par une absence totale d’activité électrique ventriculaire, voire une absence de tout accident électrique. Le tracé électrocardiographique est plat . L’asystolie est toujours de très mauvais pronostic car elle fait souvent suite à un épisode de fibrillation ventriculaire. Les facteurs prédisposant à cette affection sont l’hyperkaliémie, l’acidose, l’hypoxie, les agents anesthésiques, les troubles électrolytiques et souvent une stimulation anormale et sévère du système vagal. C’est pourquoi, le traitement est basé sur l’utilisation d’adrénaline puis d’atropine à 50 µg / kg . Malgré cela, l’issue est souvent fatale. - la dissociation électro-mécanique Elle est caractérisée par l’association d’un ECG qui présente peu de perturbations et une absence totale de contraction ventriculaire. Elle serait plus courante que la fibrillation ventriculaire. Les causes incluent l’hypoxie myocardique, l’acidose respiratoire, l’hyperkaliémie, les anesthésiques, le propranolol et la quinidine (79). Le traitement est difficile et très incertain (39). De l’adrénaline est administrée malgré le rsique d’induction de fibrillation ventriculaire (39). De la déxaméthasone à forte dose (3-5 mg / kg) et de l’isoprotérénol (isoprénaline) à 50-100 µg / kg sont ensuite injectées (5, 39). L’isoprénaline est une catécholamine de synthèse qui possède des effets β1 et β2 non sélectifs. Son emploi, dans ce type d’accident, est justifié par ses propriétés dromotropes positives sur la conduction atrioventriculaire. L’utilisation de sels de calcium ( 10 mg / kg, à raison de 5 mg / kg / min (39, 72) ) est très discutée, actuellement, car ils majorent l’inflation calcique intracellulaire cérébrale (39). Pourtant, ils seraient souvent d’une bonne efficacité (5). - la fibrillation ventriculaire Elle se caractérise par une activité électrique totalement anarchique et désorganisée, avec absence de toute contraction efficace. Elle demande une défibrillation chimique ou électrique. La fibrillation se produit lorsque le cœur est irritable, en hypoxie, sensibilisé aux catécholamines ou malade. Les origines possibles sont l’hypoxie, les modifications électrolytiques notamment les troubles de la kaliémie et de la calcémie, les agents 146 anesthésiques, en particulier les anesthésiques volatils, les thiobarbituriques qui potentialisent fortement l’action arythmogène des catécholamines (39). L’injection d’adrénaline à 200 µg / kg, préconisée précédemment peut paraître surprenante. En effet, elle augmente les risques de fibrillation ventriculaire sur un cœur en anoxie. Cependant, elle transforme une fibrillation ventriculaire à mailles fines, où le cœur est totalement inefficace et flasque, en fibrillation à mailles larges où le cœur est tonique et sur lequel la lidocaïne ou le choc électrique donnent de meilleurs résultats (39, 72). De plus, après le retour à un rythme normal, l’adrénaline joue un rôle dans l’amélioration de la circulation (39). Le traitement par défibrillation électrique nécessite l’emploi d’un défibrillateur (rare en pratique vétérinaire). C’est un condensateur qui délivre une décharge de courant continu ou alternatif dans le but de resynchroniser les myocytes ventriculaires en activité anarchique Le niveau d’énergie désiré est réglé (2-5 J / kg, 1 Joule = 1 watt / sec) (27, 39). Les palettes sont mises en charge et sont lubrifiées avec un gel conducteur. Le massage est interrompu le temps de l’électrochoc. Les palettes sont fortement appuyées sur le thorax, la palette négative au creux axillaire droit et la positive à l’apex cardiaque gauche (39). Dès le retrait des électrodes, si le rythme cardiaque est nul, le massage est repris pendant 30 secondes. Les électrochocs sont renouvelés avec une intensité croissante (6-7-8 J / kg). La lidocaïne est administrée à la dose de 2 mg / kg. Son emploi repose sur ses capacités à bloquer les canaux sodiques rapides avec une diminution de la vitesse de propagation des ondes de dépolarisation, un allongement des durées des potentiels d’action et des périodes réfractaires effectives. Son efficacité réelle n’a cependant jamais été prouvée (39). La lidocaïne est un stabilisateur de membrane de la classe 1B de la classification de Vaugham-Williams. Si la dose initiale ne suffit pas, une ou plusieurs injections de 2 mg / kg, sans dépasser 8 mg / kg, sont effectuées (39). L’injection doit se réaliser sur 30 à 45 secondes, sous peine de provoquer d’éventuelles convulsions et vomissements. En cas d’ectopies ventriculaires fréquentes, pouvant mener de nouveau à une fibrillation ventriculaire, une perfusion de 50-100 µg / kg / min peut être mise en place. Un contrôle ECG est indispensable lors de cette perfusion, afin de prévenir d’éventuels blocs et/ou bradycardies délétères (39). Certains auteurs proposent l’injection de chlorure de potassium à 1 mEq / kg, associée à l’acétylcholine à 5 mg / kg (5, 39). L’efficacité est encore moins fiable que pour la lidocaïne, à priori. Les sels de brétylium, à 10 mg / kg, et le chlorure de calcium à 10 % ( 5-10 ml ) par voie IV ont été aussi utilisés (39). Tant que le rythme ne redevient pas sinusal, le massage cardiaque est poursuivi. La réanimation cardiaque doit être maintenue jusqu’à ce qu’un pouls fémoral soit perçu, qu’il soit de bonne ou de mauvaise qualité (régularité, fréquence et pression). Sa présence doit faire cesser tout massage sous peine de provoquer un nouvel arrêt (5, 39). Lors de la reprise de l’activité mécanique du cœur, si la fréquence est basse, il convient d’injecter de l’atropine à 0,02-0,05 mg / kg IV (58, 39, 70). Si cela se révèle inefficace, l’adrénaline est administrée à la dose de 0,1 µg / kg / min (70), la dobutamine ou la dopamine peuvent aussi être employées aux doses respectives de 1-5 µg / kg / min IV (27) et 5 µg / kg / min (5). Si la fréquence est supérieure à 180 147 bpm, il convient d’injecter de la lidocaïne (cf ventriculaires) . traitement des tachyarythmies Lorsque la systole mécanique et la fréquence cardiaque se normalisent, on administre de la dobutamine à 2,5 µg / kg / min IV (soit 250 mg dans 1000 ml de glucose 5 % et administrer 1 goutte / kg / min avec un microperfuseur) (70). e quand est-il nécessaire d’abandonner ? Ce sont les séquelles neurologiques et l’état général de l’animal qui déterminent le pronostic. Il convient de cesser la réanimation : - au bout de 10 à 12 minutes sans résultat sur un animal en bonne santé - au bout de 6 à 8 minutes sur un animal en mauvais état général préalable Dans la majorité des cas, la situation se clarifie en 5 à 6 minutes de soins (5, 39, 72). 148 • la réanimation complémentaire c premières mesures - assistance respiratoire Elle est maintenue tant que l’animal ne récupère pas une respiration spontanée, stable et précoce. Cette condition est fondamentale afin d’éviter toute hypoxie pulmonaire à l’origine d’anaérobie cellulaire et d’une acidose métabolique. Le retrait de la sonde est effectué dès la reprise des réflexes laryngés. Cependant, une sonde naso-trachéale est posée ou, si la taille de l’animal le permet, on le maintient dans une enceinte confinée et oxygénée. Le décubitus latéral est la meilleure position afin d’améliorer le rapport ventilation / perfusion. L’animal est retourné toutes les 2 heures. La PaC02 est maintenue entre 25 et 35 mmHg pour éviter l’œdème cérébral, et la Pa02 doit se situer à environ 100 mmHg (39). - correction de l’acidose L’alcalinisation n’est jamais systématique, mais est fonction de la durée de l’arrêt circulatoire et des déséquilibres acido-basiques qui en découlent. Si l’arrêt n’excède pas 2 minutes, rien n’est entrepris car les mécanismes compensateurs suffisent. Après un arrêt de l’ordre de 5 minutes, des bicarbonates sont administrés : une injection (1 mEq / kg) en 5 minutes (39, 72), celle ci est renouvelée, à la dose de 0.5 mEq / kg toutes les 15 minutes en fonction des résultats d’analyse (HC03- : 20-25 mmol / l et Cl- : 105 mmol / l) (39). - prévention de l’œdème cérébral et rétablissement de la diurèse Pour lutter contre l’œdème et rétablir la diurèse, du mannitol est injecté à une dose de 1-1.5 g / kg, sur la base de 0.5 g / kg / h. L’objectif est d’obtenir une diurèse horaire de 2 ml / kg / h. A défaut de mannitol, le furosémide peut être utilisé (39, 72). - prévention d’une CIVD Celle ci fait appel à l’héparine (100 UI / kg toutes les 4 heures), aux corticoïdes (méthylprednisolone à 10 mg / kg, déxaméthasone à 0.5 mg / kg) et une transfusion de sang total peut, éventuellement, être effectuée. L’emploi des corticoïdes est conseillé car ils limitent la production de radicaux libres (issus de la destruction des membranes cellulaires). A cette fin, on peut utiliser le DMSO (500 mg / kg IV 30 minutes après la fin de la réanimation), le vérapamil (0,1 mg / kg IV lentement 30 minutes après la fin de la réanimation), l’allopurinol (10 mg / kg PO, 3 fois par jour) ou les vitamines C et E (1g PO 6 fois par jour ou 2g PO 2 fois par jour) (70). - correction de la volémie L’hypovolémie est compensée par des albumines fluidifiées à 10 % à raison de 5-6 ml / kg, au rythme de 1,5-2 ml / kg / min (39). d la surveillance ultérieure Elle exige : - des contrôles ECG, respiratoire et des pressions systémiques - une surveillance de la diurèse - une surveillance de la température, en particulier chez les petits animaux 149 - une surveillance du statut acido-basique une surveillance et le traitement d’éventuelles crises convulsives (valium 0,1-0,3 mg / kg) qui signent une atteinte neurologique grave et de mauvais pronostic. L’arrêt cardiaque, même s’il est dramatique, demande un traitement logique qui donne au mieux une issue favorable dans 10 à 20 % des cas. Il est obligatoire d’évaluer objectivement l’efficacité, ou l’inefficacité, de la thérapeutique pour décider de l’abandon ou de la poursuite de la réanimation sans acharnement inutile. III - LES SUBSTANCES CARDIAQUE UTILISEES CONTRE L’INSTABILITE III. A - LES ANTIARYTHMIQUES III. A. 1 - Substances luttant contre les tachyarythmies Les substances, employées en vue de traiter les dysrythmies ventriculaires et supraventriculaires, sont divisées en différentes classes suivant leur mécanisme d’action. Les antiarythmiques exercent leurs effets en bloquant les canaux sodiques, potassiques, calciques ou les récepteurs β adrénergiques cardiaques (60). a - la lidocaïne • action C’est un agent de la classe Ib. Elle est utilisée aussi pour l’anesthésie loco-régionale. Elle n’est pas employée lors de tachyarythmie atriale mais trouve toute son utilité dans les cas d’arythmies ventriculaire ou de tachycardie par phénomène de réentrée (60). Elle diminue la vitesse de conduction de l’influx électriqueet augmente la période réfractaire des cellules cardiaques. L’action cellulaire de la lidocaïne dépend de la concentration intracellulaire en potassium. Lorsque le potentiel de repos membranaire diminue (comme lors d’une augmentation de la [ K+] intracellulaire ) la lidocaïne agit en supprimant l’activité des canaux sodiques rapides, comme la quinidine et la procaïnamide. La lidocaïne a un effet plus marqué sur l’automaticité, la vitesse de conduction et la période réfractaire de cellules endommagées que de cellules intègres. Elle peut induire une hyperpolarisation des cellules partiellement dépolarisées et ainsi améliorer la conduction dans une région endommagée du myocarde (60). Lors de tachyarythmie spontanée, l’hyperpolarisation, induite par la lidocaïne, permet de supprimer ces arythmies. • indications cliniques La lidocaïne est employée dans le traitement des tachyarythmies ventriculaires. Elle n’est, cependant, pas efficace dans la prévention de ces accidents. En effet, elle n’empêche pas l’apparition de tachycardie ventriculaire induite par une injection d’adrénaline (52). Sa rapidité d’action, son efficacité, sa sécurité d’emploi et sa durée de demi-vie courte (90-100 minutes) font de celle ci un agent idéal dans le traitement d’accidents aigus. 150 Elle n’affecte aucunement les tachyarythmies supraventriculaires et, du fait de l’allongement de la durée de dépolarisation se traduisant par une diminution du rythme d’échappement, la lidocaïne est à éviter lors de BAV 3 (60). On l’injecte en bolus de 2-4 mg / kg IV, administré sur 1 à 3 minutes suivie éventuellement par un relais en perfusion (25-100 µg / kg / min) . • toxicité Elle peut avoir des effets sur le SNC se traduisant par des vomissement, un nystagmus, des fasciculations musculaires, des crises convulsives, et pouvant nécessiter l’emploi de valium ( 0,25-0,5 mg / kg IV ) . La lidocaïne peut aussi avoir un effet dépresseur sur la fonction ventriculaire lors d’insuffisance sévère du myocarde, produire des BAV lors d’atteinte du système de conduction, exacerber la bradycardie sinusale et provoquer un arrêt chez les patients souffrant d’un sick sinus syndrome (60). b - la quinidine C’est un isomère de la quinine. Ce n’est pas avant 1918 que la quinidine est reconnue comme agent efficace dans le traitement de la fibrillation atriale chez l’homme. • action C’est un antiarythmique de la classe Ia efficace dans les cas de tachyarythmies ventriculaires et supraventriculaires chez le chien (60). Son action principale se résume à diminuer le mouvement des ions Na+ dans la chaîne Na dépendante au cours de la phase d’initiation de la dépolarisation (phase 0). Ceci se solde par diminution de la vitesse de conduction et de l’initiation du potentiel d’action. Cet effet est amplifié lorsque la [K+] extracellulaire est augmentée, du fait de la diminution du potentiel de repos membranaire (60). La quinidine prolonge la période réfractaire atriale, ventriculaire et des fibres de Purkinje ce qui peut effectivement interrompre tout phénomène de réentrée. Elle supprime l’automaticité des fibres de Purkinje et l’excitabilité cardiaque en augmentant le seuil de fibrillation. L’automaticité du nœud sinusal reste inchangée et peut même être stimulée du fait de la diminution du tonus vagal (effet vagolytique de la quinidine) (60). • indications cliniques Elle est employée dans le traitement à long terme de dépolarisations ventriculaires prématurées et de tachyarythmies ventriculaires (demi-vie de 5-6 heures chez le chien). Cependant, elle peut être administrée lors d’épisodes aigus de tachyarythmies ventriculaires et se montre efficace dans le contrôle d’extrasystoles supraventriculaires et de tachycardies supraventriculaires paroxystiques (60). Dans ce cas, une dose de 5-10 mg / kg IV est injectée mais lentement. Si l’injection est trop brusque, on risque une hypotension (c’est pourquoi on préfère la lidocaïne ou la procaïnamide en IV). En relais Per Os, la dose est de 6-16 mg / kg. • toxicité La quinidine déplace la digoxine de ses sites de fixation et réduit sa clearance rénale se soldant par une augmentation de la concentration sérique de la digoxine voire l’apparition de signes d’intoxication aux digitaliques (vomissements). Sa concentration cérébrale augmente de 50 % lors d’administration de quinidine tandis que la concentration dans le reste du corps diminue (notamment au niveau du myocarde, donc pas de toxicité cardiovasculaire) (60). 151 Le plus important problème (cependant rare) est le développement d’une insuffisance cardiaque du à l’effet intrope négatif de la quinidine. En général, son emploi est à éviter chez le chien souffrant d’une atteinte cardiaque déjà avancée (60). 152 c - la procaïnamide • action C’est un antiarythmique de classe Ia dont les propriétés sont très semblables à la quinidine. La procaïnamide diminue l’excitabilité et la vitesse de conduction de l’influx électrique. Ses effets sont amplifiés lors de l’augmentation de la [ K+] extracellulaire. La procaïnamide accroît le seuil du potentiel de dépolarisation vers des valeurs plus positives, ce qui réduit l’excitabilité du tissu cardiaque, et augmente la durée de repolarisation (60). Cet effet devrait théoriquement majorer le seuil de fibrillation et faire de la procaïnamide un agent efficace dans la lutte contre la fibrillation ventriculaire, mais ceci ne semble pas être le cas selon la clinique humaine et vétérinaire (60). • indications cliniques La procaïnamide est efficace dans le traitement des tachyarythmies ventriculaires et peut l’être dans certaines tachyarythmies supraventriculaires. Elle ne semble pas être utile dans la prévention de mort subite chez les patients atteints de maladies cardiaques décompensées. Elle peut même s’avérer être proarythmique. Par conséquent, elle sera évitée chez les pinschers et boxers atteints de CMD ou chez le chien souffrant de sténose aortique (60). Généralement, la procaïnamide est employée dans le cas où la lidocaïne se montre inefficace. Pour une administration IV de procaïnamide, des bolus répétés de 2-4 mg /kg peuvent être injectés mais lentement (2 minutes) pour un maximum de 12-20 mg / kg jusqu’à ce que l’arythmie soit contrôlée. Une perfusion de 10-40 µg / kg /min peut prendre le relais. L’administration par voie orale (dans le traitement à long terme) réclame des doses non encore établies avec précision. Des doses de 8-20 mg / kg / 6-8 h (du fait de la durée de demi-vie courte : 3h) restent encore trop faible (aujourd’hui, la dose est de 30 mg / kg / 6h) (60). Le fait qu’elle soit plus efficace chez l’homme vient du fait qu’il la métabolise en Nacétylprocaïnamide à activité antiarythmique ce que le chien ne fait pas. • toxicité Elle est surtout cardiaque avec une augmentation de la durée du qRs et de l’intervalle qT cependant ceci n’a jamais été observé en clinique (60). Chez certains patients humains, la procaïnamide est proarythmique et bien que n’ayant pas été observé chez le chien, cet effet est tout de même suspecté. Une injection trop rapide peut engendrer un collapsus vasculaire du fait de la vasodilatation périphérique et d’une diminution de la contractilité du myocarde avec son corollaire d’hypotension (60). d - les β bloquants 3 types de récepteurs sont présents dans le corps. Les β1 sont localisés dans le cœur et le tissu adipeux. Leur stimulation se solde par une augmentation de la FC, de la contractilité du myocarde, de la vitesse de conduction atrioventriculaire et de l’automaticité des pacemakers subsidiaires (60). 153 Les β2 sont localisés dans les muscles lisses vasculaires et bronchiques et leur stimulation induit une relaxation. Cependant, on les trouve également dans le tissu sinusal et atrioventriculaire où ils contribuent à l’augmentation de la FC et de la vitesse de conduction, et dans le myocarde où ils stimulent la contractilité (ils sont également présents dans le rein et le pancréas comme médiateur du relargage de rénine et d’insuline) (60). Les β3 ont été récemment découverts et auraient un effet dépresseur sur le cœur (60). Les β bloquants les plus utilisés en médecine vétérinaire sont le propanolol et l’aténolol. Le propranolol est un β bloquant non sélectif alors que l’aténolol est uniquement un β1 bloquant. L’esmolol est un β bloquant à durée de demi-vie très courte, utilisé dans le contrôle à court terme des arythmies. • le propranolol C’est le prototype des β bloquants. Son effet antiarythmique dépend de la capacité à bloquer la stimulation adrénergique (9, 60). Il diminue le rythme automatique dépendant des catécholamines et ralentit la conduction dans le tissu nodal atrioventriculaire et dans le myocarde endommagé et rallonge la période réfractaire (49, 60). Ceci diminue la réponse ventriculaire lors de fibrillation ou de flutter atrial et abolit efficacement les arythmies supraventriculaires résultant de phénomènes de réentrée au niveau du nœud atrioventriculaire (49, 60). En réduisant la contractilité, le propranolol diminue la consommation du myocarde en 02, ainsi améliore un éventuel état d’hypoxie myocardique et la formation d’arythmie n’en est que plus prévenue. Il est utilisé lors de tachyarythmies ventriculaires et supraventriculaires et communément en combinaison avec la digoxine afin de ralentir le rythme ventriculaire chez le patient présentant une fibrillation atriale (9, 60). Il est efficace dans le traitement et la prévention des tachycardies supraventriculaires, et utilisé seul, il peut se montrer intéressant lors de tachycardie ventriculaire bien qu’il soit plus efficace combiné à d’autres antiarythmiques (60). Les β bloquants sont à utiliser avec précaution chez l’insuffisant cardiaque. En effet, chez ces derniers, le nombre de récepteurs β diminue par le phénomène d’internalisation. Chez ces patients, il y a nettement moins de récepteurs à bloquer. Cependant, ils dépendent de cette stimulation β afin de garder une bonne contractilité du myocarde. L’injection d’une dose moyenne ou élevée de β bloquants, dans ce cas, pourrait se révéler désastreuses pour la FC et les performances cardiaques (9, 49, 60). Le propranolol, injecté à la dose de 0,02mg / kg IV (équivalent à 0,2 mg / kg PO) ne semble pas induire de modifications cardiaques ou hémodynamiques. Une dose de 0,08 mg / kg IV (équivalent à 0,5 mg / kg PO) diminue dP/dT (un indice de la contractilité) de prés de 30%. Le propranolol n’a pas d’effet puissant sur la résistance vasculaire périphérique, chez le chien sain. A la dose de 0,02 mg / kg IV, la résistance est pratiquement doublée et par la suite, si la dose augmente, il n’y a plus d’augmentation (60). Ces effets n’ont pas été testés chez le malade cardiaque mais il apparaît que ces agents sont à éviter, ou tout au moins à faible dose, dans le cas d’insuffisance mitrale modérée à sévère ( on préférera utiliser les digitaliques ou le calcium ) (60). 154 • l’aténolol C’est un β1 bloquant .Il a les mêmes potentialités que le propranolol. Il a une durée de demi-vie de 5-6 heures et est éliminé en grande partie inchangé dans les urines et sa biodisponibilité est de 80 %. On l’emploie fréquemment en combinaison avec la digoxine afin de diminuer la FC dans le cas de fibrillation atriale. On l’emploie aussi lors de tachycardie supraventriculaire ou tachyarythmie ventriculaire (60). Il est recommandé dans le traitement au long cours de la fibrillation atriale ou des tachycardies supraventriculaires paroxystiques à la dose de 6,25-50 mg / animal / 12h PO. Les doses IV ne sont pas connues chez le chien ni chez le chat (60). • l’esmolol C’est un β1 bloquant à durée d’action très courte, sa demi-vie est de moins de10 minutes. Il est utilisé uniquement en IV, en bolus de 0,25-0,5 mg / kg puis en perfusion de 10-00 µg /kg. Il est rapidement hydrolysé par l’estérase des cellules sanguines (GR). Le métabolite majeur de l’esmolol, le ASL 8123, à durée de demi-vie de 2,1 heures, est 1500 fois plus actif sur les récepteurs β que l’esmolol (60). Son action bloquante intervient dans les 10 à 20 minutes suivant la mise en place de la perfusion, elle est plus rapide après un bolus, puis disparaît dans les 20 minutes. L’esmolol diminue la fréquence du nœud sinusal (c’est pourquoi il est recommandé en cas de TSVP ou de FA). Une perfusion de l’ordre de 25 µg / kg / min réduit de 30 % l’effet tachycardisant de l’isoprotérénol. Cette valeur monte jusqu’à 60 % pour un rythme de perfusion de 50 µg / kg / min et approximativement 70 % pour 100 µg / kg / min (60). L’esmolol diminue aussi la contractilité myocardique. Chez le chien en parfaite santé, une perfusion de 10 µg / kg / min ne modifie pas dP/dT alors qu’un rythme de 40 µg / kg / min le diminue de 30 % et à 160 µg / kg / min, le dP/dT diminue de 50 % (60). Du fait de son action spécifique sur les récepteurs β1, l’esmolol ne modifie pas la résistance vasculaire périphérique. Chez le chien présentant une régurgitation mitrale sévère, il est recommandé de ne pas injecter de bolus mais d’employer uniquement une perfusion de 10-20 µg / kg / min (60). e - brétylium et amiodarone Ce sont des antiarythmiques de classe III qui rallonge la durée de la période réfractaire et ainsi sont capables d’atténuer voire stopper la fibrillation ventriculaire due à des phénomènes de réentrée (60). • l’amiodarone Le temps nécessaire à atteindre la moitié de la concentration maximum, chez le chien, permettant une action significative sur les arythmies, est de 2,5 jours pour l’amiodarone. C’est pourquoi elle n’est pas intéressante dans le traitement d’accidents cardiaques peropératoires (60). • le brétylium Il est utilisé, lui, dans le traitement d’urgence des tachycardies et fibrillation ventriculaires qui ne rétrocèdent pas au massage et à la lidocaïne. Il n’est, généralement, pas efficace contre les arythmies supraventriculaires (60). 155 L’effet principal de cet agent est l’augmentation de la durée du potentiel d’action et de la période réfractaire du myocarde. Il atténue, également, les disparités de potentiels d’action entre les tissus sains et lésés (60). Le brétylium est pris en charge et s’accumule dans les terminaisons nerveuses adrénergiques. Ceci se solde, initialement, par un relargage de norépinéphrine et d’un bref effet sympathomimétique puis il y a inhibition du relargage de ce même neurotransmetteur. L’augmentation de la durée du potentiel d’action et de la période réfractaire des tissus atrial, ventriculaire et des fibres de Purkinje induit une majoration du seuil de fibrillation. Le brétylium produit alors un effet biphasique avec, dans les 10 à 15 premières minutes, une augmentation du rythme sinusal, de la contractilité myocardique et de la pression artérielle puis une diminution des tous ces paramètres corrélée à la diminution du tonus sympathique. Cet effet anti-adrénergique prolonge aussi le temps de conduction chez le chien (60). La durée de demi-vie est de 16 heures. Cependant, la concentration plasmatique décline rapidement après une injection IV. Pour 15 mg / kg IV, la concentration passe de 20 µg / ml à 6 minutes à moins de 2 µg / ml après une heure. L’effet anti-fibrillation est corrélé à la concentration myocardique qui s’accroît lentement après l’injection IV pour atteindre son maximum en 1.5 à 6 heures. La dose en IV est de 2-6 mg / kg. Avec ceci, le seuil de fibrillation est multiplié par 5 à 18 fois . La toxicité est imputable à l’effet sympathomimétique primaire qui peut aggraver une hypertension ou une l’arythmie préexistante, puis à l’hypotension survenant lors de la phase sympatholytique (elle peut nécessiter à l’injection de dopamine ou de norépinéphrine si la pression artérielle chute au dessous de 75 mmHg ) (60). Son effet prenant un certain temps à s’imposer, le brétylium est souvent écarté au profit de la lidocaïne qui a une action plus rapide mais moins prononcée. La solution intermédiaire consiste en une combinaison de lidocaïne (2 mg / kg) et de brétylium (5 mg / kg) qui aurait un effet supplémentaire par rapport à l’emploi individuel des deux agents (60). Son action, longue à se mettre en place, et la fluctuation des paramètres hémodynamiques tels que la pression artérielle, non sans risque chez un malade cardiaque, font de cet agent une substance à éviter chez l’IMC (60). f - les inhibiteurs calciques Les agents, utilisés fréquemment en médecine vétérinaire, sont le vérapamil et le diltiazem Ils agissent en bloquant les canaux calciques de type L des cellules cardiaques et des muscles lisses vasculaires (60). Leurs effets se traduisent, en ce qui concerne le cœur, par une diminution de la contractilité du myocarde, de l’excitabilité du nœud sino-atrial et un ralentissement de la conduction atrioventriculaire (49, 60, 109). En ce qui concerne les fibres musculaires lisses vasculaires, les inhibiteurs calciques induisent une vasodilatation des artérioles systémiques se soldant par une diminution de la résistance vasculaire périphérique (49, 60, 109). La capacité à induire un effet plus ou moins marqué dépend de la molécule. Le vérapamil se fixe sur les 2 sites et a un effet marqué alors que le diltiazem a un effet plus intermédiaire (60). 156 • le vérapamil C’est un dérivé de la papavérine. Ce fut le 1er inhibiteur calcique découvert et utilisé en médecine humaine. En médecine vétérinaire, il est uniquement administré en intraveineux pour le contrôle de tachycardies supraventriculaire aiguës chez le chien, injecté à la dose de 0,05-0,15 mg / kg IV. La 1ère injection (0,05 mg / kg) se fait sur 1 à 2 minutes en surveillant l’ECG. Si aucune amélioration n’est obtenue, une deuxième dose de 0,05 mg / kg est injectée 10 à 20 minutes plus tard. Une troisième peut être requise (pour un total de 0,15 mg / kg) 10 à 20 minutes plus tard. Ceci permet, normalement, de venir à bout de 85 % des tachycardies supraventriculaires. Pour un effet plus long et continu, le bolus initial peut être suivi d’une perfusion de 2-10 µg / kg / min (60). La capacité du vérapamil à mettre un terme à la tachycardie suoraventriculaire est probablement imputable à son action sur le tissu jonctionnel atrioventriculaire. Du fait de l’absence d’activité des canaux Na rapides dans le nœud sinusal et dans certaines portions du nœud atrioventriculaire, les canaux calciques sont responsables de la dépolarisation des ces sites. Les inhibiteurs calciques ralentissent alors la conduction de l’influx dans la région atrioventriculaire, inhibent la réponse ventriculaire aux tachyarythmies supraventriculaires (comme la FA) et abolissent les arythmies supraventriculaires par phénomène de réentrée (60, 109). Utilisée en prévention, le vérapamil préviendrait l’apparition d’arythmies ventriculaires (52). Chez le chien, le vérapamil accroît la FC, effet sans doute relié à l’augmentation du tonus sympathique suite à la vasodilatation ce que le diltiazem n’induit pas ou presque pas. La contractilité du myocarde est directement diminuée par le vérapamil. En effet, les mouvements calciques sont nécessaires au couplage excitation – contraction .Ceci se solde par une atteinte plus ou moins grave de l’inotropisme cardiaque. Chez l’homme sain, cet action inotrope négative est contrebalancée par une stimulation du système nerveux sympathique, mais chez le patient dont la fonction myocardique est déjà éprouvée, les effets inotrope et chronotrope négatifs de cet agent ne peuvent être améliorés par un système sympathique déjà fortement stimulé. Ainsi l’injection d’inhibiteurs calciques peut se solder par une chute significative de la FC et de la contractilité du myocarde. C’est pourquoi le vérapamil est à éviter, chez le patient insuffisant mitral chronique de stade III et IV (60). S’il est, tout de même utilisé, un monitorage poussé des variables hémodynamiques et des injections de calcium ou de catécholamines doivent être entrepris (60). Chez le patient souffrant d’une insuffisance mitrale légère à modérée, le vérapamil peut accroître le débit cardiaque du fait de la vasodilatation artériolaire. Cependant, il faut être prudent car si l’injection est trop brutale, une hypotension sévère voire un collapsus cardiovasculaire peut se rencontrer (60). • le diltiazem En médecine vétérinaire, le diltiazem est employé afin de diminuer la FC lors de fibrillation atriale ou supprimer une tachycardie supraventriculaire (49, 60, 109). En effet, il ralentit la conduction dans le nœud atrioventriculaire et rallonge la période réfractaire atrioventriculaire d’un degré identique à celui du vérapamil (49, 60, 109). 157 Le diltiazem, injecté à la dose de 0,8 mg / kg IV, n’altère en rien la contractilité du myocarde ventriculaire gauche mais diminue la résistance périphérique et augmente la FC en réponse à une augmentation réflexe du taux de catécholamines circulantes (60). Cependant, dans la même étude, chez un chien atteint d’insuffisance myocardique ou de surcharge volumique du cœur gauche, l’injection de diltiazem s’accompagne d’une diminution de la contractilité et d’aucune variation de la FC. C’est pourquoi il doit être administré avec précaution chez l’IMC (60). Pour le contrôle d’épisodes de tachycardies supraventriculaires, KITTELSON suggère que les injections de diltiazem soient faites selon le même protocole que pour le vérapamil soit 3 injections de 0,05 mg / kg avec 5 minutes d’intervalle. D’autres cardiologues suggèrent l’emploi d’une dose unique de 0,25 mg / kg injectée sur 5 minutes (9, 60, 109). g - les digitaliques Ce sont des dérivés stéroïdes d’origine botanique, on y trouve la digoxine et la digitoxine (49, 56). Ces glycosides agissent comme des inotropes positifs mais possèdent, également, des propriétés antiarythmiques en ralentissant la FC. L’effet inotrope vient du groupement lactone de la molécule. On note, suite à l’injection de digitaliques, une augmentation de la contractilité du myocarde sain ou lésé. La capacité à améliorer l’inotropisme cardiaque est faible par rapport aux sympathomimétiques (environ 33 %). La réponse à l’emploi de ces agents semble, de plus, dépendre de l’espèce et de l’âge (56). L’augmentation du débit cardiaque résulte de l’effet inotrope positif mais aussi, chez l’insuffisant cardiaque, d’une vasodilatation liée à la suppression du réflexe de vasoconstriction. Chez le chien sain, cet effet vasoconstricteur est conservé et on n’assiste pas à cette augmentation de débit (75). L’effet inotrope est imputable à l’action des digitaliques sur la pompe Na / K ATPase dépendante de la membrane des cellules myocardiques (49, 56, 75, 96). Les digitaliques se fixent sur les sites normalement empruntés par le potassium et stoppent l’activité de la pompe. A la dose thérapeutique, environ 30 % des pompes sont ainsi inhibées. Les cellules en question vont perdre leur capacité à se vider de leur sodium durant la diastole ce qui va se solder par une augmentation de la [Na+] intracellulaire et à une augmentation de l’osmolalité. La cellule va alors échanger le sodium en excès contre du calcium par l’intermédiaire des transporteurs Na+ / Ca++ et voir son capital en calcium s’accroître. Dans une cellule intègre, cet excès de calcium est capté par le réticulum sarcoplasmique puis relargué durant la systole sur les protéines contractiles ce qui entraîne une augmentation de la contractilité. Lors d’atteinte des cellules myocardiques, on retrouve cet effet mais il sera plus ou moins bien restitué selon que le réticulum sarcoplasmique est plus ou moins apte à capter le calcium excédentaire (49, 56, 96). Selon KITTELSON, l’effet inotrope est, tout de même, sévèrement réduit lors d’insuffisance myocardique (56). Les digitaliques présentent également un caractère antiarythmique. Ils agissent, notamment, en augmentant la sensibilité des barorécepteurs (9, 49, 56). Lors d’insuffisance cardiaque, ces derniers voient souvent leur sensibilité diminuer avec, par conséquent, une diminution du tonus vagal et une augmentation de l’activité sympathique. La stimulation de l’activité de ces barorécepteurs rétablit le tonus vagal et atténue la concentration plasmatique en catécholamines permettant d’amoindrir la FC (9, 56). Cette action bradycardisante proviendrait également d’une stimulation vagale 158 directe sur le centre bulbaire (75). La diminution de la FC qui s’en suit améliore le remplissage ventriculaire et diminue la consommation en 02 du myocarde (56). L’action antiarythmique résulte, également, d’un effet direct sur la vitesse de conduction et de la période réfractaire du nœud atrioventriculaire en plus de la stimulation parasympathique sur le nœud sinusal et atrioventriculaire (49, 56). Ce faisant, les digitaliques permettent de maîtriser les dépolarisations supraventriculaires prématurées et les tachycardies supraventriculaires (ces arythmies faisant souvent suite à des phénomènes de réentrée, l’augmentation de la période réfractaire et la diminution de la vitesse de conduction atrioventriculaire permettent dans la plupart des cas d’abolir ces phénomènes) (9, 49, 56). Lors de fibrillation atriale, l’utilisation des digitaliques peut induire une baisse variable de la fréquence ventriculaire. Si cette baisse n’est pas suffisante ( FC > 160 bpm ), l’administration conjointe de β bloquants ou de diltiazem doit être entreprise (99). L’emploi de ces agents (digitaliques) n’est pas dénué d’effets indésirables. On peut notamment observer le développement d’arythmies ( effet bathmotrope positif qui augmente l’excitabilité du myocarde ventriculaire (49, 56, 75)) : tachycardie ventriculaire telle que des dépolarisations ventriculaires prématurées, bigéminisme, trigéminisme ou des bradyarythmies comme un BAV 2ème degré, bradycardie sinusale ou pause sinusale induite par l’augmentation du tonus vagal (49, 56). L’intoxication aux digitaliques (index thérapeutique étroit (65)) peut mener à une dysfonction myocardique et à des dommages aux myocytes (49). Lors d’urgences, la dose à injecter produit des concentrations sériques toxiques, c’est pourquoi, lorsqu’ils sont employés, ils le seront avec précaution (injection lente, sur 15 minutes et sous monitorage) (56, 75). Dans le traitement d’urgence des tachycardies supraventriculaires, ils sont généralement proscris, la préférence allant aux β bloquants ou aux inhibiteurs calciques (56, 75). Si on recherche un effet inotrope positif, la dobutamine et la dopamine sont des molécules d’utilisation plus sure et plus efficace (56, 75). 159 III. A. 2 - les substances luttant contre les bradyarythmies a - les anticholinergiques Ces derniers, atropine et glycopyrrolate, peuvent être utilisés à des fins thérapeutique et diagnostique dans les bradyarythmies. L’augmentation du tonus vagal, faisant éventuellement suite à l’administration d’agents anesthésiques, peut induire une bradycardie sinusale, une pause sinusale ou un BAV de 2ème degré. Suite à l’injection de ces agents, la fréquence cardiaque (du moins sinusale) remonte au dessus de 150 bpm si la bradycardie est due à un tonus vagal trop important. Si la bradycardie résulte d’une atteinte du nœud sinusal, la fréquence ne remonte pas au dessus de 110 bpm. La dose prescrite est de 0,04 mg / kg IV d’atropine (49, 73). b - les sympathomimétiques Il s’agit de l’isoprotérénol ou isoprénaline. C’est un β agoniste pur (stimulant donc à la fois les récepteurs β1 et β2). Ce faisant, il induit une augmentation de la fréquence du nœud sinusal donc de la FC, de la vitesse de conduction dans le nœud atrioventriculaire, il améliore la contractilité du myocarde et le débit mais diminue la pression artérielle et accroît excitabilité des pacemakers subsidiaires du cœur (49, 73). L’isoprénaline est employée afin d’augmenter temporairement la FC chez des animaux souffrant d’un sick sinus syndrome ou développant un BAV de 3ème degré (73). Bien qu’elle soit inotrope positif, elle est surtout utilisée pour ses propriétés dromotrope et chronotrope positives dans les bradycardies extrêmes : BAV sans réponse aux anticholinergiques (65, 73). L’isoprénaline est administrée en perfusion à un rythme de 0.05-0.2 µg / kg / min. Elle peut s’accompagner d’épisodes d’hypotension suite à la stimulation des récepteurs β2 et à la vasodilatation des artérioles, et induire des tachyarythmies ventriculaires notamment (49, 60, 73, 96). III. B - LES SUBSTANCES INOTROPES Appelés également cardiotoniques, ce sont des agents qui ont comme propriétés d’accroître la contractilité du myocarde (96). Il est possible de distinguer différentes classes : les inhibiteurs de l’ATPase Na / k dépendante (les digitaliques vus précédemment), les sympathomimétiques et les inhibiteurs de la phosphodiestérase (96). La thérapeutique d’urgence des défaillances myocardiques contractiles ou l’état à bas débit, est fondée sur l’utilisation de ces agents par voie intraveineuse. Ils sont tous de manipulation délicate car aucun n’est purement inotrope positif. Parmi les effets indésirables, l’effet bathmotrope positif est le plus dangereux. La surveillance électrocardiographique est donc indispensable (65). III. B. 1 - les sympathomimétiques a - mécanisme d’action Les amines sympathomimétiques augmentent la contractilité, la vitesse de conduction et la FC en se fixant sur les récepteurs β du cœur. L’augmentation de la contractilité provient de la stimulation de l’adénylcyclase des cellules qui clivent l’ATP en AMPc activant une protéine kinase. Cette dernière va activer (par phosphorylation) certaines 160 protéines intracellulaires notamment celle du réticulum sarcoplasmique ce qui permet une plus grande prise en charge du calcium durant la diastole. L’AMPc affecte aussi les canaux calciques cellulaires et accentue l’entrée du calcium dans la cellule pendant la diastole (49, 56, 75, 96). La stimulation des récepteurs β1 charrie à elle seule les effets inotrope, chronotrope et bathmotrope positifs (56). La plupart des sympathomimétiques est capable d’accroître la contractilité de 100 % mais certains d’entre eux sont d’emploi dangereux du fait d’effets annexes. Les sympathomimétiques peuvent stimuler à la fois les récepteurs α et β adrénergiques. L’effet dépend de la molécule et de la dose injectée (56). L’isoprénaline est un β agoniste pur, elle accroît la contractilité mais aussi la FC, stimule l’apparition d’arythmies et peut faire chuter la pression artérielle de par son action β2, vasodilatatrice (56). L’adrénaline, ou l’épinéphrine, est inotrope positive mais stimule aussi les récepteurs α adrénergiques périphériques induisant alors une vasoconstriction et une augmentation de la résistance vasculaire périphérique et de la pression artérielle (49, 56). Elle produit également une tachycardie et est la plus arythmogène de toutes les catécholamines. C’est pourquoi son emploi est uniquement réservé à l’arrêt cardiaque ou circulatoire (49). Les nouveaux sympathomimétiques, comme la dobutamine ou la dopamine, sont moins arythmogènes, augmentent moins fortement la FC et sont plus recommandés dans les états à bas débit. Leur durée d’action est très courte ( 1-2 minutes ), c’est pourquoi ils sont administrés, de la meilleure manière, en perfusion continue (56). Une des limitations de leur utilisation chez le chien malade cardiaque, est l’altération de la densité et sensibilité des récepteurs β aux catécholamines endo ou exogènes. La réponse inotrope aux sympathomimétiques diminue d’environ 50 % après une journée de traitement par ces agents (56). b - la dobutamine C’est une catécholamine de synthèse. Elle stimule les récepteurs β1 se soldant par un effet inotrope positif. Ce faisant, elle diminue le volume en fin de systole, accroît le volume d’éjection et le débit cardiaque. Elle possède, également, une faible action β2 périphérique et α1 adrénergique. Cependant, la pression artérielle reste souvent inchangée (49, 56). L’effet inotrope positif est puissant, les effets chronotrope et bathmotrope sont, par rapport à l’isoprénaline, nettement plus faibles (75). Les effets hémodynamiques de la dobutamine ont été étudiés chez le chien conscient et anesthésié. Dans chaque situation, la dobutamine induit une augmentation de la myocontractilité, du débit cardiaque, du volume d’éjection et du flux coronaire sans variation de la pression ni augmentation de la consommation en 02 (49, 56). Les effets de la dobutamine sur la FC sont beaucoup moins marqués, comparée aux autres catécholamines. On note, cependant une légère augmentation chez le chien anesthésié que l’on ne retrouve pas chez l’animal conscient (aucune variation même pour 20µg / kg / min) (49, 56). Injectée à des patients souffrant d’insuffisance myocardique aiguë ou chronique, elle permet de diminuer la pression diastolique ventriculaire et, ce faisant, la formation d’œdèmes. 161 La dobutamine est moins arythmogène que la plupart des catécholamines mais peut, malgré tout, aggraver une arythmie (en particulier une arythmie ventriculaire) voire en induire une. Le rythme de perfusion est de 5-20 µg / kg / min, ce qui semble être bien adapté chez le chien. Un rythme supérieur se solde, généralement, par une tachycardie (49, 56). 162 c - la dopamine C’est un précurseur de la noradrénaline. Elle stimule les récepteurs β1 cardiaques et les récepteurs dopaminergiques périphériques, en particulier au niveau rénal et mésentérique où elle induit une vasodilatation (49, 56). L’action de la dopamine est complexe car dose dépendant : - à moins de 5 µg / kg / min, elle stimule les récepteurs DOPA (DA1 et DA2) entraînant une vasodilatation des vaisseaux rénaux, mésentériques et des coronaires sans baisse de la pression artérielle ni des résistances périphériques (49, 56). - aux doses moyennes de 5-20 µg / kg / min, s’ajoute une stimulation β avec action inotrope et chronotrope positives et diminution de la résistance périphérique due à la vasodilatation des artérioles (49, 65, 73, 75). - à forte dose, supérieure à 20 µg / kg / min, la stimulation des récepteurs α induit une vasoconstriction avec augmentation de la pression artérielle et chute de la diurèse (49, 65, 73, 75). La dopamine est recommandée lors d’état de choc mais présente aussi un intérêt dans le traitement à court terme des états à bas débit (49, 56). Aux doses moyennes, l’effet inotrope est plus marqué que les effets chronotrope et bathmotrope (65). III. B. 2 - les inhibiteurs de la phosphodiestérase Dérivés de la bipyridine, ces composés induisent une augmentation de la contractilité du myocarde et une vasodilatation artériolaire. a - principe d’action Ce sont des inhibiteurs de la fraction III de la phosphodiestérase (49, 56, 75, 96). Cette dernière est une enzyme intracellulaire responsable de l’inactivation de l’AMPc dans le myocarde et les tissus vasculaires. Ces agents sont ainsi responsables d’une augmentation de la durée de vie de l’AMPc et de sa concentration intracellulaire (49, 56, 75, 96). Ce faisant, ils induisent le même type d’effet inotrope que les sympathomimétiques. La différence majeure est que les inhibiteurs de la phosphodiestérase (IPDE) shuntent les récepteurs β donc leur effet inotrope ne diminue pas avec l’internalisation des ces derniers (56). Aux doses élevées, les IPDE exercent un effet sur le transport du calcium qui contribue à renforcer l’effet inotrope (56). La vasodilatation résulte d’une diminution de la prise en charge du calcium dans les fibres musculaires lisses vasculaires suite à l’augmentation de la concentration en AMPc (75). b - l’amrinone Elle induit une augmentation de la contractilité du myocarde, une diminution de la pression sanguine et télédiastolique gauche sans modifier en profondeur la FC, une diminution de la consommation en 02 et une nette amélioration du débit cardiaque (49, 75). Chez le chien anesthésié, un bolus IV de 1-3 mg / kg induit une élévation de 60 à 100 % de la contractilité, une diminution de 10 à 30 % de la pression artérielle et une hausse de 5 à 10 % de la FC. L’effet inotrope atteint son maximum en 5-10 minutes après l’injection et diminue de 50 % toutes les 10 minutes. Il est dissipé en, environ, 20 à 30 minutes. Ceci témoigne de la nécessité de l’administration en continue grâce à une 163 perfusion (10-100 µg / kg / min). Suite à cela, la contractilité augmente de 30 à 90 %, chez l’animal anesthésié .Pour un débit de 10 µg / kg / min la pression ne varie pas, alors que pour 30 µg / kg /min elle diminue de 10 % et 100 µg / kg / min elle chute de 30 %. De la même façon, la FC resta inchangée pour un débit de 10 µg / kg / min mais s’élève de 15 et 20 % pour un débit de 30 et 100 µg / kg / min (56). Chez le patient anesthésié chez lequel on induit une insuffisance myocardiaque, l’emploi d’amrinone s’accompagne d’une hausse de la contractilité de 40 à 200 % et du débit de 80% (56). Cet agent a un indice thérapeutique très large et un faible risque de toxicité. Il est recommandé dans le traitement à court terme d’état à bas débit avec une injection lente d’un bolus de 1-3 mg / kg puis un relais en perfusion de 10-100 µg / kg / min. Il faut faire attention à l’éventuelle hypotension lors d’induction trop brutale (49, 56). c - la milrinone Elle a les mêmes effets mais est 30 à 40 fois plus puissante que l’amrinone (49, 56). Chez l’animal en bonne santé et anesthésié, une injection de 30-300 µg / kg induit une hausse de la contractilité de 40 à 120 % alors que la pression diminue de 10 à 30 % (56). La milrinone semble également améliorer les indices de fonction diastolique du ventricule gauche (49). L’effet maximum est obtenu en 1 à 2 minutes suivant l’injection puis décroît d’environ 50 % toutes les 10 minutes pour être dissipé en une demi heure. Une perfusion continue de 1-10 µg / kg / min améliore l’inotropisme cardiaque de 50 à 140 % avec un pic d’effet au bout de 10 à 30 minutes. Cependant, il semblerait que chez un faible pourcentage d’animaux, elle induise une a g s ventriculaires g (56). r a III. B. 3 - les calcium sensibilisateurs Ils ont la faculté d’accroître la sensibilité des protéines myocardiques (actine et myosine) au calcium ce qui a comme résultat, une meilleure force contractile. Ils ont également un faible effet sur la phosphodiestérase, leur allouant des similitudes avec les dérivés de la bipyridine (49, 56, 65). Bien qu’ils exercent un effet bénéfique sur la relaxation du myocarde à court terme (56), ils sont, selon toute vraisemblance, néfastes à long terme avec une réduction de l’espérance de vie malgré une amélioration de sa qualité (49, 56). Ces deux classes d’agents que sont les antiarythmiques et les inotropes positifs regroupent un grand nombre de substances dont il convient de connaître les effets (tant bénéfiques qu’indésirables) afin de les utilis 164 v Le monitorage du patient est la plaque tournante de la réussite de l’anesthésie car il permet la surveillance et le contrôle d’un grand nombre de paramètres cardiorespiratoires, les interventions rapides et la vérification de l’efficacité du traitement en cas d’accident. Pour un patient présentant une IMC compensée sans signe clinique ni restriction, un ECG, une évaluation indirecte de la pression artérielle ( doppler ) et la mesure du volume courant en plus des paramètres facilement appréciables ( TRC, couleur des muqueuses, auscultation cardiaque et respiratoire ) sont suffisants. A mesure que l’IMC s’aggrave, le monitorage s’enrichit d’un oxymètre, d’un capnographe afin d’évaluer les constantes sanguines, d’une mesure directe des pressions veineuse et artérielle. Lorsque la situation cardiovasculaire est critique, la mesure du débit cardiaque par thermodilution et de la pression pulmonaire nécessite la mise en place d’un cathéter de swan-ganz. Un analyseur sanguin est, lui aussi, indiqué. Tout ce matériel nécessite, également, compétence et dépense conséquentes. Contrairement au monitorage, le matériel nécessaire au traitement des accidents peropératoires est constant et doit comporter un panel de substances antiarythmiques et inotropes positives couramment utilisées. 165 166 CONCLUSION GENERALE L’examen pré-anesthésique du patient souffrant d’IMC permet d’estimer assez précisément la gravité de l’atteinte cardiaque, ses répercussions sur l’organisme, la stabilité du système cardiovasculaire et la possibilité de subir une anesthésie générale. On rappellera l’importance des examens échocardiographique et électrocardiographique dans la visualisation de la morphologie et l’évaluation de la dynamique cardiaque. La connaissance des effets cardiovasculaires des agents anesthésiques majeurs permet de choisir, au vue de l’examen pré-anesthésique, les molécules les plus sures à employer. Ainsi un animal de stade I ou II peut être considéré comme un patient sain et peu de substances sont à éviter. Cependant, plus l’affection évolue et plus le choix s’oriente vers des produits à relativement large innocuité tels que les benzodiazépines, les morphiniques, l’étomidate et les agents volatils comme le sévoflurane ou le desflurane. De même, le monitorage des constantes cardiorespiratoires reste somme toute superficiel ou indirect pour des patients en début d’évolution. Les mesures directes d’un plus grand nombre de paramètres sont entreprises lorsque l’IMC se solde par une modification importante de la morphologie et de la dynamique cardiaque (pression veineuse centrale et pression artérielle, statut acido-basique du patient, analyse des gaz sanguins). Un patient souffrant d’IMC est ainsi toujours anesthésiable, il n’est cependant pas offert à tous les praticiens d’anesthésier des patients de stade III ou IV car ceux-ci requièrent l’emploi d’agents anesthésiques très spécifiques, le monitorage doit être très pointu et nécessite un matériel ainsi que des compétences qui restent encore l’apanage d’un nombre restreint de vétérinaires. 167 168 BIBLIOGRAPHIE 1 - ABOU-MADI N, ROBERTSON S. Evaluation of lingual venous oxygen tension as a substitute for arterial blood in blood-gas analysis in the dog : a preliminary report. Vet. Surg, 1989, 18 ( 3 ), 247 . 2 - AMBERGER C, GLARDON O, LOMBARD C W. Validité des examens complémentaires dans l’évaluation de l’insuffisance cardiaque par endocardiose mitrale : étude à partir de 106 cas. Prat. Med. Chir. Anim. Comp., 1995, 30, 659-670 . 3 - BEDNARSKI RM. Anesthetic concerns for patients with cardiomyopathy. Vet. Clin. North. Am, 1992, 22, 460 . 4 - BEGON D. Le gros cœur radiologique. Rec. Med. Vet, 1987, 163 ( 8-9 ), 739-755 . 5 - BERNARDE A. Incidents, accidents et complications de l’anesthésie. Point Vét., 1993, 25, 133-149 6 - BERRY CR, LOMBARD CW, HAGER DA, ACKERMAN N. Pericardial effusion secondary to chronic endocardiosis and left atrial rupture in a dog. Comp. Contin. Educ. Pract. Vet., 1988, 10 ( 7 ), 800-805 . 7 - BLAISET MA, BEDNARSKI RM, CABASSU JP. L’examen pré-anesthésique. Point vét., 1993, 25, 5-10 . 8 - BONAGURA JD, GRADY MR, POWERS JD et HERRING DS. Quantitative cross sectionnal echocadiography in the normal dog. Vet. Radiol., 1986, 27 (2), 34-49 . 9 - BONAGURA JD, KEENE BW. Therapy of heart failure. In : KIRK’S. Current veterinary therapy. 12th ed. philadelphia, WB Saunders, 1995, 780-786 10 - BOND BR. Problems in veterinary ultrasonographic analysis of acquired heart disease. Probl. Vet. Med., 1991, 3-4, 520-554 . 11 - BORENSTEIN N. Mise en place d’une voie veineuse centrale. Action Vét., 1998, n° 1432, 19-23 . 12 - BOYD CJ, MAC DONELL WN, VALLIANT A. comparative hemodynamic effects of halothane and halothane acepromazine at equipotent doses in dogs. Can. J. Vet Res., 1991, 55, 107-112 . 13 - CHETBOUL V. Affections valvulaires acquises. Encyclopédie Vétérinaire, Paris, 1994, cardiologie 0600, 1-9 . 14 - CHETBOUL V. Echographie et cardiopathies acquises. Rec. Med. Vet., 1995, 171 ( 4-5 ), 299-310 . 169 15 - CHETBOUL V, POUCHELON JL. Echographie en cardiologie : technique et aspect normal. Rec. Med. Vet., 1995, 171 ( 4-5 ), 287-298 . 16 - CHETBOUL V, POUCHELON JL, BONHOEFFER P. L’examen doppler cardiaque chez les carnivores domestiques. Rec. Med. Vet., 1995, 171 ( 12 ), 799-818 . 17 - CHETBOUL V, POUCHELON JL, TESSIER D et al. Atlas d’échocardiographie vétérinaire. Paris, Masson , 1999, 169p 18 - COGNY M. Les anesthésiques volatils. Point Vét., 1993, 25, 43-50 . 19 - COPPENS P. La surveillance de l’anesthésie chez les petits animaux. Point Vét., 1993, 25, 111-118. 20 - CULKEN LK. Medetomidine sedation in dogs and cats : a review of its pharmacology, antagonism and dose. Br. Vet. J., 1996, 152, 519-531 . 21 - DARKE PGG. Mitral valve disease in cavalier king charles spaniels. Cardiopulmonary diseases. In : KIRK’S. Current veterinary therapy. 12th ed. Philadelphia, WB Saunders, 1995, 837-842 . 22 - DI FRUSCIA R, THERRIEN N. L’insuffisance cardiaque chez le chien : physiopathologie et principe de traitement. Le Médecin Vétérinaire Du Québec, 1997, 27 ( 1 ), 12-20 . 23 - DODMAN NH, SEELER DC, COURT MH. Recommended technics in small animal anesthesia : an update. Br. Vet. J., 1984, 140, 505-515 . 24 - DUPRAS I, BLAIS D, CUVELLIEZ S. L’induction. Point Vét., 1993, 25, 89-95 . 25 - DUPRE G. Le choix des examens complémentaires pré-opératoires en fonction de l’intervention .Point Vét, 1993, 25, 21-23 . 26 - DYSON DH, PETTIFER GR. Evaluation of the arrythmogenicity of a low dose of acepromazine : comparison with xylazine . Can. J. Vet. Res., 1997, 61, 241-245 . 27 - EVANS AT. Anesthetic emergencies and accidents. In : LUMB AND JONES. Veterinary anesthesia. 3rd ed. Philadelphia, Léa & Febiger, 1997, 849-860 . 28 - FARVER TB, HASKINS SC, PATZ JD. Cardiopulmonary effects of acepromazine and subsequent administration of ketamine in dog. Am. J. Vet. Res., 1986, 47 ( 3 ), 631635 . 29 - FRANCOIS G. Système circulatoire et anesthésie. In : Précis d’anesthésie. Paris, Masson, 1981, 261-270 . 30 - GAILLOT H, BEGON D. La radiographie en cardiologie. Rec. Med. Vet., 1995, 171 ( 4-5 ), 269-285 . 170 31 - GREENE SA, THURMON JC. Xylazine : a review of its pharmacology and use in veterinary medecine. J. Vet. Pharmacol ther., 1998, 11, 295-313 . 32 - GREENE SA, HARTSFIELD SM, TYNER CL. Cardiovascular effects of butorphanol in halothane anesthetized dogs. Am. J. Vet. Res., 1990, 51 ( 8 ), 1276-1280 . 33 - HAGGSTROM J, HAMLIN RL, HANSON K, KVART C. Heart rate variability in relation to severity of mitral regurgitation in cavalier king charles spaniels. J. Small. Anim. Pract., 1996, 37, 69-75 . 34 - HARTSFIELD SM. Intérêts et principe d’utilisation de la kétamine pour induire une anesthésie. Point Vét., 1993, 25, 99-100 . 35 - HASKINS SC. Internal cardiac compression. J. Am. Vet. Med. Assoc., 1992, 200 ( 12-1 ), 1945-1946 36 - HASKINS SC. Monitoring the anesthetized patient. In : LUMB AND JONES. Veterinary anesthesia. 3rd ed. Philadelphia, Léa & Febiger, 1997, 409-423 . 37 - HASKINS SC, FARVER BT, PATZ DJ. Cardiovascular changes in dogs given diazepam / ketamine. Am. J. Vet. Res., 1986, 47 ( 4 ), 795-798 . 38 - HASKINS SC, KLIDE AM. Précautions lors de l’utilisation de la kétamine pour induire une anesthésie. Point Vét., 1993, 25, 100 . 39 - HERVE D. L’arrêt cardiaque. Point Vét., 1993, 25, 91-98 . 40 - HOIT BD, JONES M, EIDBO EE, ELIAS W, SAHN DV. Sources of variability for doppler flow mapping of regurgitant jets in an animal model of mitral regurgitation. J. Am. Coll. Cardiol., 1989, 13, 1631-1636 . 41 - HUI CHU LIN. Dissociative anesthetics. In : LUMB AND JONES. Veterinary anesthesia. 3rd ed. Philadelphia, Léa & Febiger, 1997, 241-276 . 42 - JACOBSON JD, HARTSFIELD SM. Cardiovascular effects of intravenous bolus administration and infusion of ketamine – midazolam in isoflurane anesthetized dogs. Am. J. Vet. Res., 1993, 54 ( 10 ), 1715-1720 . 43 - JAMES KM, POLZIN D, OSBORNE CA, OLSON JK. Effect of sample handling on total carbon dioxide concentrations in canine and feline serum and blood. Am. J. Vet. Res., 1997, 58 (4), 343-347 . 44 - JONES DJ, STEHLING LC, ZAUDER HL. Cardiovascular response to diazepam and midazolam maleate in the dog. Anesthesiology, 1979, 51, 430-434 . 45 - JONES JL. Non invasive monitoring techniques in anesthetized animals. Vet. Med., 1996, 91 (4 ), 326-336 . 46 - JONES JL. Invasive monitoring techniques in anesthetized animals. Vet. Med., 1996, 91 (4 ), 337-341 . 171 47 - KEEGAN RD, GREENE SA. Cardiovascular effects of a continuous two hour propofol infusion in dogs / comparison with isoflurane anesthesia. Vet. Surg., 1993, 22 ( 6 ), 537-543 . 48 - KEEGAN RD, GREENE SA, BAGLEY RS, MOORE MP, WEIL AB, SHORT CE. Effects of medetomidine administration in intracranial pressure and cardiovascular variables of isoflurane anesthetized dogs. Am. J.Vet. Res., 1995, 56 ( 2 ), 193-198 . 49 - KEENE BW, RUSH JE. Therapy of heart failure. In : ETTINGER SJ, FELDMAN EC. Textbook of veterinary internal medecine. The cardiovascular system, first volume. 3rd ed. Philadelphia, WB Saunders, 1989, 867-890 . 50 - KIENLE RD. Echocardiography. In : Small animal cardiovascular medecine. St Louis. Mosby, 1998, 95-118 51 - KILBORN SH, BONNETT BN, POOK HA. Comparison of three different methods of total carbondioxide measurement. Vet. Clin. Pathology., 1995, 24 ( 1 ), 2227 . 52 - KITAO JMA, MITEMA ES. Effect of antiarrythmic drugs ( verapamil, propanolol and lignocaîne ) on the ECG and haematology in adrenaline induced arrythmias in dogs anesthetized with halothane. Br. Vet. J., 1994, 150 ( 4 ), 365-375 . 53 - KITTELSON MD. Radiography of the cardiovascular system. In : Small animal cardiovascular medecine. St Louis, Mosby, 1998, 47-71 . 54 - KITTELSON MD. Electrocardiography : basic concepts, diagnosis of chamber enlargement and intraventricular conduction disturbances. In : Small animal cardiovascular medecine. St Louis ; Mosby, 1998, 72-94 . 55 - KITTELSON MD. Pathophysiology of heart failure. In : Small animal cardiovascular medecine. St Louis, Mosby, 1998, 136-148 . 56 - KITTELSON MD. Management of heart failure. In : Small animal cardiovascular medecine. St Louis, Mosby, 1998, 149-194 . 57 - KITTELSON MD. Approach to the patient with cardiac disease. In : Small animal cardiovascular medecine. St Louis, Mosby, 1998, 195-217 . 58 - KITTELSON MD. Myxomatous atrioventricular valvular degeneration. In : Small animal cardiovascular medecine. St Louis, Mosby, 1998, 297-318 . 59 - KITTELSON MD. Diagnosis and treatment of arrythmias. In : Small animal cardiovascular medecine. St Louis, Mosby, 1998, 449-494 . 60 - KITTELSON MD ; Durgs used in treatment of cardiac arrythmias ; In : Small animal cardiovascular medecine. St Louis, Mosby, 1998, 502-524 . 172 61 - KNIGHT DH. Pathology of heart failure and clinical evaluation of cardiac function. In : ETTINGER SJ, FELDMAN EC. Textbook of veterinary internal medecine. The cardiovascular system. first volume. 3rd ed. Philadelphie, WB Saunders, 1989, 844-866 . 62 - KOMAR E, FAV D, SILMANOWICZ P, BALICKI I. Effets du propofol sur les paramètres hémodynamiques chez le chien. Rev. Med. Vet., 1992, 143 ( 10 ), 741-744 . 63 - LE BOBINNEC G. Les pièges de l’auscultation. Rec. Med. Vet., 1987, 163, 8-9 . 64 - LE BOBINNEC G. L’électrocardiogramme pré-opératoire. Point Vét., 1993, 25, 11-19 . 65 - LE BOBINNEC G. L’insuffisance cardiaque aiguë par défaillance myocardique contractile. Point Vét., 1998, 23, 99-101 . 66 - LEMAIRE M, ART T, HENROTEAUX M, LEKEUX P. Potentialités de l’application de l’oxymétrie à infrarouge basée sur les pulsation dans l’espèce canine. Ann. Med. Vét., 1991, 135, 203-212 . 67 - LEMKE KA, TRANQUILLI JW, THURMON JC, BENSON GJ, OLSON WA. Alterations in the arrythmogenic doses of epinephrine after xylazine or medetomidine administration in halothane anesthetized dogs. Am. J. Vet. Res., 1993, 54, n° 12, 21322138 . 68 - LEMKE KA, TRANQUILLI JW, THURMON JC, BENSON GJ, OLSON WA. Alterations in the arrythmoge 173 75 - MORAILLON R. La thérapeutique inotrope. Nouveautés en cardiologie. Rec. Med. Vet., 1987, 163, 8-9, 799-803 . 76 - MUIR WW. Anesthesia for dogs and cats with cardiovascular disease. Part I. Comp. Contin. Educ. Pract. Vet., 1998, 20, n° 1, 78-87 . 77 - MUIR WW. Anesthesia for dogs and cats with cardiovascular disease. Part II. Comp. Contin. Educ. Pract. Vet., 1998, 20, n° 4, 473-484 . 78 - MUIR WW, MASON DE. Side effects of etomidate in dogs. J. Am. Vet. Med. Assoc., 1989, 194 ( 10 ), 1430-1434 . 79 - MUIR WW, DE MORAIS HSA. Acid base imbalance : traditionnal and modified approaches. In : LUMB AND JONES. Veterinary anesthesia. 3rd ed. Philadelphia, Léa & Febiger, 1997, 558-571 . 80 - MUIR WW, WERNER LL, HAMLIN RL. Antiarrythmic effect of diazepam during coronary artery occlusion in dogs. Am. J. Vet. Res., 1975, 36, 1203-1206 . 81 - MUIR WW, WERNER LL, HAMLIN RL ; Effects of xylazine and acétylpromazine upon induced ventricular fibrillation in dogs anesthetized with thiamylal and halothane. Am. j. Vet. Res., 1975, 36, 1299-1303 . 82 - MUIR WW, HUBBELL J, SKARDA RL. Handbook of veterinary anesthesia. St louis, Mosby, 1989, 340p 83 - MUIR WW, HUBBELL J, SKARDA RL, BEDNARSKI RM. Handbook of veterinary anesthesia. 2nd ed. St louis, Mosby, 1995. 84 - MUTOH T, NISHIMURA R, KIM HY, MATSUNAGA S, SASAKI N. Cardiopulmonary effects of sevoflurane compared with halothane, enflurane and isoflurane in dogs. Am. J. Vet. Res., 1997, 58 ( 8 ), 885-90 . 85 - NAKAYAMA T, WAKAO Y, NEMOTO H, UECHI M, KAGEYAMA T, MUTO M, TAKAHASHI M. Mitral valve protrusion assessed by use of B mode echocardiography in dogs with mitral regurgitation. Am. J. Vet. Res., 1996, 57 ( 6 ), 791-797 . 86 - NAKAYAMA T, WAKAO Y, NEMOTO H, UECHI M, KAGEYAMA T, MUTO M, TAKAHASHI M. Relationship between degree of mitral protrusion assessed by use of B mode echocardiography and degree of mitral regurgitation using an experimental model in dogs. J. Vet. Med. Sci., 1997, 59 ( 7 ), 551-555 . 87 - OAKLEY RE, OLIVIER B, EYSTER GE, HAUPTMAN JG. Experimental evaluation of central venous pressure monitoring in the dog. J. Am. Anim. Hosp. Assoc., 1997, 33, 77-82 . 88 - O’GRADY Acquired valvular heart disease. In : ETTINGER SJ. Textbook of veterinary internal medecine. The cardiovascular system. first volume. 3rd ed. Philadelphia, WB Saunders, 1989, 944-958 . 174 89 - ORSINI OA. Pathophysiology, diagnosis and treatment of clinical acid base disorders. Comp. Contin. Educ. Pract. Vet., 1989, 11 ( 5 ), 593-604 . 90 – ORTON CE. Small animal thoracic surgery. Philadelphia, Lea & Febiger, 1995, 350p 91 - PADDLEFORD RR. Manual of small animal anesthesia. New York, Churchill Livingstone, 1988, 1-30 . 92 - PASCOE PJ, ILKIW JE, HASKINS SC, PATZ JD. Cardiopulmonary effects of etomidate in hypovolemic dogs. Am. J. Vet. Res., 1992, 53 ( 11 ), 2178-2182 . 93 - PEDERSEN HD, LORENTZEN KA, KRISTENSEN BO. Observer variation in two dimensionnal echocardiographic evaluation of mitral valve prolapse in dogs. Veterinary radiology and ultrasound, 1995, 37 ( 5 ), 367-372 . 94 - PEDERSEN HD, KRISTENSEN BO, NERBY B, LORENTZEN KA. Echocardiographic study of mitral valve prolapse in dachshunds. J. Vet. Med. A, 1996, 43, 103-110 . 95 - PIBAROT P, BLAIS D, CUVELLIEZ S. La surveillance de la pression artérielle par la méthode doppler. Le médecin vétérinaire du Québec, 1992, 22 ( 1 ), 28-29 . 96 - POUCHELON JL. Cardiologie. Unité pédagogique de pathologie médicale des équidés et des carnivores. ENVA, 1993, 38p 97 - POUCHELON JL. Les urgences cardiaques. Rec. Med. Vet., 1989, 165 ( 12 ), 965968 . 98 - POUCHELON JL, CHETBOUL V. Etude de la fraction de raccourcissementchez 110 chiens insuffisants mitruax par endocardiose. Rec. Med. Vet., 1989, 165 ( 10 ), 801806 . 99 - QUANDT JE, RAFFE MR, POLZIN D, ROBINSON EP, MANDSAGER RE. Evaluation of toenail blood samples for blood gas analysis in the dog. Vet. Surg., 1991, 20 ( 5 ), 357-361 . 100 - RAND JS, REYNOLDS WT, PRIEST J. Echographic evaluation of the effects of medetomidine and xylazine in dogs. Aust. Vet. J., 1996, 73 ( 2 ), 41-44 . 101 - RUDLOFF E, KIRBY R. Hypovolemic shock and resuscitation. Emergency medecine, 1994, 24 ( 6 ) 1015-1036 . 102 - SALMON Y. La démarche anesthésique. Point Vét., 1992, 24 ( 143 ), 17-20 . 103 - SEYRTEN D, COPPENS P, JONES R, VERSTEGEN J, PHILIPPARTS C, LAMYS M. Circulatory and respiratory effects of the combination medetomidine / ketamine in beagles. J. Vet. Pharmacol. Ther., 1993, 16, 199-206 . 175 104 - STAUFFER JL et al. Cardiac dysrythmias during anesthesia for cervical decompression in the dog. Am. J. Vet. Res., 1988, 49 ( 7 ), 1143-1146 . 105 - STEFFEY EP. Inhalation anesthetics ; In : LUMB AND JONES. Veterinary anesthesia. 3rd ed. Philadephia, Léa & Febiger, 1997, 297-323 . 106 - STEPIEN RL. Sedation for cardiovascular procedures. In : KIRK’S ; Current veterinary therapy. Cardiopulmonary disease. 12th ed. Philadelphia, WB Saunders, 1995, 773-780 . 107 - STEPIEN RL, BONAGURA JD, BEDNARSKI RM, MUIR WW. Cardiorepiratory effects of acepromazine maleate and buprenorphine hydrochloride in clinically normal dogs. Am. J. Vet. Res., 1995, 56 ( 1 ), 78-84 . 108 - TAKEMURA N, KOYAMA H, MOTOYOSHI S. Congestive heart failure due to bilaterale atrioventricular valve insufficiency in two dogs. J. Vet. Med. Sci., 1996, 58 ( 4 ), 381-384 . 109 - THIEBAULT JJ. Inhibiteurs calciques : réalité ou espoir thérapeutique. Rec. Med. Vet., 1987, 163 ( 8-9 ), 781-792 . 110 - THIEBAULT JJ. Les agents de la pré-anesthésie chez les carnivores domestiques. Point Vét., 1993, 25, 27-33 . 111 - THIEBAULT JJ. Les anesthésiques injectables chez les carnivores domestiques. Point Vét., 1993, 25, 35-41 ; 112 - THURMON JC, TRANQUILL WJ, BENSON GJ. Preanesthetics and anesthetic adjuncts. In : LUMB AND JONES. Veterinary anesthesia. 3rd ed. Philadelphia, Léa & Febiger, 1997, 183-203. 113 - THURMON JC, TRANQUILLI WJ, BENSON GJ. Injectable anesthetics ; In : LUMB AND JONES. Veterinary anesthesia. 3rd ed. Philadelphia, Léa & Febiger, 1997, 210-238 . 114 - TRONCY E, BLAIS D, CUVELLIEZ S. La prémédication. Point Vét., 1993, 25, 75-88 . 115 - TURNER DM, ILKIW JE. Cardiovascular and respiratory effects of three rapidly acting barbiturates in dogs. Am. J. Vet. Res. , 1990, 51 ( 4 ), 598-604 ; 116 - UEHARA Y, TAKAHASHI M. Quantitative evaluation of the severity of mitral insufficiency indogs by the color doppler method. J. Vet. Med. Sci., 1996, 58 ( 3 ), 249253 . 117 - WEBB AI, MAC MURPHY RM. Effect of anticholinergic preanesthetic medicaments on the requirement of halothane for anesthesia in the cat. Am. J. Vet. Res., 1987, 48 ( 12 ), 1733-1735 . 176