POLY-PREPAS Centre de Préparation aux Concours - Poly

POLY-PREPAS
Centre de Préparation aux Concours Paramédicaux
- Section i-Prépa -

I. Limites de la mécanique de Newton :
Au niveau macroscopique : un satellite peut graviter à une distance quelconque d’un astre.
D’après la mécanique de Newton, ce modèle dit : planétaire, affirme qu’il y a une infinité d’orbites
possibles et que l’on peut déterminer complètement le mouvement.
En revanche, au niveau submicroscopique, chaque atome a un volume bien défini donc le rayon
atomique d’un élément est précis ; on ne trouve pas les électrons d’un atome en orbite sur n’importe
quel rayon mais sur des couches bien définies , K, L, M, N…
⟹ le modèle planétaire ne peut s’appliquer à l’atome ; les Lois de Newton
ne sont plus valables dans le monde submicroscopique
II. Quantification des niveaux d’énergie :
1887 : expérience de Hertz, effet photo-électrique
Si l’on éclaire une plaque de zinc avec une lampe à incandescence, on ne relève aucun phénomène ;
quelle que soit sa puissance, il ne se passe rien, aucun électron n’est éjecté.
Si l’on éclairez maintenant la même plaque de zinc avec un rayonnement UV, on constate que même à
très faible puissance, des électrons sont éjectés.
Comment expliquer ce phénomène, dit : effet photo-électrique ?
1900 : Max Planck émet l’hypothèse que les échanges d’énergie ne se font pas de façon continue mais
par paquets, ou quantas, c’est-à-dire que chaque radiation lumineuse de fréquence transporte une
certaine quantité d’énergie
1905 : Einstein : « les quantas sont portés par des corpuscules de pure énergie, de masse nulle, et se
déplaçant à la vitesse de la lumière » : les photons
L’énergie d’un photon correspondant à une radiation de fréquence (et donc de longueur d’onde
= ) est donnée par la relation :
=
∶
=
=,..
1913 : Postulat de Bohr :
- Les variations d’énergie de l’atome sont quantifiées
- Les niveaux d’énergie sont quantifiés, l’atome ne peut exister que dans certains états d’énergie
bien définis ; les orbites sur lesquelles gravitent les électrons sont quantifiées

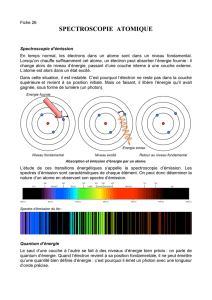
III. Absorption et émission de photon :
a) émission :
Un photon de fréquence est émis si l’atome passe d’un état d’énergie vers un état d’énergie plus
basse ; lors de cette transition, il y a émission d’énergie dans le milieu extérieur sous forme de
photons de fréquence telle que :
:
−
=
→
=
→
b) absorption :
De même, si un photon provenant du milieu extérieur est absorbé, l’électron change d’orbite et l’atome
passe d’un niveau d’énergie à un état d’énergie tel que :
−=→=
→

IV. Niveaux d’énergie de l’atome d’hydrogène H :
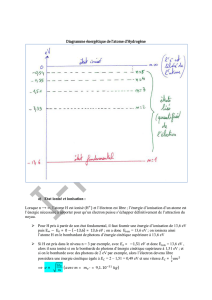
a) diagramme énergétique et niveaux d’énergie :
On appelle niveau fondamental le niveau de plus basse énergie, c’est là où l’atome est le plus stable.
Dans un diagramme énergétique, on prend comme origine O l’état maximal d’excitation, et l’on note :
=0. Les énergies des autres niveaux sont donc négatives.
Remarque : le rayonnement correspondant à la désexcitation du noyau-fils prend sa signification
ici : le noyau-fils est émis dans un état d’énergie excité, et revient à son niveau de repos (fondamental)
en émettant des photons ; pour le rayonnement , ces photons sont de très haute fréquence.
b) niveaux d’énergie de l’atome d’hydrogène H :
L’atome H possède 1 proton dans son noyau, donc 1 électron dans son cortège électronique. Le
modèle de Bohr appliqué à l’atome H postule qu’un électron gravite autour d’un noyau fixe à la
vitesse v sur des orbites précises, quantifiées, chaque orbite n étant définie par une énergie telle
que :
=
−
²
=
−
,
² avec n
>
0
(unité de
: eV)
ü n : premier nombre quantique ~ numéro de la couche énergétique sur laquelle orbite l’e
ü E:niveau fondamental : niveau d’énergie de l’atome lorsque l’électron est sur l’orbite la
plus stable, c’est-à-dire le niveau d’énergie la plus basse
Niveaux d’énergie de l’Hydrogène :
⎩
⎪
⎪
⎪
⎨
⎪
⎪
⎪
⎧
=∶ = − ,
²= −,
=∶ = − ,
²= −,
=∶ = − ,
= −,
...
= ∞∶ =

Diagramme énergétique de l’atome d’Hydrogène
c) Exemple-type :
Quelle est la fréquence et la longueur d’onde d’un photon résultant de la transition énergétique du
niveau à de l’atome d’Hydrogène ? On spécifiera le rayonnement émis.
On donne :1 = 1,602.10
Réponse :
− =ℎ→ ⟹ →=
= [
,(,)].,.
,. = 29,2.10
→=
→= 3.10
29,2.10= 102 , .
Remarque : −=
→ ⟹ à la plus petite variation d’énergie correspond la plus grande
longueur d’onde émise
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%