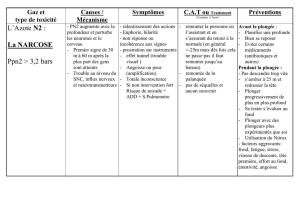
PHYSIOLOGIE DE LA PLONGEE

1
PHYSIOLOGIE DE LA PLONGEE
ACCIDENTS DE PLONGEE

2
Le cœur
I/ Rappels
Le cœur est un muscle qui bat de façon autonome dans la cavité
thoracique et qui a pour rôle d’assure la circulation sanguine dans l’organisme
affin de permettre les échanges entre les tissus et le milieu extérieur.
Y circulent en particulier, les gaz dissous.
On distingue classiquement deux circulations. La grande et la petite
circulation.
La grande circulation (circulation systémique) part du cœur gauche et
achemine vers les organes du sang riche en oxygène (O2) et pauvre en dioxyde
de carbone (CO2) via les artères et ramène du sang moins oxygéné et chargé de
CO2 via les veines pour retourner au cœur droit. Le sang s’appauvrit en O2 et
s’enrichit en CO2
La petite circulation (circulation pulmonaire) sert elle uniquement à
oxygéner le sang et le débarrasser du CO2. On retrouve un circuit cœur droit-
poumons-cœur gauche. Le sang s’enrichit en O2 et s’appauvrit en CO2.

3
II/ Cœur et plongée :
Schématiquement au cours de la plongée, il y a une redistribution du
volume vasculaire au profit de la petite circulation et une augmentation de la
tension artérielle. La fréquence cardiaque est ralentie. Il y a une diminution des
débits périphériques.
L’augmentation de la tension artérielle augmente la filtration rénale. On a
donc plus facilement envie d’uriner.

4
Biochimie des gaz
I/ Introduction
Rappels
Au niveau de la surface de la mer la pression atmosphérique est de 760
mm de mercure, ou 1 bar, ou une atmosphère (ATA) ou 105 Pascals.
Sous l’eau s’y additionne la pression hydrostatique. Soit 1 bar tous les 10
mètres. On parle alors de pression absolue.
L’atmosphère est composée de 21 % d’oxygène (O2) et de 79 % d’azote
(N2). La valeur du CO2 est négligeable avec 0,03 %.
Dissolution des gaz
Les gaz se dissolvent dans les différents tissus. La quantité dissoute et la
vitesse de dissolution varient suivant différents critères.
La quantité est régie par les lois de Dalton et Henry.
La loi de Dalton introduit la notion de pression partielle. La pression
partielle exercée par un gaz dans un mélange équivaut à celle qu’il exercerait s’il
occupait seul le volume total du mélange. Elle s’exprime par la formule : PP =
P.Abs. x X. (où P Abs est la pression absolue et X la quantité de gaz présent en
pourcentage). Ainsi à 20 mètre de profondeur la PP d’oxygène est de 0.63 bar
((1+2) x 0.21).
La loi de Henry dit que la quantité de gaz dissous à saturation dans un
liquide est proportionnelle à la pression partielle du gaz au contact du liquide.
Donc en plongée, plus le plongeur descend et plus la PP des gaz
augmente. Si en surface les gaz sont parfaitement tolérés il n’en va pas de même
en profondeur. L’azote comme l’oxygène deviennent toxiques et le CO2 atteint
des valeurs plus critiques.

5
II/ L’oxygène :
On parle d’hypoxie quand la pression partielle en oxygène est inférieure à
0.12 bar.
On parle d’hyperoxie lorsque la pression partielle en oxygène est
supérieure à 0.21 bar.
En plongée c’est l’hyperoxie qu’il faut redouter.
L’hyperoxie :
Effets cardiaques : cf supra
Effets pulmonaires :
Effet pneumo toxique de Lorrain Smith. Il apparaît au-delà de
0.5 bar (-14 m). -Toux,
-Brûlure rétro sternale
-Œdème pulmonaire.
La durée d’exposition doit être longue pour voir les troubles
s’installer donc pas courant en plongée loisir.
Effets Neurologiques :
Effet neurotoxique de Paul Bert. Il apparaît au-delà d’une
PPO2 de 1.6 bar (-67 m en mélange ou – 6 m en oxygène pur !). C’est une crise
d’épilepsie.
-phase prodromique : gêne respiratoire, anxiété,
crampes, secousses musculaires, anomalie du champs visuel
-phase tonique (corps raide)
-phase clonique (convulsions)
-phase résolutive
Il y a des variations individuelles. Certains sont plus sensibles que
d’autres.
Effets Oculaires :
Décollement de rétine et lésion vasculaire rétinienne.
ON NE DESCEND PAS À L’AIR EN DESSOUS DE 60 M
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%