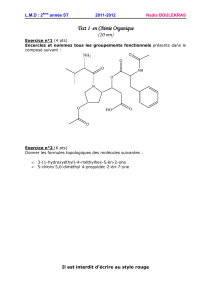
On étudie l`enregistrement du mouvement d`une balle lancée

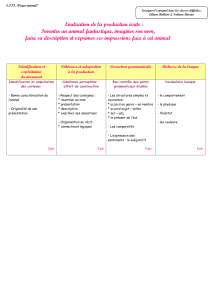
Le schéma ci-contre représente un projet de rover d’exploration
de la planète Mars élaboré par une classe de BTS.
On étudie le mouvement des roues dentées qui propulsent les
chenilles du rover.
On s’intéresse d’abord au mouvement du point A situé sur une
dent de la grande roue du rover, au point de contact entre la
chenille, la roue dentée et le sol.
La trajectoire du point A qui tourne dans le sens des aiguilles
d’une montre est reproduite à l’échelle 1/10e sur le document ci-
dessous. L’intervalle de temps entre chaque point vaut
= 40 ms.
1. Calculer la vitesse du point A aux positions A6, A12 et A18. (2 pts)
2. Tracer les vecteurs vitesse
v6
et
v12
et
v18
du point A. (2 pts)
3. Déterminer la vitesse de rotation de la grande roue du rover de rayon RA = 60,0 cm. (2 pts)
4. Calculer en expliquant le raisonnement la vitesse d’un point de la chenille. (1,5 pts)
5. En déduire la vitesse de rotation de la petite roue du rover, du rayon RB = 40,0 cm. (1,5 pts)
6. Quelle doit être la vitesse de rotation de la grande roue pour que le rover avance à 20 km.h-1 ? (1 pt)
Classe de 1S5 EVALUATION DE PHYSIQUE ET CHIMIE DUREE : 35 mn
A6
A12
A18
Cabine
Chenille
Roue avant
Roue arrière
A0
Echelle 1/10e
= 40 ms

Le chlorure de potassium est un solide ionique de formule statistique KCl(s). Il est utilisé dans les préparations
alimentaires en remplacement du sel de cuisine, qui est aussi constitué d’ions chlorures Cl-.
On utilise aussi le chlorure de potassium dans les engrais, par exemple en le mélangeant au sulfate de potassium.
On réalise tout d’abord une solution de chlorure de potassium notée S1 en dissolvant 10,0 g de chlorure de
potassium dans 1,0 L d’eau.
On donne :
M(O) = 16,0 g.mol-1 ; M(K) = 39,1 g.mol-1 ; M(Cl) = 35,5 g.mol-1 ; M(S) =32,1 g.mol-1 .
1. Ecrire l’équation de dissolution du chlorure de potassium dans l’eau. (1 pt)
2. Déterminer les concentrations molaires effectives des espèces dissoutes dans la solution de chlorure de
potassium réalisée. (2 pts)
On mélange ensuite cette solution S1 à une solution S2 de 1,0 L de sulfate de potassium de formule
2KSO4
2
et
de concentration en soluté apporté c2 = 1,0.10-1 mol.L-1. On obtient ainsi la solution S3.
3. Quelle est la formule statistique du sulfate de potassium solide ? (2 pts)
4. Déterminer la quantité de matière d’ions potassium en solution dans la solution S2. (3 pts)
5. Calculer la concentration effective en espèces dissoutes dans la solution S3. (2 pts)
PARTIE CHIMIE

1
/
3
100%