Correction des deux exercices de chimie

TERMINALES SCIENTIFIQUES SAMEDI 13 NOVEMBRE 2010
CORRECTION DU DEVOIR SURVEILLÉ DE SCIENCES PHYSIQUES
CHIMIE
EXERCICE 1 (6 points) : Autour du zinc.
1. L’équation de la réaction s’écrit : 2
(aq)
H
+ Zn (s) = H2 (g) +
2
(aq)
Zn
L’oxydant H+ du couple H+/H2 réagit avec le réducteur Zn du couple Zn2+/Zn.
2. On note ni(Zn) la quantité de zinc introduite et ni(H+) la quantité d’ions oxonium introduite. Le tableau descriptif de
l’évolution du système utilisant l’avancement est le suivant :
équation
2
(aq)
H
+ Zn (s) = H2 (g) +
2
(aq)
Zn
Etat du
système
Avancement
(mol)
Quantité de matière en mole
Etat initial
x = 0
ni(H+)
ni(Zn)
0
0
En cours
x
n(H+) = ni(H+) – 2x
n(Zn) = ni(Zn) – x
x
x
Etat final
xmax
nf(H+) = ni(H+) – 2xmax
nf(Zn) = ni(Zn) - xmax
xmax
xmax
La transformation est totale donc xf=xmax
Le réactif limitant est celui qui est entièrement consommé soit nf(H+) = 0 ou nf(Zn) = 0
nf(H+) = 0
ni(H+) – 2. xmax = 0
xmax = ni(H+)/2
xmax = CA.V / 2
A.N : xmax = 0,200 x 100x10-3/2
xmax = 1,00 x10-2 mol
On choisit la plus petite des deux valeurs. On en déduit que xmax = 1,00 x10-2 mol.
Le réactif qui correspond à la valeur retenue pour l’avancement maximal est le réactif limitant. Il s’agit ici de l’ion H+.
3. La quantité d’ions zinc (II) présente dans l’état final nf(Zn2+) est liée à l’avancement maximal par la relation :
nf(Zn2+) = xmax
La quantité d’ions zinc (II) dans l’état final est liée à la concentration des ions Zinc (II) dans l’état final par :
nf(Zn2+) = [Zn2+]f.V
On obtient xmax = [Zn2+]f.V
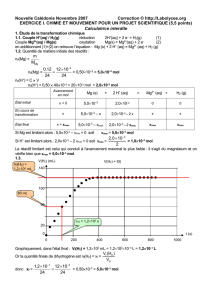
4. Le temps de demi-réaction t1/2 est la date à laquelle l’avancement a atteint la moitié de sa valeur finale xmax soit ici x1/2 =
xmax/2 = 5,00 x10-3 mol.
or [Zn2+] =
V
x
soit [Zn2+]1/2 =
V
x2/1
Pour [Zn2+]1/2 = 50,0 mmol.L-1 , on lit sur le graphe t1/2 = 4,1 min
5. Pour t = t1/2 , x1/2 = 5,00 x10-3 mol.
On en déduit alors les quantités des différentes espèces chimiques présentes dans le mélange réactionnel :
n1/2(H+) = ni(H+) – 2. x1/2 = CA.V - 2. x1/2 = 1,00 x10-2 mol
n1/2(Zn) = ni(Zn) – x1/2 = m(Zn)/M(Zn) – x1/2 = 3,0 x10-2 mol
n1/2(Zn2+) = x1/2 = 5,00 x10-3 mol
n1/2(H2) = x1/2 = 5,00 x10-3 mol considère t-on H2 présent ds le mélange ?
Pour t infini, la transformation est terminée et l’avancement maximal est atteint. On en déduit alors les quantités des
différentes espèces chimiques présentes dans le mélange réactionnel :
nf(H+) = ni(H+) – 2. xmax = 0 mol (réactif limitant)
nf(Zn) = ni(Zn) – xmax= 2,5 x10-2 mol
nf(Zn2+) = xmax= 1,0 x10-2 mol
nf(H2) = xmax = 1,0 x10-2 mol
6. La vitesse volumique
a. La vitesse volumique v de la réaction est la valeur de la dérivée de l’avancement par rapport à la variable temps à un
instant t divisée par le volume de la solution. On a la relation
t
dt
dx
V
1
v
nf(Zn) = 0
ni(Zn) - xmax = 0
xmax = ni(Zn)
xmax = m(Zn)/M(Zn)
A.N : xmax = 2,3 /65,4
xmax = 3,5 x10-2 mol

b. Dans le tableau descriptif de l’évolution du système, on peut voir que la quantité de zinc en cours de transformation
est égale à l’avancement x. On a donc : n(Zn2+) = [Zn2+].V = x
On en déduit que
t
2
t
2
tdt ]Zn[d
.V
dt ])Zn.[V(d
dt
dx
(on sort V de la dérivée car V est un constante)
On obtient
t
2
dt
Znd
v
c. La vitesse volumique de la réaction à un instant t est égale à la dérivée de la concentration des ions zinc (II) par
rapport au temps à cet instant t. Elle évolue donc comme le coefficient directeur de la tangente à la courbe [Zn2+] =
f(t) au point d’abscisse t.
d. La fonction représentant l’évolution de la concentration en ions zinc en fonction du temps est croissante et elle
admet une limite lorsque t tend vers +oo, prequ’atteinte à la date t = 20 min. On remarque que les valeurs des pentes
des tangentes à la courbe diminuent au cours du temps donc que la vitesse volumique de cette transformation décroît
au cours du temps.
7. Les facteurs cinétiques
a. Au fur et à mesure de la transformation les réactifs sont consommés, or la concentration des réactifs est un
facteur cinétique. Plus la concentration des réactifs est faible, plus la transformation évoluera lentement ce qui
permet d’expliquer l’allure de cette
courbe.
b. La température est un facteur
cinétique : plus elle est élevée, plus la
transformation est rapide. On atteint
donc plus rapidement l’avancement
final xmax = 5,00 mmol soit [Zn2+]1/2 =
50,0 mmol.L-1 sans pour autant que
cette valeur soit modifiée puisque la
transformation est toujours la même.
c. Si la transformation s’effectuait dans
un grand volume d’eau, cela signifie
que la concentration en ions H+ serait
plus faible. Or la concentration des
réactifs est un facteur cinétique :
plus la concentration est faible, plus la
transformation chimique est lente
donc des pentes plus faibles. De plus
l’asymptote serait plus basse car la concentration en ions zinc serait plus faible puisque le volume de la solution est
plus grand.
EXERCICE 2 (4 points) : réaction acido-basique.
Partie I - Solution de départ
1.1 Un acide au sens de Bronsted est une entité chimique susceptible de céder un ou plusieurs protons.
1.2 La solution étant corrosive, le port de gants et de lunettes est nécessaire.
Partie II - Accès à la valeur du taux d'avancement final par une mesure pH-métrique
2.1 On réalise une dilution. On prélève un volume V0 = 1,0 mL de solution-mère de concentration en acide
éthanoïque apporté c0 = 17,5 mol.L-1. On prépare un volume V = 500 mL de solution fille. On calcule
c1, la concentration molaire en acide éthanoïque apporté de la solution S1 :
On utilise la conservation de la quantité de soluté : c1.V = c0.V0
On en déduit : c1 = (c0.V0)/V = (17,5x1,0)/500 = 3,5.10-2 mol.L-1
La solution S1 a une concentration en acide éthanoïque apportée égale à 3,5.10-2 mol.L-1.
2.2
Ligne 1
Equation de la réaction
AH (aq) + H2O (l) = A- (aq) + H3O+ (aq)
2.3 On note x l'avancement de la réaction.

Ligne 1
Equation de la réaction
AH (aq) + H2O (l) = A- (aq) + H3O+ (aq)
Etat du système
Avancement
(mol)
n(AH)
(mol)
n(H2O)
(mol)
n(A-)
(mol)
n(H3O+)
(mol)
Ligne 2
Etat initial
0
c1.V
Solvant
0
0
Ligne 3
En cours de
transformation
x
c1.V - x
Solvant
x
x
Ligne 4
Etat final
xf
c1.V - xf
Solvant
xf
xf
Ligne 5
Etat maximal
xmax
c1.V - xmax
Solvant
xmax
xmax
2.4 Si l’acide éthanoïque est entièrement consommé alors c1.V - xmax = 0 et xmax = c1.V = 1,8.10-2 mol
2.5 On calcule la concentration des ions oxonium dans la solution S1 :
[H3O + ]1,f = 10-pH = 7,9.10-4 mol.L-1
On en déduit la valeur de l’avancement final :
x1f = V. [H3O + ]1,f = 500.10-3. 7,9.10-4 = 4,0.10-4 mol
2.6 x1f < xmax, la transformation associée à la réaction de l'acide AH sur l'eau est limitée.
2.7 Le taux d'avancement final d'une transformation chimique est le rapport de l’avancement final sur
l’avancement maximal.
2.8 On calcule le taux d'avancement final τ 1 de la transformation associée à la réaction de l'acide AH sur
l'eau :
τ 1 = x1f/ xmax = 4,0.10-4/1,8.10-2 = 0,023
2.9 Le taux d’avancement final τ 1 = 0,023 correspond à la mise en solution de l’acide éthanoïque dans l’eau.
1
/
3
100%