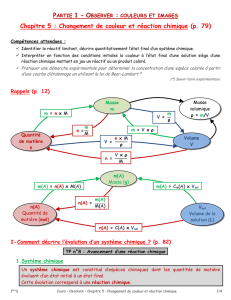
Fiche méthode : Utilisation du tableau d`avancement dans l

Méthode pour établir un tableau d’avancement
1- Ecris l’équation de la réaction après avoir repéré les réactifs et les produits pour décrire l’évolution au niveau
macroscopique du système chimique.
Ajuste les nombres stœchiométriques pour avoir conservation des éléments et de la charge électrique.
On précise en indice des formules, entre parenthèses, l’état physique de l’espèce chimique (s pour solide, l pour
liquide, g pour gaz, aq pour aqueux).
2- Dresse le tableau d’avancement pour décrire l’évolution des quantités de matière des réactifs et des produits
de l’état initial à l’état final :
Avancement
x en mol
Equation de la réaction :
REACTIFS PRODUITS
aA + bB cC + dD
Etat initial (Ei, en mol)
Etat intermédiaire
Etat final (Ef, en mol)
3- Remplis la ligne « Etat initial » en indiquant les quantités de matière initiales des réactifs (notées nA,i, nB,i),
celles-ci sont données ou calculées à partir des données de l’énoncé.
Rappel des formules pour calculer une quantité de matière :
Relation entre la quantité de matière et la masse : n = m/M (n en mol, m en g et M en g·mol-1)
M est la masse molaire atomique si l’espèce est un atome ou un ion monoatomique.
M est la masse molaire moléculaire si l’espèce chimique est une molécule ou un ion polyatomique, qui est égale à la
somme des masses molaires atomiques.
Relation entre la concentration molaire et la quantité de matière : C = n/V (C en mol·L-1, n en mol et V en L)
Relation entre la concentration massique et la masse : c = m/V (c en g·L-1, m en g et V en L)
4- Remplis la ligne « Etat intermédiaire » avec l’avancement x en tenant compte des nombres stœchiométriques
(notées a, b, c, d) devant les formules brutes (notées A, B, C, D) de l’équation de la réaction.
5- Remplis la ligne « Etat final » du tableau en remplaçant x par l’avancement maximal xmax.
6- Détermine l’avancement maximal xmax de la réaction, en déterminant le réactif limitant. L’autre réactif est
appelé réactif en excès.
La réaction est considérée comme totale, donc la transformation s’arrête lorsque l’un des réactifs A ou B est
complètement consommé :
- si A réactif limitant alors nA,i - a xmax = 0 mol - si B réactif limitant alors nB,i - b xmax = 0 mol
On résout les deux équations pour les réactifs et on conserve la plus petite valeur de xmax calculée :
- si A réactif limitant alors xmax = nA,i/a - si B réactif limitant alors xmax = nB,i/b
7- Pour faire le bilan de matière de l’état final, il faut calculer les quantités de matière des espèces présentes
dans l’état final avec la plus petite valeur de xmax calculée au 6- placée dans les équations n = f(x) de l’état final.
8- On peut être amené à déterminer les masses, les volumes, les concentrations molaires ou massiques des espèces
présentes dans l’état final.
Situation particulière :
Dans le cas où tous les réactifs sont limitants, le mélange est dit stœchiométrique, c’est-à-dire que les réactifs
sont dans les proportions de leurs nombres stœchiométriques et on a : xmax = nA,i/a = nB,i/b.

Méthode pour établir un tableau d’avancement
1- Ecris l’équation de la réaction après avoir repéré les réactifs et les produits pour décrire l’évolution au niveau
macroscopique du système chimique.
Ajuste les nombres stœchiométriques pour avoir conservation des éléments et de la charge électrique.
On précise en indice des formules, entre parenthèses, l’état physique de l’espèce chimique (s pour solide, l pour
liquide, g pour gaz, aq pour aqueux).
2- Dresse le tableau d’avancement pour décrire l’évolution des quantités de matière des réactifs et des produits
de l’état initial à l’état final :
Avancement
x en mol
Equation de la réaction :
REACTIFS PRODUITS
aA + bB cC + dD
Etat initial (Ei, en mol)
Etat intermédiaire
Etat final (Ef, en mol)
3- Remplis la ligne « Etat initial » en indiquant les quantités de matière initiales des réactifs (notées nA,i, nB,i),
celles-ci sont données ou calculées à partir des données de l’énoncé.
Rappel des formules pour calculer une quantité de matière :
Relation entre la quantité de matière et la masse : n = m/M (n en mol, m en g et M en g·mol-1)
M est la masse molaire atomique si l’espèce est un atome ou un ion monoatomique.
M est la masse molaire moléculaire si l’espèce chimique est une molécule ou un ion polyatomique, qui est égale à la
somme des masses molaires atomiques.
Relation entre la concentration molaire et la quantité de matière : C = n/V (C en mol·L-1, n en mol et V en L)
Relation entre la concentration massique et la masse : c = m/V (c en g·L-1, m en g et V en L)
4- Remplis la ligne « Etat intermédiaire » avec l’avancement x en tenant compte des nombres stœchiométriques
(notées a, b, c, d) devant les formules brutes (notées A, B, C, D) de l’équation de la réaction.
5- Remplis la ligne « Etat final » du tableau en remplaçant x par l’avancement maximal xmax.
6- Détermine l’avancement maximal xmax de la réaction, en déterminant le réactif limitant. L’autre réactif est
appelé réactif en excès.
La réaction est considérée comme totale, donc la transformation s’arrête lorsque l’un des réactifs A ou B est
complètement consommé :
- si A réactif limitant alors nA,i - a xmax = 0 mol - si B réactif limitant alors nB,i - b xmax = 0 mol
On résout les deux équations pour les réactifs et on conserve la plus petite valeur de xmax calculée :
- si A réactif limitant alors xmax = nA,i/a - si B réactif limitant alors xmax = nB,i/b
7- Pour faire le bilan de matière de l’état final, il faut calculer les quantités de matière des espèces présentes
dans l’état final avec la plus petite valeur de xmax calculée au 6- placée dans les équations n = f(x) de l’état final.
8- On peut être amené à déterminer les masses, les volumes, les concentrations molaires ou massiques des espèces
présentes dans l’état final.
Situation particulière :
Dans le cas où tous les réactifs sont limitants, le mélange est dit stœchiométrique, c’est-à-dire que les réactifs
sont dans les proportions de leurs nombres stœchiométriques et on a : xmax = nA,i/a = nB,i/b.
1
/
2
100%