Thème 1 : Communication nerveuse

1
Thème 1 : Du génotype au phénotype
Chapitre 1 : Le Phénotype dépend des protéines
Acquis :
Fonctionnement de l’organisme
Au cours de la digestion, le molécules de grosse taille et de nature variée contenues dans les
aliments sont fragmentées en un nombre réduit de petites molécules : les nutriments. Cette
simplification moléculaire s’effectue sous l’action d’enzymes
Selon leur information génétique les cellules produisent à partir des nutriments de nouvelles
molécules nécessaires à leur renouvellement : c’est l’assimilation.
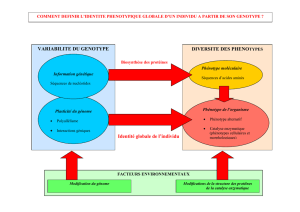
Unité et diversité des êtres vivants
Chaque individu présente les caractères de l’espèce à laquelle il appartient avec des variations
qui lui sont propres. C’est le résultat de l’expression de son programme génétique et de
l’influence de l’environnement.
Les chromosomes portent les gènes, unités d’information génétique qui déterminent les
caractères héréditaires.
Quelles relations peut-on établir entre les caractères héréditaires et les protéines dans la
mesure où ils dépendent tous les deux directement des gènes ?
Comment les enzymes contribuent elles à la diversité des phénotypes ? La catalyse
enzymatique est elle un phénomène commun à tous les processus biologiques ?
Pourquoi dit-on que les enzymes ont une double spécificité ?
I. Le phénotype à l’échelle de l’organisme
Comment s’exprime le phénotype à l’échelle de l’organisme ?
Observations : photo 124
Doc 1 p126
Doc 1 p 128
Doc 1 p 130
L’ensemble des caractères observables d’un individu constitue le phénotype. Ces caractères
sont morphologiques, physiologiques ou biochimiques.
Pour la mucoviscidose : cara
Pour l’albinisme : cara
Pour la drépanocytose : cara
Pour chaque caractère, il existe des phénotypes variés :

2
- La peau est plus ou moins pigmentée selon les individus et ne l’est pas du tout chez les
albinos
- Un individu peut être en bonne santé ou bien malade.
II. Le phénotype à l’échelle de la cellule
Comment s’exprime le phénotype à l’échelle de la cellulee ?
Observations : Doc 2 p126
Doc 2 p 128
Doc 2 p 130
Des caractères propres et observables au niveau des cellules.
Ces caractères concernent l’aspect, la forme, la taille, la couleur…
- Hématies déformées : cellules drépanocytaires, en forme de disque biconcave chez
sujet sain.
- Les mélanocytes sont colorés chez sujet sain et pas chez sujet albinos.
- Les cellules épithéliales fabriquent un mucus fluide chez sujet sain, alors qu’il est
visqueux chez sujet atteint de mucoviscidose.
III. Le phénotype à l’échelle des molécules
Comment s’exprime le phénotype à l’échelle de la molécule ?
Observations : Doc 3 p126
Doc 3 p 128
Doc 3 p 130
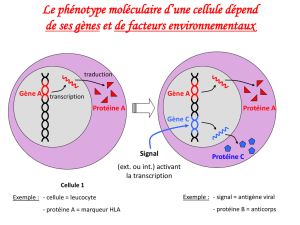
- Pour la drépanocytose : L’implication des protéines dans la réalisation du phénotype
moléculaire est directe : en effet les phénotypes différents concernent la protéine : il y a
2 sortes d’hémoglobines : HbA et HbS
- Pour la mucoviscidose l’implication des protéines dans la réalisation du phénotypes
moléculaires est indirecte : en effet les différences de structure des protéines entrainent
des phénotypes moléculaires variés qui concernent d’autres molécules que les
protéines : la protéine CFTR permet le flux d’ions Cl- ans les cellules épithéliales si elle
n’est pas exprimée le flux de Cl- ne se fait pas, ce qui entrainera un épaississement du
mucus.
- Pour l’albumine : l’implication est aussi indirecte : en effet si toutes les protéines sont
exprimées, la mélanine est synthétisée à partir de la Tyrosine, si une ou plusieurs
protéines ne sont pas exprimées, la mélanine n’est pas synthétisée.
Donc les phénotypes variés à l’échelle moléculaire sont responsables des phénotypes à
l’échelle des cellules.
L’HbA est soluble dans les hématies qui ont leur forme en disque biconcave, l’HbS est peu
soluble, il s’agglutine et crée des structures fibreuses qui déforment les hématies.
La mélanine est ou n’est pas exprimée donc les mélanocytes sont ou ne sont pas pigmentés.
Le flux de Cl- dans les cellules épithéliales rend le mucus fluide, si ce flux est absent, le
mucus est épais et visqueux.

3
Les protéines sont responsables des différents caractères exprimés à l’échelle moléculaire.
Elles sont à l’origine des différents niveaux d’expression du phénotype.
Quelle est la structure d’une protéine ?
IV. Structure d’une protéine
Observation doc 1 et 2 p132 133
Une protéine est une molécule réalisant une fonction biologique précise : L’Hb transporte
le dioxygène
La myosine intervient dans la contraction musculaire
La lactase est une enzyme permettant la digestion du sucre contenu dans le lait….
Une protéine est toujours constituée d’un enchaînement d’aa. Leur nombre varie d’une
protéine à l’autre. Il existe 20 aa différents => grande diversité de protéines dans le monde
vivant, car l’enchaînement de 100 aa offre en théorie 20 100 possibilités pour l’ordre dans
lequel se succèdent ces aa.
Selon la nature et la séquence des aa, la molécule protéique se replie en structures
particulières : hélice alpha, feuillets bêta, boucles.
Ce sont les liaisons énergétiques établies entre les aa qui donnent à la protéine sa structure
spatiale.
Une protéine peut être formée de plusieurs chaînes d’aa ou chaînes polypeptidiques.
De la structure spatiale d’une protéine dépend la fonction de cette protéine.
L’enchaînement des aa constitutifs d’une protéine est réalisé grâce à des liaisons
peptidiques qui unissent les aa entre eux. C’est la structure primaire de la protéine. C’est
cette structure qui conditionne la forme spatiale de la protéine par la constitution d’autres
liaisons chimiques entre aa voisins. Ces liaisons covalentes (l hydrogène), liaisons ioniques
(entre aa chargée) amènent la cohésion de la molécule.
Qu’est ce qui modifier la structure d’une protéine ?
Doc 3p133 et obs faites sur les trois cas moléculaires étudiés.
L’anticorps est une protéine qui a pour fonction l’élimination d’un antigène donné. Pour
cela la forme de l’AC et celle de lAG sont complémentaires.
Toute modification de la séquence des aa de certaines zones de l’anticorps modifie sa
capacité à se lier à l’antigène et doonc à l’éliminer.
Exercices sommatif : en classe n°5 p137
Evaluation 3 p37 Bordas

4
Chapitre 2 : Des protéines indispensables à la réalisation d’un
phénotype : les enzymes
Les protéines assurent des fonctions variées (P de structure cellulaire, P enzymatique, P
hormonales) et sont donc responsables de la variabilité des phénotypes.
Les enz sont des protéines qui interviennent dans de très nombreuses réactions et sur
beaucoup de molécules. Elles sont fabriquées par des êtres vivants, elles sont spécifiques dans
leur fonction : on dit que ce sont des biocatalyseurs.
Pb : Qu’est ce qu’un catalyseur ?
Quelles sont les propriétés des biocatalyseurs ?
Comment explique leur activité spécifique ?
Quelles relations existe-t-il entre enz et phénotype ?
I. Les enzymes, des biocatalyseurs
Observation : TP1 hydrolyse de l’amidon par l’amylase
1) Observation « in vivo » : mastiquer longuement un morceau de pain : gout sucré dans la
bouche
Transformation de l’amidon par hydrolyse en une plus petite molécule glucidique : le
maltose.
La salive est le suc digestif qui permet cette transformation.
Etude du tableau doc 1 p 140
La comparaison de la composition chimique des salives de 2 groupes d’individus différents
montre que dans un groupe, la salive ne contient pas d’amylase.
2) Observation in vitro de l’hydrolyse de l’amidon par l’amylase
Hydrolyse : l’amidon est une macromolécule, formée de n glucoses. L’amylase est l’enzyme
qui va la couper en glucose.
Cf poly de résultats TP1
Protocole expérimental :
t0 => tube 1 : empois d’amidon
=> tube 2 : empois d’amidon les deux tubes placés au bain marie
Test à la liqueur de Fehling => résultats
t2 =>T2 + 1 ml amylase
Test à l’eau iodée immédiat
Puis toutes les trois minutes =>virée de couleur dans T2

5
t20 => faire un test à la liqueur de fehling
3) Observation in vitro de l’hydrolyse de l’amidon par HCl
Protocole expé : empois d’amidon + HCl => 2h
Prélever toutes les dix minutes et traité à l’eau iodée et à la liqueur de Fehling
Les enzymes sont des catalyseurs biologiques : elles interviennent dans les réactions
chimiques du vivant en augmentant la vitesse de réaction tout en se trouvant intacts à la fin de
celle-ci.
Les propriétés de toutes les enzymes sont :
- elles accélèrent les réactions qui se font, en général beaucoup plus lentement
- elles agissent à faible concentration
- on les retrouve intactes après la réaction.
Ce sont donc des catalyseurs des réactions de catalyse. Vu qu’elles interviennent dans de
nombreuses réactions cellulaires et extra cellulaires, ce sont des biocatalyseurs.
Faire TP 1 et 2 notés
II. La double spécificité des enzymes
Observation : doc 1 p142
Test quantité de glucose
Quand le test baisse => la catalyse se fait
Quand on remplace le glucose par galactose ou saccharose : quantité de O2 ne baisse pas =>
pas de catalyse, la gucose oxydase ne permet pas la réaction.
La glucose oxydase n’agit pas que sur le glucose
Quelle action spécifique est ainsi mise en évidence ?
1) Spécificité du substrat
On appelle substrat, la molécule dont l’enzyme catalyse la transformation. Une enzyme
donnée ne peut agir que sur un seul substrat.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%