Chapitre 4

Classe de BTS AB2
1
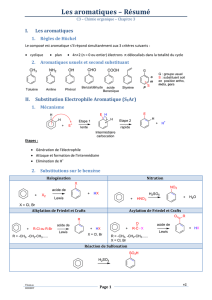
Chapitre de Chimie n°5
Les hydrocarbures aromatiques
I- Présentation des hydrocarbures aromatiques
Ces hydrocarbures sont des composés dont la formule dérivent de celle du benzène :
1- Nomenclature
Quand le groupe benzènique est un substituant, il prend le nom de substituant phényl.
Exemple : Acide 2-méthyl-3-phénylpropanoïque
Quand le groupe benzènique est la fonction principale, il garde le nom de benzène
Exemple : 1,3,5-triméthylbenzène
2- Réactivité
Les cycles aromatiques ont une structure particulière : Les trois liaisons doubles ne sont pas localisées entre des atomes de
carbone en particulier, mais délocalisées sur l’ensemble des atomes de carbone.
Cette délocalisation, procure au cycle benzénique une stabilité particulière.
Lors des réactions, on a donc toujours restauration de ce cycle pour retrouver cette stabilité.
Les oxydants, même forts, qui coupent les alcènes, coupent très rarement ce cycle.
II- Nitration par substitution électrophile
1- Bilan
Un mélange d’acides nitrique et sulfurique concentrés (mélange sulfonitrique) provoque une nitration : remplacement d’un H par
un groupe nitro NO2 : On obtient un dérivé nitré.
L’acide sulfurique assure le rôle de catalyseur, en favorisant la formation du réactif électrophile NO2+ :
2- Mécanisme
Première étape : Addition électrophile du réactif NO2+

Classe de BTS AB2
2
Deuxième étape : Perte du proton et restauration de la double liaison
Cette réaction est appelée en raison de la première étape une substitution électrophile
On obtient le mononitrobenzène, un liquide employé en parfumerie pour son odeur d’amande.
Remarque : Si on reproduit cette réaction plusieurs fois, on peut obtenir jusqu’au 1,3,5-trinitrobenzène (voir règle de Holleman).
Il s’agit d’un solide utilisé comme explosif, de même pour le 2,4,6-trinitrotoluène, aussi appelé T.N.T. :
1,3,5-trinitrobenzène 2,4,6-trinitrotoluène
III- Alkylation et acylation par substitution électrophile
1- Alkylation
a- Bilan
L’alkylation est la substitution d’un H par un groupe alkyle R : elle permet donc de lier une chaîne latérale sur un cycle.
On utilise pour cela comme réactif un halogénure d’alkyle RX, en présence de chlorure d’aluminium comme catalyseur :
Le chlorure d’aluminium favorise la rupture de la liaison C-Cl et la formation du réactif électrophile R+, par la réaction :
Il est ensuite régénéré par réaction avec le proton libéré :
b- Mécanisme
Le mécanisme est le même que le précédent en remplaçant le réactif NO2+ par R+
Inconvénient de cette réaction : Il est difficile de s’arrêter à la substitution d’un seul H.

Classe de BTS AB2
3
2- Acylation
a- Bilan
L’acylation est la substitution d’un H par un groupe acyle R-CO : on obtient donc une cétone de la forme Ar-CO-R.
On utilise pour cela comme réactif un chlorure d’acyle R-COCl, en présence de chlorure d’aluminium comme catalyseur :
Le chlorure d’aluminium favorise la rupture de la liaison C-Cl et la formation du réactif électrophile R-C=O+, par la réaction :
Il est ensuite régénéré par réaction avec le proton libéré :
b- Mécanisme
Il est strictement identique au précédent. On obtient :
IV- Règle de Holleman
1- Positions pour un cycle benzénique
Considérons un cycle benzénique substitué par un substituant R. On peut définir les différents carbones grâce à leur position
par rapport à ce substituant :
Exemples : Dans le TNT, les trois substituants nitro sont positionnés en méta les uns par
rapport aux autres.
Dans cette molécule, le 1-chloro-2-nitrobenzène, le substituant chlore et le
substituant nitro sont en ortho l’un par rapport à l’autre.
2- Observations
On part d’une molécule de benzène, sur laquelle on réalise une première substitution, on obtient le méthylbenzène, ou toluène :

Classe de BTS AB2
4
On effectue ensuite une deuxième substitution, dans le but d’ajouter un substituant chlore, par exemple. Cette substitution peut
à priori conduire aux trois isomères suivants :
Isomère ortho Isomère méta Isomère para
Si on se base sur les statistiques, étant donné qu’il y a une position para, deux positions ortho et deux positions méta, on
devrait obtenir 40% d’isomère ortho, 40% d’isomère méta et 20% d’isomère para.
Or, on n’obtient pas les trois isomères dans ces proportions : on obtient majoritairement les isomères ortho et para et une
proportion négligeable d’isomère méta : On dit que cette substitution est régioséléctive, c‘est-à-dire que certaines positions
du cycle benzénique sont substituées préférentiellement à d’autres : ici, les positions ortho et para sont préférées à la
position méta.
De façon générale, on observe que la présence d’un premier substituant oriente la substitution du deuxième substituant.
On observe aussi que la présence d’un premier substituant peut modifier de façon très importante la vitesse d’une
deuxième substitution : certains l’accélèrent (ils sont activants), d’autres la ralentissent (ils sont désactivants).
3- Classement des substituants
L’ensemble des résultats expérimentaux connus à ce sujet a conduit à formuler une règle empirique, connue sous le nom de
règle de Holleman :
Les divers substituants que peut porter un cycle benzénique se classent en deux groupes, selon la façon dont ils orientent une
substitution :
Substituants ortho/para-orienteurs
o Activants : -OH, -NH2, -R(groupes alkyles), -OR
o Désactivants : -F, -Cl, -Br, -I
Substituants méta-orienteurs
o Désactivants : -NO2, -COOH, -CH=O, -CO-R, -CN, -SO3H
Exemple : Nitration comparée de quatre composés benzéniques
Composé
Vitesse relative par
rapport au benzène
% de mélange ortho
+ para
% de méta
Nom
Formule
Phénol
C6H5-OH
1000
98
2
Toluène
C6H5-CH3
25
95
5
Chlorobenzène
C6H5-Cl
0,3
99
1
Nitrobenzène
C6H5-NO2
0,0001
6
94
Remarque :
Ce sont les effets inductifs ou mésomères qui permettent d’expliquer le fait que tel ou tel substituant soit méta-orienteur ou
ortho/para-orienteur. Ces deux effets sont liés à la « densité électronique » de chaque substituant, par exemple, un
substituant –OH est riche en électrons, avec ses deux doubles non-liants sur l’oxygène, alors qu’un
substituant -NO2 est pauvre en électron (l’azote porte une charge +, dans la représentation de Lewis
ci-contre).
Un substituant OH va donc « donner » sa densité électronique au cycle sur les positions ortho et
para (ce ne sont pas des charges réelles, mais des charges partielles -)
Il va donc favoriser la substitution d’un électrophile (chargé +), tel que R+ ou NO2+ sur les positions
ortho et para, puisque la charge + de l’électrophile est attirée par la charge - du cycle.
A l’inverse pour un substituant NO2, qui est déjà pauvre en électron et qui va donc attirer vers lui les
électrons du cycle benzénique pour essayer de se stabiliser, il va ainsi créer des charges partielles
+, sur les positions ortho et para du cycle (ci-contre).
Il va donc défavoriser la substitution d’un électrophile sur les positions ortho et para, puisque la
charge + de l’électrophile et les charges partielles + du cycle vont se repousser. Par conséquent, la
substitution en méta va être favorisée.
1
/
4
100%