Texte du contrôle

Mardi 23 Novembre Contrôle n° 2 Physique & Chimie
Durée : 1 heure. L’usage de la calculatrice est autorisé
L’énoncé devra être rendu avec la copie
Note importante : Une présentation soignée de la copie est indispensable ; il n’y aura pas de
bonus pour les copies correctement présentées mais un malus (pouvant atteindre 5 points) dans
le cas contraire.
EXERCICE 1 : Mesurer son rythme cardiaque ( ………../ 7 points)
Les troubles du rythme cardiaque* sont une famille de maladies cardiaques. Chez l'adulte en bonne santé,
au repos, le pouls se situe entre 50 (sportif pratiquant l'endurance) et 80 pulsations par minute.
Pour établir son diagnostic, le médecin peut avoir recours à des examens s’appuyant sur l’utilisation de
phénomènes électriques. L’électrocardiogramme en est un exemple.
Le tracé suivant est un électrocardiogramme obtenu par enregistrement des signaux électriques émis par le
muscle cardiaque (coeur) d’un patient.
Le rythme cardiaque est le nombre de pulsations par minute. On parle également de la fréquence
cardiaque qui est le nombre de pulsations par seconde.
Questions :
1°) Définir la période d’un phénomène périodique.
2°) Exprimer la fréquence d’un phénomène périodique en fonction de sa période.
3°) Donner la grandeur mesurée sur l’axe horizontal ? Sur l’axe vertical ?
4°) Dire ce qui permet d’affirmer que le signal est périodique. Repasser en couleur un motif du signal
périodique.
5°) Déterminer la période T des battements cardiaques du patient en expliquant la méthode employée
afin d’obtenir un résultat le plus précis possible.
6°) Déterminer la fréquence cardiaque f du patient et l’exprimer en Hz.
7°) Déterminer son rythme cardiaque R.
8°) Dire, en le justifiant, si ce patient a un rythme cardiaque normal.
EXERCICE 2 : Que se passe-t-il quand la lumière passe de l’air à l’eau ? ( ……../ 4 points)
Compléter et légender le plus complètement possible le schéma suivant :
50 ms/.mm
10 V/.mm
0,5
0,5
1
1
1,5
1
1
0,5
eau
air

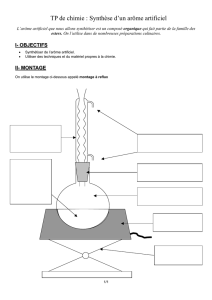
EXERCICE 3 : extraction et identification ( ………../ 9 points)
Le but de cet exercice est d’étudier le principe d’extraction de l’huile essentielle contenue dans un bâton de
cannelle, de réaliser ensuite sa synthèse puis d’identifier par chromatographie les espèces chimiques
obtenues.
I - Extraction par solvant.
Protocole expérimental :
Dans un erlenmeyer de 100 mL, mettre de la poudre issue d’un bâton de cannelle puis ajouter sous
la hotte 20 mL de cyclohexane. Boucher puis agiter.
Filtrer, puis verser le filtrat dans une ampoule à décanter.
Laver avec 10 mL d'eau, bien agiter, dégazer, puis laisser décanter.
Recueillir la phase organique dans un flacon (noté A) et le conserver pour une analyse
chromatographique (voir III).
Cyclohexane
Dichlorométhane
Densité
0,71
1,33
Miscibilité avec l’eau
Nulle
nulle
1) Quels critères essentiels doit posséder un solvant pour être utilisé dans cette extraction ?
2) Définir la densité d’un liquide.
3) Faire un schéma du contenu de l’ampoule à décanter. On justifiera la position relative des deux phases
et on indiquera le contenu de chaque phase observée.
II - Synthèse de l’huile essentielle d’un bâton de cannelle
Dans un tube à essai introduire environ 0,4 g de soude en pastille et 2 cm3 d’éthanol.
Agiter puis refroidir 5 min dans la glace.
Sous la hotte ajouter : 1 mL de benzaldéhyde et 0,5 mL d’éthanal. Boucher le tube à essai puis agiter
10 minutes.
On récupère le produit de synthèse dans un flacon (noté E) pour une analyse chromatographique.
Données :
Noms
Formules chimiques
Masse volumique
( g/cm3)
Température de fusion
Température d’ébullition
Soude
NaOH
2,13
324 °C
1390 °C
Ethanol
C2H6O
0,80
-112 °C
79 °C
Benzaldéhyde
C7H6O
1,04
-26 °C
179 °C
Ethanal
C2H4O
0,78
-123 °C
20 °C
1) Pourquoi refroidit-on le tube à essai avant d’introduire l’éthanal ?
2) Rappeler la définition de la masse volumique puis calculer la masse de 1 cm3 de benzaldéhyde. On
rédigera et on expliquera soigneusement la réponse.
III - Chromatographie
On effectue sur une plaque de chromatographie cinq dépôts :
Après élution puis révélation sous UV on obtient la plaque chromatographique ci-dessus.
1) Donner le nom des deux traits tracés sur la plaque.
2) Le produit issu de l’extraction par solvant est-il pur ? Justifier votre réponse.
3) Identifier le nom de l’arôme constituant l’huile essentielle de la cannelle. Justifier.
4) L’analyse chromatographique du produit de synthèse obtenu au II montre qu’il contient d’autres
espèces chimiques que l’arôme. Peut-on les identifier : si oui, donner leurs noms. Justifier.
5) Définir le rapport frontal d’une espèce chimique.
6) Calculer le rapport frontal de l’anéthole.
A B C D E
1
1
1,5
1
1
0,5
1
0,5
0,5
0,5
0,5
Tache A : produit issu de l’extraction par
solvant du I
Tache B : anéthole (arôme naturel pur)
Tache C : cinnamaldéhyde (arôme naturel pur)
Tache D : benzaldéhyde (arôme naturel pur)
Tache E : produit de synthèse obtenu au II.
1
/
2
100%