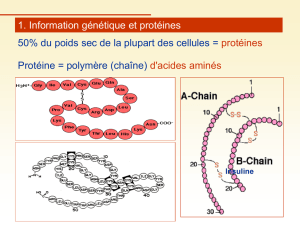
Table de codon de l`ARN

1
Chapitre
2.5
Les enzymes
Attentes
2.5.1. Les enzymes ont un site actif sur lequel des substrats spécifiques
viennent se fixer.
2.5.2. La catalyse enzymatique implique le mouvement moléculaire et la collision
de substrats avec le site actif.
2.5.3. La température, le pH et la concentration du substrat affectent le taux
d’activité enzymatique.
2.5.4. Les enzymes peuvent être dénaturées.
2.5.5. Les enzymes immobilisées sont largement utilisées dans l’industrie.
Rappel :
ENZYMES agissent comme CATALYSEUR
Ne peuvent causer la réaction
Peuvent seulement augmenter le taux de réaction
À la température normale, plusieurs réactions auraient un taux si lent, que sans
enzyme, il n’y aurait pas de changement pas de vie

2
Facteurs qui influencent les réactions catalysées par les enzymes.
Température
pH
Concentration du Substrat
Effet de la température. (Optimum à 37oC -- Corps Humain -- Fièvre)
Temp. Mouvement des molécules Collision
Alors énergie (avec ou sans enzymes)
Mais les réactions qui utilisent les enzymes ont des limites puisque les enzymes
peuvent perdent leur forme DÉNATURATION
Permanente Temporaire
Dépend des liaisons peptidiques.
Perte de
forme
Augm. des
collisions

3
Échelle du pH.
C’est quoi le pH. (Échelle logarithmique)
La concentration des ions H+
Donc,
Eau = pH= 7.0 = (H+) = 1 x 10-7 mol/L
Alors si la tomate est :
Tomate = pH= 4.0 = (H+) = 1 x 10-4 mol/L
Ce qui veut dire que la tomate est 1000 fois plus acide que l’eau
1 x 10-4 mol/L = 1000 x 10-7
= 103 x 10-7
= 10-4

4
Effet du pH. (Majorité au pH = 7)
Le site actif d’un enzyme contient plusieurs acides aminés de la protéine.
Ceux-ci sont chargés soit POSITIVEMENT (+)
soit NÉGATIVEMENT (-)
Les charges du substrat sont attirées = par les charges opposées du site
actif.
Si la solution est très acide, les ions H+ peuvent se lier au site actif ou au
substrat
Enzyme moins efficace
Perte de forme de l’enzyme
DÉNATURATION
Aucun pH n’est spécifiquement optimum pour les enzymes. Ça dépend
des enzymes.
Majeure partie des enzymes pH = 7
Estomac – Pepsine pH = 2
Paroi de l’intestin grêle - Trypsine pH = 8
.

5
Figure 3.15
Site internet intéressant
http://heinenmann.co.uk/hotlinks
http://www.phschool.com/science/biology_place/biocoac
h/transcription/tcproc.html
http://www.wiley.com/legacy/college/boyer/0470003790/
animations/animations.htm
http://www.johnkyrk.com/DNAreplication.html
Exercice No 15 :
Imaginez que l’ARNm quitte le noyau d’une cellule eucaryote avec la séquence
de bases : AUGCCCCGCACGUUUCCAAGCCCCGGG. Localiser un tableau
des codons de l’ARNm
(On peut en trouver un au site http://www.pearsonhotlinks.co.uk/ Choisissez le
code 4273P et le weblink 3.6.)
a. Déterminer les acides aminés codés dans la séquence fournis par
l’ARNm?
b. Déterminez le code de l’ADN qui a donné la séquence des nucléotides de
l’ARN?
 6
6
 7
7
1
/
7
100%