Télécharger le fichier - Fichier

2016-2017 Chimie organique
Correction sujet de Janvier 2016
– UE VI: Voies d'accès aux substances médicamenteuses–
Semaine : n°13 (du 28/11/16 au
04/12/16
Date : 28/11/2016
Heure : de 8h00 à
10h00 Professeur : Pr. Willand
Binôme : n°46 Correcteur : n°54
Remarques du professeur : pas de remarques
PLAN DU COURS
I) Exercice 1
II) Exercice 2
III) Exercice 3
1/6

2016-2017 Chimie organique
IV) Exercice 1
Question 4
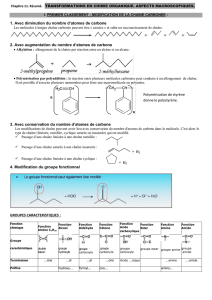
La sérine est un AA dont la chaîne latérale est CH2 – OH. La configuration du C est S (G : NH2, M :
COOH, P : chaine latérale, μ: H ).
La fonction biologique d'une protéase est de couper une enzyme en un brin aminé et un acide
carboxylique.
Question 5
A gauche, on a un hétérocycle où on ne trouve pas de carbones électrophiles mais plutôt des carbones
nucléophiles. Ensuite, on a une fonction amide avec un carbone électrophile mais un amide est
l'électrophile le plus faible donc le caractère électrophile n'est pas marqué. Les CH3 ne sont pas
électrophiles du tout. On a encore des liaisons amides. Enfin, il nous reste une liaison nitrile. C'est là que
se trouve le carbone électrophile.
Dans la protéase, on a la chaîne latérale de la sérine. Dans la cavité de l'enzyme, c'est l'inhibiteur qui va
entrer. Il va se placer de telle sorte que le nitrile soit à proximité de l'oxygène. L'hydroxyle de la sérine va
s’additionner sur le carbone E+. les e- pi vont se déplacer sur l'azote qui récupère le proton porté par l'O
et on va former une liaison covalente entre l'O et le carbone E+. C'est une réaction irréversible. Du fait de
la liaison covalente, l'enzyme est bloquée et la sérine ne peut plus cliver les liaisons peptidiques.
2/6

2016-2017 Chimie organique
V) Exercice 2
Question 1
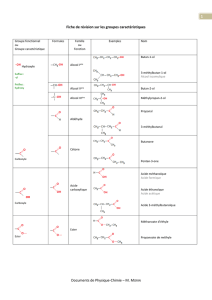
Le composé au-dessus de la flèche possède une amine, une fonction carbamate et un groupement BOC
donc l'amine est protégée. Ici, on a une Nu+. Le carbone relié à un halogène (Nf) joue le rôle d'E+.
L'amine va venir substituer le C portant l'halogène.
Le Nu- vient attaquer l'E+ et on a le départ du Nf (Cl-). On la formation d'une liaison sigma entre l'azote et
le carbone. Cl- va venir arracher un proton porté par l'azote pour conduire à un produit qui n'est plus
chargé.
Le produit A sera neutralisé par une B.
En milieu acide, l'amine peut se protoner mais le groupement BOC va partir. Donc en milieu acide, on a
déprotection de l'amine terminale. B est le produit de déprotection de A.
B va réagir avec l'acide carboxylique. On devra utiliser un agent d'activation pour cela.
Question 4
On va pouvoir utiliser :
–Carbodiimide : substitué sur ses atomes d'azotes par des groupements R
–Di-cyclo-hexyl-carbodiimide (DCC)
3/6

2016-2017 Chimie organique
Question 5
On va partir d'une acide carboxylique. Il nous faut d'abord la présence d'une base pour déprotoner l'acide
et obtenir le carboxylate (Nu-). Ce dernier va réagir avec le carbodiimide. Les atomes d'azotes tirent les
e- donc le carbone est δ+. On peut délocaliser l'une ou l'autre des liaisons. Le Nu- vient s’additionner sur
le C E+ et on délocalise les doublets d'électrons vers l'un des deux atomes d'azote. On forme donc une
liaison covalente entre l'O et le carbone E+. La base va redonner le proton à l'azote chargé -. On forme
donc un ester activé. La seule réaction possible est la formation d'une liaison amide par réaction entre un
Nu- et un E+. Le proton porté par l'amine vient sur le Nf.
Si on fait réagir l'acide avec l'amine directement, l'amine va réagir avec le proton et va former un
sel : RCOO- et NH3+- R'. +++
4/6

2016-2017 Chimie organique
VI) Exercice 3
Question 1
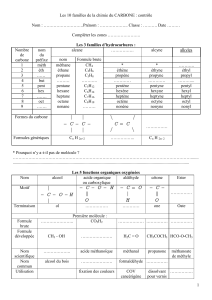
le but est de retrouver la pipérazine. On trouve 4 hétérocycles :
–Hétérocycle à sommets qui est saturé avec un soufre et un azote = thiazolidine
–Hétérocycle en 2ème position = pyrrolodine
–Hétérocycle à 6 sommets = pipérazine
–Hétérocycle = pirazole
La conformation la plus stable d'un cyclohexane est la conformation chaise. Donc la conformation la plus
stable de la pipérazine est la conformation chaise avec des substituants en position équatoriale.
Question 2
On a 4 e- via les liaisons pi. On a un atome d'azote qui présente un dnl qui peut aller dans le cycle. On a 4
atomes de carbone et deux atomes d'azote qui sont à l'état d'hybridation sp². On a donc bien un
hétérocycle aromatique.
5/6
 6
6
1
/
6
100%