http://www2

http://www2.univ-reunion.fr/~briere/chimexp/th11.htm
Classification électrochimique des métaux
Produits et Matériel :
Solutions 0,1 M de Zn2+ ; Cu2+ ; Fe2+ ; Ag+ - Solution 1M de CuSO4 -
Lames de : Zinc ; Fer ; Cuivre et Argent (2 de chaque) - Electrodes de Graphite (2) -
Fil de Platine ou Electrode de Platine - Zinc en Grenaille - Zinc en poudre - Fer en
poudre - Cuivre en tournure - Cuivre en Poudre - Solution de Soude 2 M - Solution
d'Acide Chlorhydrique 1 M - Acide Chlorhydrique Concentré - Acide Sulfurique
Commercial - Dichromate de Potassium Solide - Ponts Salins (6) (à défaut papier
filtres imbibés de KNO3) - Multimètres Numériques (3) - Tubes à Essais (12) -
Portoirs (2) - Pipettes Compte-gouttes (4) - Bechers 100 ml (10) - Bechers 500 ml (2)
- Bechers 250 ml (6) - Cristallisoir - Entonnoirs (2) -
Introduction :
Nous allons montrer que les métaux et leur cations forment des couples oxydo-
réducteurs susceptibles de donner des réactions chimiques par échange d'électrons
entre les différentes formes oxydantes et réductrices de deux couples différents. Ces
réactions peuvent se faire directement par action d'un métal sur un ion métallique
appartenant à un autre couple ou par l'intermédiaire d'un conducteur extérieur dans
une pile. L'étude de ces diverses réactions nous conduirons à un classement des
divers ions métalliques selon leur pouvoir oxydant. Ce classement qualitatif sera
complété ensuite par un classement quantitatif grâce à l'étude des piles. Nous
définirons ensuite la notion de potentiel de référence d'oxydo-réduction et la situation
particulière du couple H+ / H2. Enfin, nous réaliserons une pile capable de débiter un
courant important et utilisant le couple Zn2+ / Zn : la pile de Bunsen.
Données Thermodynamiques :
H3O+/H2 E0 = 0 v Zn2+ / Zn E0 = - 0,76 V
Cu2+ / Cu E0 = 0,34 V Pb2+ / Pb E0 = - 0,13 V
Ag+ / Ag E0 = 0,80 V Fe2+ / Fe E0 = - 0,44 V
I) Réactions entre un métal et le cation d'un autre métal :
1) Réaction entre le métal zinc et l'ion cuivre (II) :
a) Réaction :
Dans un tube à essais, verser 5 ml d'une solution de sulfate de cuivre 1 M, puis
ajouter 1 bonne spatulée de zinc en poudre. Le zinc se recouvre d'un dépôt
rougeâtre, et la température augmente sensiblement. Le montrer au toucher ou a
l'aide d'un thermomètre. Il se produit une réaction chimique exothermique. Boucher
le tube et agiter énergiquement, la solution bleue se décolore petit à petit. Laisser

reposer pour que la poudre de zinc se décante. (Eventuellement filtrer sur entonnoir
+ Coton).
b) Caractérisation des réactif et des produits :
Montrer l'action de la soude sur une solution de sulfate de cuivre. Dans un tube à
essais introduire un peu de solution puis ajouter goutte à goutte un solution de soude
1M. Il se forme un précipité bleu gélatineux d'hydroxyde de cuivre (II) Cu(OH)2
insoluble dans un excès de soude. Procéder de la même manière avec une solution
de sulfate de zinc. Il se forme un précipité blanc gélatineux d'hydroxyde de zinc (II)
Zn(OH)2 qui lui, est soluble dans un excès de soude par formation du complexe
Zn(OH)42-. Prélever un peu de la solution décolorée du a) et faire le test à la soude,
la formation d'un précipité blanc soluble en excès montre la formation de Zn2+. La
décoloration de la solution montre la disparition de l'ion Cu2+. Le dépôt rougeâtre ne
peut être que du cuivre métallique.
c) Conclusion :
La réaction est : Cu2+ + Zn ---> Cu + Zn2+
Il y a eu échange d'électrons entre les deux réactif de départ il s'agit d'une réaction
d'oxydo-réduction. L'ion Cu2+ est l'oxydant, le métal zinc est le réducteur.
2) Réaction entre le métal fer et l'ion cuivre (II) :
Procéder exactement de la même manière. L'ion Fe2+ est caractérisé par la formation
de Fe(OH)2 de couleur verte.
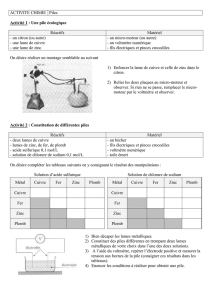
3) Généralisation à d'autres métaux :
Dans un becher de 100 ml introduire un peu de la solution d'un ion métallique, puis y
plonger une lame d'un autre métal.
Réaliser ainsi : (Cu2+ ; Fe) ; (Cu2+ ; Zn) ; (Fe2+ ; Zn) ; (Ag+; Cu) ; (Ag+ ; Fe) ;
(Ag+ ; Zn) ; (Fe2+; Cu) ; (Zn2+ ; Cu) ; (Zn2+ ; Fe) ; (Cu2+ ; Ag)
Laisser les réactions se faire et montrer le résultat.
L'argent se dépose sur tous les autres métaux.
Le cuivre se dépose sur le zinc et le fer, mais ne se dépose pas sur l'argent.
Le fer se dépose sur le zinc mais pas sur le cuivre et l'argent.
Le zinc ne se dépose sur aucun des autres métaux.
2) Classement qualitatif des ions métalliques selon leur pouvoir oxydant (ou
des métaux selon leur pouvoir réducteur)

Les expériences précédantes permettent de classer les ions métalliques selon leur
pouvoir oxydant. L'ion Ag+ est capable d'oxyder tous les métaux étudiés. L'ion Ag+
est donc le meilleur oxydant parmi les ions étudiés. Inversement le métal zinc est
capable de réduire tous les cations métalliques étudiés. Le métal zinc est donc le
meilleur réducteur parmi les métaux étudié.
On obtient le classement qualitatif suivant :
a) Selon le pouvoir oxydant de l'ion métallique :
Zn2+ < Fe2+ < Cu2+ < Ag+
b) Selon le pouvoir réducteur du métal :
Ag < Cu < Fe < Zn
c) Notion de Couple Oxydo-réducteur :
Les deux tableaux précédant peuvent être résumé en un seul qui va classer les
couples ion métallique/métal. On place les couples sur un axe horizontal, l'ion
métallique (oxydant) en haut, le métal (réducteur) en bas. Le pouvoir oxydant
augmente vers la droite, le pouvoir réducteur vers la gauche.
Zn2+ Fe2+ Cu2+ Ag+
-I----------I----------I----------I--------> Pouvoir Oxydant
Zn Fe Cu Ag
III) Place du Couple H+ / H2 :
Le couple H+ / H2, est un couple oxydo-réducteur particulièrement important, bien
que non métallique, nous allons le situer dans le tableau précédant.
1) H+ est capable d'oxyder le fer :
Pour le montrer introduire un peu de fer en poudre dans un tube à essai puis verser
1 ou 2 ml d'une solution d'acide chlorhydrique 1 M. On observe un dégagement de
dihydrogène que l'on caractérisera en le faisant aboyer à la flamme. Caractériser
ensuite les ions Fe2+ formés par la soude. (Si l’attaque ne se produit pas ajouter une
goutte d’acide concentré pour la faire démarrer).
2) H+ n'est pas capable d'oxyder le cuivre :
Procéder de la même manière avec du cuivre en tournures, aucune réaction ne se
produit.
3) Place du couple H+/ H2 :

Le Couple H+/H2 est donc situé entre les couples (Fe2+ / Fe) et (Cu2+ / Cu). Le
rajouter au tableau précédant.
IV) Classement quantitatif des couples :
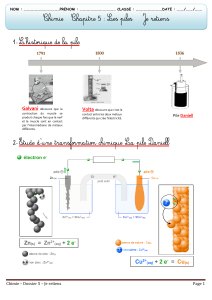
1) Pile Zinc-Cuivre :
a) Réalisation d'une Pile :
Réaliser une pile : Cu / Cu2+ / Pont Salin / Zn2+ / Zn.
Mesurer sa f.e.m à l'aide d'un multimètre numérique, on trouve 1,1 V.
Montrer que le pôle + est sur le cuivre et le pôle - sur le zinc.
b) Interprétation :
La mesure de la f.e.m permet de déduire la circulation d'un courant électrique.
L'identification des pôles de la pile permet de déduire le sens de circulation des
électrons dans le conducteur extérieur. Les électrons sont produits à l'électrode de
zinc et consommés à l'électrode de cuivre. Le zinc est donc oxydé en Zn2+
fournissant au circuit extérieur deux électrons qui vont aller à l'électrode de cuivre. A
l'électrode de cuivre les ions Cu2+ captent les électrons fournis par le conducteur
extérieur et donnent du cuivre métallique.
Schématisation de la Pile :
Pôle MOINS : Zn ---> Zn2+ + 2 e-
Pôle PLUS : Cu2+ + 2 e- ---> Cu
Bilan : Zn + Cu2+ ---> Zn2+ + Cu
On retrouve l'équation bilan de la première réaction étudiée.
Ici l'échange électronique se fait par l'intermédiaire du conducteur extérieur.
Remarque : Par définition, l'anode est l'électrode où se produit la réaction d'oxydation
et la cathode est l'électrode où se produit la réaction de réduction. Le pôle moins de
la pile est donc l'anode et le pôle plus la cathode. C'est l'inverse pour une cellule
d'électrolyse.

2) Généralisation :
Réaliser les piles suivantes (par exemple) et mesurer leur f.e.m :
(Ag / Cu) ; (Fe / Cu) ; (Fe / Zn). Montrer que leur pôle + est respectivement sur Ag,
Cu et Fe. Interpréter les réactions qui se produisent aux électrodes et montrer qu'on
retrouve le classement qualitatif précédant.
3) Classement quantitatif des couples :
Utiliser les valeurs des f.e.m trouvées pour classer quantitativement les couples. Sur
un axe on placera les divers couples en les écartant d'une distance proportionnelle à
la f.e.m de la pile les mettant en jeu.
4) Prévision de la f.e.m d'une pile :
Utiliser le tableau pour prévoir la f.e.m de la pile (Ag / Zn) et vérifier
expérimentalement le résultat obtenu.
V) Notion de potentiel de référence d'oxydo-réduction :
On a pu classer quantitativement les couples par mesure de différences de potentiel.
Il est tentant d'attribuer une valeur définie pour le potentiel de chaque couple. Pour
cela on doit choisir arbitrairement un couple de référence à qui on attribuera un
potentiel nul. Le couple choisi comme référence de potentiel est le couple H+/H2.
1) Réalisation d'une Electrode de Référence à Hydrogène simplifiée
Dans un cristallisoir ou un gros becher, introduire une solution 1 M d'acide
chlorhydrique. Rajouter du zinc en grenaille. Introduire un fil de platine (ou mieux une
électrode de platine) et le mettre en contact avec la solution. Le zinc est attaqué et
du dihydrogène se dégage. On à réalisé une 1/2 pile mettant en jeu le couple H+ / H2
; par convention on pose un potentiel nul pour cette demi-pile. (Laisser la réaction se
faire 5 à 10 minutes, si le dégagement de dihydrogène ne se produit pas on peu
" tricher " un peu en décapant le zinc par HCl concentré avant de l'introduire dans le
becher).
2) Réalisation de piles utilisant l'E.R.H :
En associant cette demi-pile à d'autres on réalisera des piles dont on pourra mesurer
la f.e.m. (borne COM sur E.R.H et V/mA/Ohm sur l'autre demi-pile). Ne pas oublier le
pont salin.
Réaliser les piles (Ag/E.R.H) ; (Cu;E.R.H) ;(Zn;E.R.H). Par définition la f.e.m de la
pile est égal au potentiel normal du couple utilisé.
Comparer avec les valeurs de la littérature.
Réaliser le classement définitif des couples en portant les valeurs des E0 sur le
tableau précédant.
 6
6
1
/
6
100%