Correction

Licence-Master Bioinformatique
Correction du contrôle continu du 28/03/07
Chaque question est sur 4
Question 1
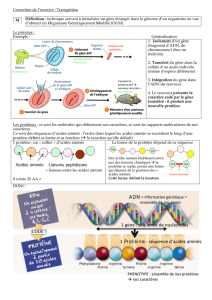
Définissez une macromolécule
-grande taille
- polymère de molécules organiques élémentaires, identiques ou similaires. Par ex, les
protéines sont des polymères d’acides aminés. Les acides aminés ont une structure de base
identique mais diffèrent par leurs résidus (20 différents). Autre ex : l’ADN est un polymère de
désoxyribonuléotides. Il existe 4 types de désoxyribonucléotides de même structure générale
mais variant par leur base. Ex de macromolécule constituée par la répétition de monomères
tous identiques : le glycogène constitué de la répétition de glucose.
- les molécules élémentaires sont liées ensemble par des liaisons covalentes pour constituer
une chaine linéaire le plus fréquemment (ex protéines et acides nucléiques) ou parfois
ramifiée (ex certains polysaccharides)
- la chaine linéaire peut adopter une structure tridimensionnelle grâce à l’établissement de
liaisons faibles entre les monomères.
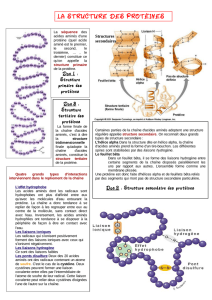
Question 2
Quels types de liaisons chimiques trouve-t-on dans une protéine, et quels sont les rôles respectifs de ces
différents types de liaison?
- liaisons covalentes. Liaisons fortes qui nécessitent un apport d’énergie pour être créées
et qui libèrent de l’énergie lorsqu’elles sont rompues. Lient
o les atomes qui constituent les acides aminés
o les acides aminés pour constituer la chaine polypeptidique. Ces liaisons
covalentes entre acides aminés sont appelées liaisons peptidiques. Ces liaisons
sont donc impliquées dans la structure primaire
o les atomes de S entre deux Cys pour créer ce que l’on appelle un pont
disulfure. C’est un cas particulier de liaison covalente qui contribue aux
structures tertiaire et quaternaire
- liaisons faibles : liaisons ioniques, liaisons hydrogène et liaisons de Van der Walls.
S’établissent spontanément entre divers groupements chimiques. Permettent les
interactions entre acides aminés qui conduisent à la mise en place des structures
secondaire, tertiaire et quaternaire des protéines.
Question 3
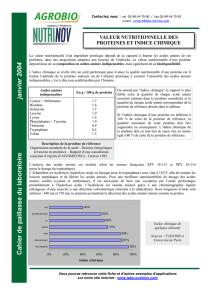
Une mutation qui change une alanine en une valine, à l’intérieur de la structure tridimensionnelle d’une protéine
donnée, entraine une perte d’activité de cette protéine. Expliquez pourquoi. Différentes causes sont possibles
Alanine et valine sont des acides aminés hydrophobes (voir tableau du cours). Ce n’est donc
pas cette différence qui peut expliquer la perte d’activité de la protéine. En revanche, l’alanine
participe généralement à la formation d’hélices alpha, tandis que la Valine a plus tendance à
former des feuillets beta (voir tableau du cours). Donc cette mutation pourrait conduire à la
perte d’une organisation en hélice alpha à l’intérieur de la protéine et ainsi complètement
déstructurer la protéine. La fonction d’une protéine étant souvent liée à sa conformation,
l’activité pourrait être perdue ainsi. Ce pourrait être typiquement le cas d’une protéine
membranaire dans laquelle le domaine transmembranaire est généralement une hélice alpha.
Alternativement, si la protéine est une enzyme, l’alanine pourrait faire partie des acides
aminés constituant le site actif. Le changement en valine changerait juste la réactivité
chimique de ce site actif sans nécessairement le déstructurer énormément.

Question 4
Dans une souche de laboratoire d’Escherichia coli, le génome a subit plusieurs délétions touchant directement ou
indirectement le fonctionnement de l’opéron Lac. Prédisez l’effet:
- De la délétion du gène codant le répresseur
- De la délétion de la séquence operator
- De la délétion du gène codant CAP
Le fonctionnement de l’opéron Lac (schéma dans le cours) met en jeu
- le répresseur. C’est une protéine codée par un gène présent à proximité de l’opéron
Lac. Ce répresseur se fixe sur l’opérateur, qui est une sous partie du promoteur de
l’opéron Lac et bloque la transcription. La délétion du gène codant le répresseur
entraine l’absence du répresseur et donc l’opéron Lac devrait être transcrit de façon
permanente.
- La délétion de l’opérateur devrait avoir la même conséquence
- CAP est le facteur de transcription sensible à l’AMPc qui permet la transcription de
l’opéron lac. La délétion du gène codant Lac devrait conduire à un arrêt de
transcription de l’opéron lac
Question 5
Cette question était une question de réflexion
La méthylation (changement chimique) des bases C de l’ADN est une modification dite « épigénétique », c’est-
à-dire une modification qui ne change pas la séquence, mais qui change l’expression des gènes. A votre avis,
quel type de séquence est spécialement la cible des méthylations?
Si la méthylation change l’expression, c’est qu’elle touche spécialement les séquences
impliquées dans cette expression à savoir les promoteurs et les enhancers. En effet, les
promoteurs sont plutôt riches en GC. On peut aussi envisager que la méthylation touche
spécifiquement les gènes codant des facteurs de transcription, mais cela parait peu probable.
L’enzyme de restriction HpaII permet de détecter la présence de séquences méthylées. En effet, elle reconnaît la
séquence 5’CCGG3’ mais ne clive l’ADN que si au moins un des deux C est méthylé. De l’ADN de cellules de
souris, de drosophile et de E. coli a été extrait, incubé en présence de HpaII, puis analysé par électrophorèse.
Les résultats sont présentés sur la figure ci-dessous. Que pouvez vous en conclure?
Une électrophorèse permet de séparer des fragments d’ADN en fonction de leur taille. Sur
l’électrophorèse on voit au plus deux « bandes » : une autour de 100 paires de bases, c’est-à-
dire des petits fragments d’ADN, l’autre supérieur à 50 kilopaires de bases, c’est-à-dire des
très grands fragments. Le site reconnu par l’enzyme HpaII est court et donc statistiquement
très fréquent dans le génome, environ toutes les 100 pb, c’est ce que l’on peut voir sur
l’électrophorèse. Tout l’ADN de Droso et de E. coli est digéré en fragments de 100 pb, cela
signifie que tous les sites HpaII sont méthylés, donc que la méthylation est généralisée chez
ces organismes et donc n’a probablement pas de rôle régulateur particulier. En revanche, chez
la souris, seule une petite partie de l’ADN a été digéré, ce qui indique que seuls une petite
minorité de sites HpaII sont méthylés. La méthylation dans ce génome est donc restreinte à
certaines séquences, probablement les séquences promotrices comme évoqué plus haut.
1
/
2
100%