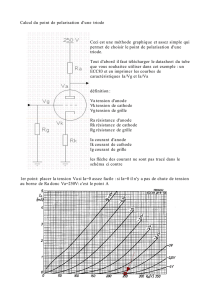
I. Transformation forcée

17/04/17 840909061 1/2
CHIMIE
TRANSFORMATIONS FORCEES - ELECTROLYSES
CORRECTION
Chap.8
I. Transformation forcée
1. Evolution spontanée d’une réaction
1.1. K = [Cu2+(aq)]f [Br-(aq)]f 2
[Br2(aq)]f = 1,2.1025. K la constante d’équilibre est très élevée (K > 104). Evolution
spontanée de la gauche vers la droite ( sens 1). Le taux d’avancement est très proche de 1.
1.2. La réaction inverse est pratiquement inexistante.
La constante de réaction K’ est égale à 1
K = 8,2x10-26.
1.3. Si [Cu2+(aq) ] = [Br-(aq)]= 0,10 mol/L et [Br2(aq)]=0 on Qri = 0 Qri <K’ . Le système évolue spontanément
vers la formation de Cu(s) et de Br2 . K’ très faible on peut considérer que le système n’évolue
pratiquement pas. Les quantités de matière mises en jeu sont très faibles. Le taux d’avancement de la
réaction est très petit . Effectivement on n’observe aucune évolution.
2. Transformation forcée
2.1. Schéma et légende du circuit ci-contre.
2.2. Voir schéma ci-contre. Le générateur impose le sens du courant dans le
circuit. Le courant sort de la borne positive du générateur. Dans les fils
conducteurs, les porteurs de charges sont les électrons qui se déplacent
dans le sens inverse du courant. Dans la solution aqueuse de bromure de
cuivre II, les ions cuivre II, Cu 2+, se déplacent dans le sens du courant et
les ions bromure, Br –, se déplacent dans le sens inverse du sens du
courant (sens de déplacement des électrons).
2.3. L’électrode reliée à la borne négative du générateur se recouvre d’un
dépôt rougeâtre de cuivre.
Du coté de l’électrode reliée à la borne positive du générateur on a
apparition d’une coloration orange.
En fin de réaction, Le cyclohexane prend une teinte orange,
caractéristique de la présence de dibrome (on a réalisé une extraction)
2.4. Le dépôt rougeâtre qui apparaît à l’électrode reliée à la borne négative
du générateur est constitué de cuivre métal. IL se produit la réduction suivante : Cu 2+(aq) + 2 e - = Cu (s).
La réduction se produit à la cathode
Le jaunissement de la solution au niveau de l’électrode reliée à la borne positive est provoqué par la
formation de dibrome. Il se produit l’oxydation suivante : 2 Br - (aq) = 2 e- + Br2(aq) . L’oxydation se produit
à l’anode
2.5. Cu2+(aq) + 2 Br -(aq) = Cu(s) + Br2(aq) Constante d’équilibre K’
2.6. On a vu précédemment que ce système constitué d’ions cuivre II en présence d’ions bromure n’évolue
pas. Le générateur fournit l’énergie nécessaire pour faire évoluer le système. Il peut le forcer à évoluer.
Cette réaction forcée est appelée électrolyse .
II. Définitions
L’électrode reliée à la borne positive est nommée anode
La réaction qui se produit à cette électrode est une oxydation
L’électrode reliée à la borne négative est nommée cathode
La réaction qui se produit à cette électrode est une réduction
Cette transformation forcée est une électrolyse
L’électrolyseur est caractérisé par une force contre-électromotrice (f.c.é.m.) E’ et une résistance
interne r’.
A l’intérieur de l’électrolyseur, le passage du courant est assuré par les ions.
Dans l’électrolyte, les cations se déplacent vers la cathode et les anions vers l’anode

17/04/17 840909061 2/2
III. Applications de l’électrolyse
1. Électrolyse à anode soluble
1.1. Expérience 3
1.2. Interprétation : Étude qualitative
1.2.1 Schéma ci-contre
1.2.2 Cu2+ (aq)/ Cu(s) et Cu2+ (aq)/ Cu(s)
1.2.3 A la cathode dépôt de cuivre. A la cathode reliée la borne
négative du générateur, l'oxydant Cu2+ gagne des électrons et se
réduit : Cu2+ (aq) +2e- = Cu(s)
1.2.4 A l'anode reliée la borne positive du générateur, un réducteur (le
métal de l'anode) s'oxyde en cédant des électrons :
Cu(s) = Cu2+ (aq) +2e-.
Le fil métallique est attaqué.
1.2.5 Cu2+ (aq) + Cu(s) → Cu2+ (aq) + Cu(s)
1.2.6 Tout se passe comme si le cuivre de l'anode était transporté sur la cathode; la
concentration restant inchangée. On a une électrode à anode soluble, puisque l'anode
disparaît progressivement.
Une électrolyse à anode soluble réalise le transport du métal de l'anode sur la cathode.
1.3. Interprétation : Étude quantitative
1.3.1 On se sert de la demi-équation. n(Cu consommé) = x et le nombre d’électrons échangé vaut 2x .
D’où nD =ne–
2=> ne-= 2nD.
État du système
avancement (mol)
Cu(s) = Cu2+ (aq) + 2 e-
État initial
0
n(Cu i)
0
0
en cours de réaction
x
n(Cu i) - x
n(Cu2+ formé) =x
n(e-)=2x
1.3.2 Q =2nD F = I ∆t => nD = I ∆t
2 F ; I
0,12 A ; t = 15 min
1.3.3 mth = MCu nD = MCu I ∆t
2 F= 63,5
Error!
= 0,036 g
1.3.4 mD = mf - mi = 0,04 g.
1.3.5 écart relatif =
Error!
=
Error!
= 11 %.
1.3.6 Des incertitudes sur les pesées. La balance n’est précise qu’à
0,01 g.
2. Dépôt métallique : Electrolyse d’une solution de chlorure d’étain en
milieu acide
2.1. Schéma du dispositif expérimental ci-contre.
2.2. On observe un dégagement gazeux à l’anode
2.3. On observe avec une décoloration de l’indigo. Dépôt de d’étain à la
cathode.
2.4. La décoloration de l’indigo permet l’identification du dichlore (Cl2).
2.5. Anode : dégagement de dichlore 2 Cl-(aq) = Cl2(g) + 2e-
Cathode : apparition d'étain sous une forme solide
Sn2+(aq) + 2e- = Sn(s)
L’équation-bilan globale de l’électrolyse est :
Sn2+(aq) + 2 Cl-(aq) → Sn(s) + Cl2(g)
2.6. Formation de Cl2
1
/
2
100%