Affinage électrolytique du cuivre : Exercice de chimie TS

Spécialité Chimie 2009/2010
TS 4, 5, 6
L
Ly
yc
cé
ée
e
J
Je
ea
an
n
X
XX
XI
II
II
I,
,
R
Re
ei
im
ms
s
1/2
Nom Prénom
Partie 7 Elaboration de produits
AFFINAGE ELECTROLYTIQUE DU CUIVRE
Données : couples
)s(Cu/)aq(Cu2
;
)aq(SO/)aq(SO 2
2
4
;
)aq(SO/)aq(OS 2
4
2
82
;
)g(H/)l(OH 22
;
)l(OH/)g(O 22
.
123
Amol1002,6N
;
14 mol.C1065,9F
;
C106,1e 19
Objectif
En déterminant la constante d’Avogadro, on souhaite appliquer la méthode d’électrolyse à la purification
du cuivre et au dépôt électrolytique d’un métal sur un autre.
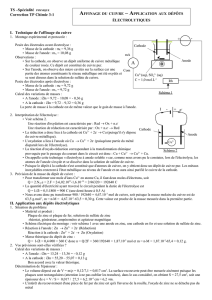
Manipulation
Décaper très soigneusement deux plaques de cuivre. Repérer une plaque et déterminer sa masse.
Réaliser un montage comportant, en série, un générateur de courant, un interrupteur, un ampèremètre,
une cellule d’électrolyse, constituée de deux plaques de cuivre (A= anode, C=cathode) plongeant dans
une solution aqueuse de sulfate de cuivre (
1
L.mol0,1c
;
mL100V
) , jusqu’à mi-hauteur.
Sous l’électrolyseur, installer un agitateur magnétique en évitant que le turbulent ne touche les
plaques de cuivre.
Prérégler le générateur à
A50,0I
.
Déclencher le chronomètre dès que l’interrupteur est fermé.
Maintenir cette tension pendant
min30t
. Il est essentiel de maintenir une agitation constante de la
solution.
Après
min30t
, constater que l’anode s’est amincie et que la cathode s’est recouverte d’un dépôt
de cuivre.
Sécher la cathode au sèche-cheveux et déterminer son accroissement de masse. On appelle
)Cu(mcat
la masse du dépôt de cuivre obtenu à la cathode.
Exploitation
1) Faire un schéma légendé du montage.
2) Quelles espèces sont initialement présentes dans cet électrolyseur ?
3) Quelles sont les trois équations des réactions modélisant les transformations à priori possibles à la
cathode ?
4) Quelles sont les trois équations des réactions modélisant les transformations à priori possibles à
l’anode ?
5) Parmi ces réactions, lesquelles retient-on comme modélisant les transformations aux électrodes ?
6) a) Ecrire l’équation de la réaction qui modélise cette électrolyse.
b) Distinguer le cuivre de l’anode de celui de la cathode en notant
Anod
Cu
et
cat
Cu
.
7) Pourquoi parle-t-on d’électrolyse à anode soluble ?
8) Calculer la quantité de matière
)Cu(nCa
déposée à la cathode.
9) Exprimer la quantité d’électricité Q qui traverse le circuit pendant la durée
min30t
.

Spécialité Chimie 2009/2010
TS 4, 5, 6
L
Ly
yc
cé
ée
e
J
Je
ea
an
n
X
XX
XI
II
II
I,
,
R
Re
ei
im
ms
s
2/2
10) Compléter le tableau d’évolution des espèces chimiques au cours de l’électrolyse.
Avt
cat
22
Anod Cu)aq(Cu)aq(CuCu
n(e-)
EI
0
n
C.V
C.V
n’
En cours
x
où n(e-) : quantité de matière d’électrons échangés.
11) Quelle est la relation entre la quantité de matière d’atomes de cuivre déposés à la cathode et la
quantité de matière d’électrons échangés ?
12) Exprimer la quantité d’électricité ayant circulé pendant
t
en fonction de n(e-) et du faraday F.
13) a) En déduire la valeur du faraday puis celle de la constante d’Avogadro NA.
b) les comparer aux valeurs connues.
14) Montrer que cette technique d’électrolyse permet de purifier du cuivre contenant des traces de
métaux précieux (inoxydables dans ces conditions).
1
/
2
100%