Thème : Matériaux

Thème : Matériaux
D’où proviennent les métaux ? Comment les produit-on ?
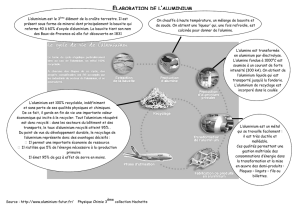
Une étape de l’élaboration de l’aluminium
Les métaux sont des ressources qui existent en quantités limitées sur terre. Ils servent de matière première dans l’industrie et l’accès aux
nouveaux gisements est difficile. De ce fait, les métaux sont un enjeu économique majeur.
La production d’aluminium en est un bon exemple …
Document 1 : Elaboration de l’aluminium.
Les métaux, matières premières essentielles à de nombreuses industries, n’existent
quasiment pas purs à l’état naturel mais généralement sous forme d’oxydes contenus
dans des minerais. Ces minerais, sont composés de nombreuses espèces chimiques. La
production d’un métal à partir d’un minerai est le résultat d’un processus industriel
complexe afin de l’extraire et de le purifier.
L'élément aluminium est, en importance, le troisième élément de la croûte terrestre
(proche de 10 %). Il y est présent essentiellement sous forme d'oxydes d'aluminium.
L’industrie de l’aluminium date de la fin du Second Empire. C’est à cette époque, grâce à
un procédé mis au point par le chimiste Henri Sainte Claire Deville que se crée, en 1860,
à Salindres (Gard) la première unité au monde de fabrication de l’aluminium.
L’aluminium devient alors un symbole du progrès industriel. Lors d’un banquet impérial,
seul Napoléon III a droit d’utiliser des couverts en aluminium, les autres convives doivent
se contenter de couverts … en argent !
Depuis, l’utilisation de l’aluminium s’est diversifiée et
démocratisée même si l’aluminium reste un métal plutôt cher à
produire car les quantités d’énergie que l’on doit déployer sont
importantes (utilisation de l’électrolyse).
Le minerai le plus utilisé pour produire l'aluminium est la bauxite
(les premiers gisements furent découverts dans le village des Baux-
de-Provence en 1831 par Pierre Berthier). A partir de la bauxite, on
produit l'alumine (oxyde d’aluminium Al2O3) dont l'électrolyse à
l'état fondu permet d'obtenir l'aluminium.
Mais la bauxite ne contient pas uniquement de "l'aluminium" : elle
est constituée de 40 à 60 % en masse d'alumine (de forme
hydratée Al(HO)3), de 10 à 20 % d'oxyde de fer III (de forme
hydratée Fe(HO)3) et de la silice. La première étape de la production de l’aluminium consiste ainsi à séparer l'alumine des autres constituants du
minerai.
Travail à la maison :
Regarder cette vidéo :
http://acver.fr/2cx
Et répondre au QCM se trouvant sur Pronote.
Usine australienne de production d’aluminium

Document 2 : Influence de différents paramètres sur la dissolution d’un composé.
La dissolution d’un composé en solution aqueuse dépend de nombreux paramètres, comme par exemple la température, la pression et le pH de la
solution.
Un composé soluble dans l’eau peut par exemple se transformer en une autre espèce non soluble lorsque l’un des paramètres évolue et ainsi
quitter la solution en formant un précipité.
Influence du pH :
C’est le cas des espèces présentes dans la bauxite ; Les hydroxydes d’aluminium Al(HO)3 et de fer III Fe(HO)3, non solubles dans l’eau peuvent se
transformer respectivement en Al3+ou Al(HO)4- et en Fe3+, solubles dans l’eau lorsque la valeur du pH de la solution change.
Les diagrammes de prédominances de ces deux espèces indiquent sous quelle forme majoritaire existent les éléments aluminium et fer en
solution en fonction de la valeur du pH :
Influence de la température :
La température est également un paramètre important influençant la dissolution d’un composé. En général, plus la température est élevée et plus
la solubilité d’un composé est importante.
Ainsi, pour favoriser ou accélérer la dissolution de composés relativement peu solubles comme les minerais, on peut les chauffer en plus d’une
bonne agitation.
A l’inverse, pour favoriser et accélérer la précipitation d’un composé non soluble dans l’eau, on peut refroidir le mélange à l’aide d’un bain de
glace.
A l’aide des documents suivants et du matériel disponible :
Proposer un protocole expérimental permettant de vérifier la solubilité de l’hydroxyde d’aluminium (Al(OH)3 ) et de l’hydroxyde de fer
III (Fe(OH)3) dans l’eau en fonction de la valeur du pH.
Après validation par le professeur, réaliser l’expérience, noter les observations. On prendra soin d’écrire les équations qui ont eu lieu lors des
réactions réalisées.
A l’aide de l’expérience précédente, élaborer un protocole expérimental permettant d’extraire l’alumine (hydroxyde d’aluminium
Al(HO)3 sous forme hydratée) de la bauxite.
Après validation par le professeur, réaliser l’expérience, noter les observations et les résultats. Conclure.
pH
pH
4
2
Al3+
Al(HO)3
Al(HO)4-
Fe(HO)3
Fe3+
0
10
14
0
14

Questions :
1) Écrire l’équation de la réaction se produit lors de l’attaque du minerai par la solution de soude.
2) Quelle espèce chimique reste sur le filtre et quelles espèces chimiques se trouvent dans le filtrat lors de la première filtration ? Justifier.
3) Écrire l’équation de la réaction qui se produit lors de l’ajout de la solution d’acide chlorhydrique.
4) Écrire l’équation de la réaction de déshydratation de l’hydroxyde d’aluminium lors de la calcination (ultime étape non réalisée lors du TP).
Questions :
1) Écrire l’équation de la réaction se produit lors de l’attaque du minerai par la solution de soude.
2) Quelle espèce chimique reste sur le filtre et quelles espèces chimiques se trouvent dans le filtrat lors de la première filtration ? Justifier.
3) Écrire l’équation de la réaction qui se produit lors de l’ajout de la solution d’acide chlorhydrique.
4) Écrire l’équation de la réaction de déshydratation de l’hydroxyde d’aluminium lors de la calcination (ultime étape non réalisée lors du TP).
Questions :
1) Écrire l’équation de la réaction se produit lors de l’attaque du minerai par la solution de soude.
2) Quelle espèce chimique reste sur le filtre et quelles espèces chimiques se trouvent dans le filtrat lors de la première filtration ? Justifier.
3) Écrire l’équation de la réaction qui se produit lors de l’ajout de la solution d’acide chlorhydrique.
4) Écrire l’équation de la réaction de déshydratation de l’hydroxyde d’aluminium lors de la calcination (ultime étape non réalisée lors du TP).
Questions :
1) Écrire l’équation de la réaction se produit lors de l’attaque du minerai par la solution de soude.
2) Quelle espèce chimique reste sur le filtre et quelles espèces chimiques se trouvent dans le filtrat lors de la première filtration ? Justifier.
3) Écrire l’équation de la réaction qui se produit lors de l’ajout de la solution d’acide chlorhydrique.
4) Écrire l’équation de la réaction de déshydratation de l’hydroxyde d’aluminium lors de la calcination (ultime étape non réalisée lors du TP).
Questions :
1) Écrire l’équation de la réaction se produit lors de l’attaque du minerai par la solution de soude.
2) Quelle espèce chimique reste sur le filtre et quelles espèces chimiques se trouvent dans le filtrat lors de la première filtration ? Justifier.
3) Écrire l’équation de la réaction qui se produit lors de l’ajout de la solution d’acide chlorhydrique.
4) Écrire l’équation de la réaction de déshydratation de l’hydroxyde d’aluminium lors de la calcination (ultime étape non réalisée lors du TP).
Questions :
1) Écrire l’équation de la réaction se produit lors de l’attaque du minerai par la solution de soude.
2) Quelle espèce chimique reste sur le filtre et quelles espèces chimiques se trouvent dans le filtrat lors de la première filtration ? Justifier.
3) Écrire l’équation de la réaction qui se produit lors de l’ajout de la solution d’acide chlorhydrique.
4) Écrire l’équation de la réaction de déshydratation de l’hydroxyde d’aluminium lors de la calcination (ultime étape non réalisée lors du TP).

Protocole opératoire « attendu ».
1ère étape : Dissolution en milieu basique de l'alumine
- Le professeur donne une masse m0 (environ 1,5 g) de minerai reconstitué. La placer dans un erlenmeyer.
- Ajouter 50 mL d'eau. Agiter. Observer.
- Ajouter dans l'erlenmeyer 15 mL de la solution de soude à 2 mol.L–1.
- Placer l'erlenmeyer sur un agitateur magnétique chauffant et chauffer 10 min tout en agitant à environ 80°C (thermostat 5).
Observer si tout le solide se dissout ou non.
2ème étape : Elimination des impuretés par décantation puis filtration
- Laisser reposer quelques instants le contenu de l'erlenmeyer.
- Filtrer rapidement la solution encore chaude (filtration simple avec papier filtre plissé).
Noter la couleur du précipité et celle du filtrat.
3ème étape : Régénération de l'alumine par précipitation de l’hydroxyde d’aluminium
- Récupérer le filtrat dans un erlenmeyer placé dans de la glace pour accélérer la précipitation.
- Y ajouter progressivement 10 à 20 mL d’une solution d’acide chlorhydrique à 2 mol.L–1 : le pH doit être compris entre 4 et 9 (vérifier au
papier pH).
- Laisser décanter et filtrer à nouveau.
4ème étape : Calcination de l'alumine
- Récupérer le précipité obtenu dans l’étape précédente.
- Le sécher entre 2 papiers-filtres.
- On devrait le placer dans une capsule, préalablement pesée, et le chauffer fortement, puis peser le résidu sec.
On obtient habituellement une masse m1 inférieure à 1 g d’alumine plus ou moins hydratée.
Industriellement le chauffage se fait à 1250°C.
1)
-

Préparation du minerai reconstitué : à faire d’avance
Dissoudre 20 g de sulfate d’aluminium et 2 g de sulfate de fer (III) dans 100 mL d’eau distillée. Ajouter environ 60 mL de solution de
soude 2,5 mol.L–1 : un précipité rouge brique apparaît, composé d’hydroxyde de fer (III) Fe(OH)3 et d’hydroxyde d’aluminium (III) Al(OH)3.
Vérifier que le pH n’est pas supérieur à 9 (papier pH) afin d’éviter la dissolution de l’hydroxyde d’aluminium (III), sinon acidifier un peu
(pH entre 4 et 9).
Récupérer ce précipité sur entonnoir Büchner en verre fritté; laver le précipité plusieurs fois à l’eau distillée, puis le placer à l’étuve (80 °C) : on
obtient alors un solide orangé d’une composition proche de celle de la bauxite (Al2O3 : 75 % ; Fe2O3 : 25 %).
Le minerai reconstitué obtenu en appliquant ce mode opératoire est homogène à l’œil et a une composition chimique proche de celle de
la bauxite. On obtient ainsi environ 6 g. Bien broyer.
Il faut recommencer plusieurs fois pour avoir 9 g par classe de spé (au moins 6 g)
( idéal : 1,5 g × 8 × 6 classes = 72 g pour 6 classes de 8 postes)
* Pour laver le büchner en verre fritté après l’utilisation : élimination de la rouille
Mettre plusieurs spatules d’acide oxalique (solide blanc) sur le büchner. Ajouter quelques gouttes d’eau juste pour les mouiller. Laisser agir,
remuer de temps en temps. Bien rincer après, quand il n’y a plus de rouille dessus.
-----------------------------------------------------------------------------------------------------------------------------------
Produits :
- 1 L de solution de sulfate d’aluminium à env. 0,1 mol/L 1 L pour 6/7 classes
- 1 L de solution non acidifiée de chlorure de fer III ou bien de sulfate de fer III à env. 10–1 mol/L
- Bauxite reconstituée : au moins 6 g pour une classe de Spé
- Glaçons + petit cristallisoir
Matériel :
Pour chaque poste :
Lunettes
Flacons de soude et acide chlorhydrique à 2 mol/L
Flacons avec solution de sulfate d’aluminium et de chlorure ou sulfate de fer (III)
Papier pH + plaque à godet
Agitateur magnétique chauffant + barreau
Potence avec pince (pour tenir l’erlen chauffé)
Tubes à essai sur portoir
3 erlenmeyers de 100 mL
Éprouvette graduée de 25 mL
Becher 25 mL (pour verser l’acide)
Potence de filtration double avec 2 entonnoirs moyens et filtres plissés
(Entonnoir Büchner à trous pas nécessaire ici)
Valet en liège
Collier de plomb
Agitateur de verre + spatule
Cuvette pour glaçons
Pissette d’eau distillée (grosse)
Collectif : le prof pèse rapidement pour voir ce que représente 1 g de bauxite et distribuera aux élèves
- 1 ou 2 balances, coupelles de pesée, Spatules, Pinceau
- Carrés papier filtre pour sécher
- 1 assiette en carton par classe pour récupérer l’alumine extraite.
1
/
5
100%