LYCEE THIONCK-ESSYL Année scolaire 2007-2008
Classe 3ème Cellule de sciences physiques
PROPRIETES CHIMIQUES DES METAUX USUELS
Exercice 1
Recopier les phrases suivantes en les complétant :
1°) La surface de la plupart des objets métalliques se transforme lorsqu’on les laisse aux
intempéries. Ce phénomène est appelé la ……………
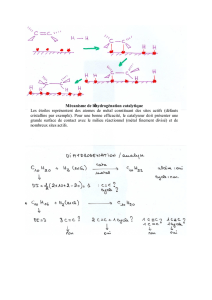
2°) a- A froid le ………………..de l’air réagit avec l’aluminium pour former une couche
d’……………….. Cette couche est ……………… ; elle protège le métal.
b- Le bilan de cette équation chimique est
Aluminium+………………. …………………….
c- Son équation – bilan est :
Al +……………. …………….
3°) A chaud, la ………………de zinc brûle dans le ……………….de l’air pour former de
l’………………de………………Cette réaction chimique set appelée……………
4°) La réaction chimique entre un métal et le dioxygène est appelée ……………..Son bilan
général est : métal+…………. ………………….
Exercice 2
Répondez aux questions suivantes par de courtes phrases.
1°) Quels les noms des deux oxydes qui se forment successivement lorsque l’on place une
plaque de cuivre dans une flamme ?
2°) Quelles sont les couleurs de ces deux oxydes ?
3°) Quelles sont les formules chimiques de ces oxydes et leurs noms ?
4°) Quels sont les bilans des deux réactions chimiques qui conduisent à ces deux oxydes ?
Ecrire les équations- bilans correspondantes.
5°) a- Quel est le nom du corps qui recouvre le cuivre lorsqu’il est laissé aux intempéries ?
b- Quels sont les corps purs, contenus dans l’air, qui réagissent avec le cuivre pour former
cette couche ?
c- Cette couche protège t- elle le cuivre de la corrosion ? Pourquoi ?
Exercice 3
Equilibrer les équations bilans ci-dessous en remplaçant les noms par leurs formules
chimiques.
1°) Al + Acide chlorhydrique ……………+ H2O
2°) H2O + Aluminium ……………..alumine + dihydrogène
3°) Fe3O4 + monoxyde de carbone Fe + dioxyde de carbone
4°) HCl + Aluminium chlorure d’aluminium + dihydrogène
5°) H2SO4 + Fer sulfate de fer + H2
Exercice 4
On jette dans la flamme d’un brûleur à gaz de la poudre de fer puis de la poudre d’aluminium
ensuite une poignée de poudre de zinc.
Ecrire les équations bilans des réactions chimiques possibles.

Exercice 5
1°) Est- il possible de transporter de l’acide chlorhydrique (HCl) dans d’un récipient en zinc ?
Justifier.
2°) a- On verse de l’acide sulfurique (H2SO4) dilué en excès et à froid sur un mélange de zinc,
d’aluminium et de cuivre. Un gaz se dégage ; lequel ? Quel est le métal attaqué par l’acide ?
Ecrire l’équation bilan de la réaction.
b- On verse de l’acide chlorhydrique dilué en excès sur le résidu solide de la première
opération après avoir soigneusement lavé avec de l’eau distillée.
Un gaz se dégage, lequel ? Quel est le métal attaqué par l’acide ?
Ecrire l’équation bilan de la réaction.
c- Sachant que les volumes de gaz sont respectivement 2,24 L et 6,72 L ; quelles sont les
masses respectives de ces deux métaux détruits par acides.
On donne M (Zn) = 65g.mol-1 ; M (Al) = 27g.mol-1 ; M (Cu) = 64g.mol-1.
Exercice 6
Dans un tube contenant 2dag d’un mélange d’aluminium et de cuivre, on verse à froid un
excès d’acide chlorhydrique (HCl).
1°) Quel est le métal attaqué par l’acide ? Quels sont les corps qui se forment ? Ecrire
l’équation bilan de la réaction.
2°) Quelle est la masse du métal attaqué par l’acide si la réaction donne 216dL de gaz ?
3°) Quel est le nom du métal restant ? Quelle est sa masse dans le mélange ?
On donne M (Al) = 27g.mol-1 ; M (Cu) = 64g.mol-1 ; VM = mol-1
Exercice 7
Dans une bouteille contenant 3600cm3 de dioxygène pur, on brûle une masse d’aluminium de
60dg. Il se forme de l’alumine (Al2O3).
1°) Ecrire l’équation bilan de la réaction.
2°) Montrer que l’aluminium est en excès.
3°) Calculer la masse d’aluminium non brûlée.
Données : M (Al) = 27g/mol ; M (O) = 16g/mol ; VM = 24L.mol-1
Exercice 8 :
On laisse séjourner dans l’air ambiant trios métaux A, B, C. Au bout de quelques jours, A
malgré sa dureté s’oxyde profondément et disparaît. B, naturellement léger s’oxyde
superficiellement et est un excellent conducteur d’électricité. C, généralement protecteur du
fer se ternit seulement.
1°) Donner respectivement les noms des métaux A, B, C.
2°) Donner l’équation équilibrée libérant du chlorure de A.
3°) Quelle masse d’acide chlorhydrique donnant 254g de chlorure de A.
4°) En déduire le volume de dihydrogène libéré en même temps.
Donner: M (H) = 1g/mol; M (Fe) = 56g/mol; M (Pb) = 207g/mol.
AU TRAVAIL !
1
/
2
100%