Document

TP n°9 Chimie
Partie D : Elaborer un produit de consommation
Classe : Spéc.
Page 1 sur 2
Elaboration de l’aluminium
I/ L’aluminium
L'aluminium a une densité environ trois fois plus faible que celle de l'acier ou du cuivre. Il est malléable
(deuxième métal le plus malléable), ductile et facilement usiné et moulé. Il possède une excellente résistance à la
corrosion et une grande longévité. Il est également non magnétique et ne provoque pas d'étincelles.
Il possède un aspect argent-gris mat, dû à une couche mince d'oxydation (alumine Al2O3) de 5 à 10 nm qui se
forme rapidement quand on l'expose à l'air et qui empêche la corrosion de progresser dans des conditions
normales d'expositions chimiques. Sans cette couche d'oxyde, il serait impropre à la plupart de ses applications.
L'aluminium est un élément abondant dans la croûte terrestre (1,5%) mais il se trouve rarement sous sa forme
pure. Le principal minerai d'aluminium est la bauxite. L'aluminium est très difficile à extraire des roches qui le
contiennent et a donc été longtemps très rare et précieux.
On attribue généralement la découverte et l'isolement de l'aluminium à Friedrich Wöhler en 1827.
II/ Tests préliminaires
1) Formation de l’hydroxyde d’aluminium
- Dans un tube à essais contenant environ 2 mL de sulfate d’aluminium à 0,05 mol.L-1 ajouter quelques
gouttes de soude à 2,5 mol.L-1. Poursuivre l’addition de soude et noter l’évolution du tube.
(Cesser l’addition de soude lorsque la solution est redevenue limpide)
- Ajouter alors dans ce même tube quelques gouttes d’acide chlorhydrique à 3 mol.L-1 et noter l’évolution
du tube. (Cesser l’addition d’acide lorsque la solution est redevenue limpide)
Questions
a) Ecrire la réaction de précipitation de l’hydroxyde d’aluminium qui se forme lorsqu’on ajoute de la
soude à la solution de sulfate d’aluminium.
b) Sachant que la constante d’équilibre de cette réaction est K1 = 1,0 10 32 déterminer la valeur du pH de
la solution lorsque le précipité commence à apparaître. (On négligera le phénomène de dilution lié à
l’ajout de la soude).
c) En présence d’un excès d’ion hydroxyde, on observe la formation du complexe [Al(OH)4] –. Ecrire la
réaction qui est responsable de la redissolution du précipité lorsqu’on poursuit l’ajout de soude. La
constante d’équilibre de cette réaction est K2 = 10
d) Calculer la valeur du pH de la solution lorsque le précipité a presque complètement disparu.
e) Indiquer sur l’axe ci-dessous le domaine de prédominance de l’ion aluminium, de l’hydroxyde
d’aluminium et du complexe [Al(OH)4] –.
f) Ecrire l’équation de la formation du précipité à partir du complexe [Al(OH)4] – lors de l’ajout de l’acide
chlorhydrique. Calculer la valeur de la constante de cette réaction.
g) Ecrire l’équation de la réaction de la formation de l’ion aluminium à partir du précipité lors de l’ajout
de l’acide chlorhydrique. Calculer la valeur de la constante de cette réaction.
2) Formation de l’hydroxyde de fer
- Dans un tube à essais contenant environ 2 mL de sulfate de fer III à 0,05 mol.L-1. Ajouter quelques
gouttes de soude à 2,5 mol.L-1. Noter les observations.
- Séparer alors le mélange dans deux tubes.
- Au premier tube, poursuivre lentement l’ajout de soude. Qu’observe-t-on ?
- Au second tube ajouter quelques gouttes d’acide chlorhydrique à 3 mol.L-1. Qu’observe-t-on ?

TP n°9 Chimie
Partie D : Elaborer un produit de consommation
Classe : Spéc.
Page 2 sur 2
Questions
a) Ecrire la réaction de précipitation de l’hydroxyde de fer qui se forme lorsqu’on ajoute de la soude à la
solution de sulfate ferrique.
b) Sachant que la constante d’équilibre de cette réaction est K1 = 1,0 10 38 déterminer la valeur du pH de
la solution lorsque le précipité commence à apparaître. (On négligera le phénomène de dilution lié à
l’ajout de la soude). Reporter la valeur de ce pH sur l’axe de la partie 1)
c) Ecrire la réaction qui se produit dans le second tube et calculer sa constante d’équilibre.
III/ Extraction des ions aluminium de la bauxite
1) Production industrielle de l’aluminium :
Les principaux constituant de la bauxite sont l'alumine Al2O3 (50 à 60%) et l’oxyde de fer III Fe2O3 (20 à 25%).
Dans un premier temps, on cherche à isoler l’alumine. Ainsi, la bauxite est traitée par une solution de soude. On
obtient alors un précipité de Al(OH)3 qui donne de l'alumine par chauffage.
L'alumine alors obtenue est ensuite introduite dans des cuves d'électrolyse pour produire de l’aluminium
métallique. La production d'une tonne d'aluminium nécessite de 4 à 5 tonnes de bauxite.
2) Extraction de l’alumine
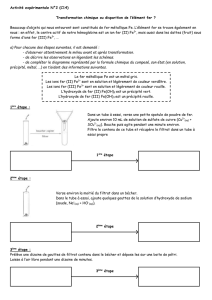
Mode opératoire
- Broyer finement dans un mortier 5 g de bauxite.
- Placer la poudre obtenue dans un bécher et y ajouter 25 mL de soude à 2,5 mol.L-1.
- Chauffer l’ensemble à 80°C tout en agitant.
- Laisser le becher refroidir puis filtrer sur filtre Büchner.
- Récupérer le filtrat dans un erlenmeyer et introduire 0,5 mL de ce filtrat dans un tube à essais pour un
test ultérieur.
- Ajouter dans l’erlenmeyer une solution d’acide chlorhydrique à 3 mol.L-1 jusqu’à ce que le pH soit
voisin de 6. (Vérifier à l’aide d’un papier pH)
- Filtrer le précipité obtenu, le rincer et le sécher à l’étuve à 80°C. On obtient de l’alumine plus ou moins
hydratée.
Questions
a) Pour quelle raison doit-on broyer la bauxite ?
b) Après ajout de la soude, et chauffage, sous quelle forme trouve-t-on l’aluminium ? Même question pour
le fer. Justifier en parlant de la valeur du pH.
c) Expliquer alors l’intérêt de filtrer la solution. Indiquer la nature du précipité et la composition du filtrat.
d) Proposer et effectuer un test permettant de prouver que la purification s’est bien produite et qu’il n’y a
plus d’ion ferrique dans le filtrat.
e) Quelle réaction se produit dans l’erlenmeyer contenant le filtrat lorsqu’on ajoute l’acide chlorhydrique ?
f) Pourquoi est-il nécessaire de surveiller la valeur du pH lors de cet ajout d’acide ?
g) A l’aide de l’axe de pH tracé précédemment, montrer qu’il aurait été possible d’isoler l’aluminium du
fer par ajout d’acide chlorhydrique dans le becher que l’on vient de laisser refroidir sans le filtrer tout
de suite.
3) Obtention de l’aluminium métallique
L'alumine obtenue de la bauxite est ensuite dissoute dans un bain d'électrolyse qui est chauffé entre 950°C et
1000°C dans lequel circule sous 4 V une intensité de l’ordre de 350 000 ampères !
Dans un tel bain, l'alumine s'ionise suivant la réaction : Al2O3 2 Al3+ + 3 O2–
Suivant le principe de l'électrolyse on fait passer un courant électrique entre l'anode et la cathode.
On obtient les réactions suivantes :
Cathode : Al3+ + 3e– = Al
Anode : 2 O2– + C = CO2 + 4e–
(Pour fabriquer une tonne d’aluminium il faut une énergie de 12 000 kWh)
1
/
2
100%