Chimie L`aluminium et ses applications Chap.7

05/11/2013 C07_aluminium.doc 1/2
Spécialité
Thème : Matériaux
Doc + Pb
Chimie
L’aluminium et ses applications
Chap.7
I. Vidéo : C’est pas sorcier sur l’aluminium
C’est pas sorcier sur l’aluminium
1) Quelles sont les principales propriétés de l’aluminium ?
2) Quelles sont les principales utilisations de l’aluminium ?
3) Quelle proportion de l’écorce terrestre représente l’aluminium ?
4) Dans quel minerai trouve-t-on l’oxyde d’aluminium ?
5) Où sont les gisements les plus importants dans le Monde ?
6) Quel procédé permet la séparation de l’aluminium et de l’oxygène contenus dans l’alumine ?
7) Que pensez-vous de l’affirmation de Jamy : « tous les atomes ont une charge électrique ». Quel terme devrait
utiliser Jamy ?
8) Que pensez-vous de l’affirmation de Jamy : « tous les atomes se comportent comme des aimants ». Quel terme
devrait utiliser Jamy ?
9) En quoi est faite l’anode ? Que se passe-t-il à l’anode ?
10) Quelle est l’intensité électrique dans une cuve ?
11) Quels sont les métaux ajoutés à l’aluminium ?
12) Quelle est l’épaisseur d’une feuille de papier aluminium ?
13) Pourquoi l’aluminium est-il 3 fois plus léger que le fer ?
14) Pourquoi l’aluminium est moins attaqué par l’eau que le fer ?
15) Quel danger peut représenter l’ingestion d’aluminium ?
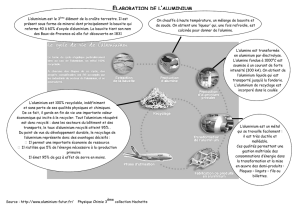
II. Production de l’aluminium (procédé Hali-Héroult)
Le métal aluminium est synthétisé à partir d’un minerai appelé bauxite, dont on extrait l’alumine : Al2O3(s). On
réalise alors une électrolyse en sel fondu : un générateur de courant continu est branché à deux électrodes au
contact d’un liquide résultant de la fusion d’un solide ionique (la cryolithe) à haute température (1 000°C environ),
dans lequel l’alumine est dissoute. Les deux électrodes branchées au générateur sont en carbone graphite : C(gr),
1) On suppose que la dissolution de l’alumine dans l’électrolyte produit des ions aluminium Al3+ et des ions oxyde O2-
. Écrire l’équation de la réaction de dissolution.
2) Écrire la demi-équation oxydant/réducteur traduisant la formation d’aluminium métallique à partir des ions Al3+.
3) Justifier l’obtention d’aluminium liquide au fond de la cuve, sur l’électrode en graphite reliée au pôle négatif du
générateur.
4) Au niveau de l’électrode reliée au pôle positif du générateur, on observe la production de dioxyde de carbone
gazeux. Ajuster la demi-équation oxydant/réducteur correspondante :
... C(gr) + ...O2-(d) = CO2(g) + ...e-
5) Déduire des questions 2) et 4) l’équation de la réaction de la synthèse de l’aluminium par électrolyse.
6) Émettre des hypothèses pour expliquer que l’industrie de l’aluminium est considérée comme l’une des plus
coûteuses, notamment d’un point de vue économique et écologique. Quelle filière doit être développée en
conséquence ?
Données : fus(Al) = 660 °C ; fus(C(gr)) = 3 827°C ; densité de l’aluminium liquide : 2,3 ;
densité de la cryolithe liquide : 2,1.

05/11/2013 C07_aluminium.doc 2/2
III. Problème à résoudre : Du minerai de bauxite à l’aluminium
L'oxyde de fer (III) ou hématite, Fe2O3(s), ne réagit pas avec l'hydroxyde de sodium, Na+(aq) + HO-(aq), alors que
l'oxyde d'aluminium (III) ou alumine, Al2O3(s), réagit avec l'hydroxyde de sodium pour donner le
tétrahydroxoaluminate de sodium, Na+(aq) + [Al(OH)4]-(aq).
Une solution de tétrahydroxoaluminate de sodium traitée par une solution concentrée d'acide chlorhydrique, H+ (aq)
+ Cl-(aq), donne un précipité blanc d'hydroxyde d'aluminium Al(OH)3(s).
Une fois isolé, ce précipité peut être déshydraté par chauffage. On obtient alors de l'alumine pure.
Dans l'industrie, l'alumine est fondue, puis électrolysée pour donner le métal aluminium.
La bauxite est le minerai naturel d'aluminium. Le minerai de bauxite considéré renferme en masse 58,3 %
d'alumine, Al2O3(s), 20,1 % d'oxyde de fer (III), Fe2O3, et 21,6 % d'impuretés, principalement de la silice, SiO2.
Les impuretés présentes dans cette bauxite ne réagissent pas avec l'hydroxyde de sodium.
Proposer un protocole décrivant les diverses étapes de l'extraction de l'alumine contenue dans cette bauxite. On
écrira les équations de toutes les réactions envisagées et on déterminera la masse minimale d'hydroxyde de sodium
solide, NaOH(s), nécessaire à l'extraction de l'alumine présente dans une masse m =1,00 103 kg de bauxite.
Données : M(Na) = 23,0 g.mol-1 ; M(H) = 1,0 g.mol-1 ; M(O) = 16,0 g.mol-1 ; M(Al) = 27,0 g.mol-1
IV. Aluminothermie
Pour réaliser la soudure mue pièces métalliques, par exemple entre rails de chemin de fer, on emploie une
technique de production du fer appelée aluminothermie. Cette méthode repose sur la réaction très exothermique de
la réduction de l'hématite Fe2O3 (s) par l'aluminium en poudre. On peut trouver de nombreuses vidéos montrant ce
procédé sur Internet : Soudure des rails LGV Rhin Rhône RFF
1) La première phase de l’aluminothermie consiste à allumer une mèche constituée de
magnésium (amorçage).
À quoi peut servir cette première phase lors de l'aluminothermie ?
2) Écrire l'équation de sa réaction qui se déroule dans le milieu réactionnel après
l'amorçage, sachant que l'aluminium s'oxyde en alumine, de formule Al2O3 (s)
(constituant les fumées banches observées au cours de la réaction),
3) Quelle température est nécessairement atteinte lors d'une aluminothermie ? En quoi ce
facteur est-il important en vue d'effectuer une soudure ?
4) d. Pourquoi l'aluminothermie ne peut-elle pas être utilisée en vue d'obtenir du fer en
grande quantité ?
Données : fus(Al) = 660°C ; (Fe) = 1 538°C
1
/
2
100%