Vers un modèle unique d`action

1
CHANAL Justine 1°SB
SALLEE Valentine
BARRAU Gwendaline
Notre site : Htpp://roddikjuju.free.fr/tpesite/index.html
Matières utilisées : Chimie + Biologie

2
Sommaire
Page 1 : Présentation
Page 2 : Sommaire
Page 4 : Introduction
Page 4 : Quelques définitions
Page 4 : PARTIE 1 : DROGUES & CERVEAU
Page 4 : I/ Du système nerveux aux neurotransmetteurs
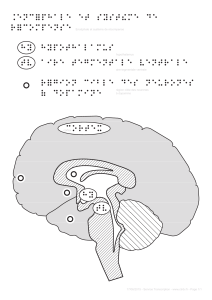
Page 6 : II/ Vers un modèle unique d’action
Page 9 : III Actions et effets
Page 12 : substances par substances, les effets
Page 18 : IV/ Des adaptations néfastes
Page 21 : PARTIE 2 : LES MODIFICATIONS ENTRAINEES PAR LES
STIMULANTS
Page 21 : I/ Présentation des stimulants
Page 21 : II/ Les amphétamines
Page 21 : A. Qu'est-ce que c'est ?
Page 22 : B. Un exemple d'amphétamine:l'ecstasy
Page 23 : 1) Qu'est-ce que c'est ?
Page 23 : 2) Son action sur le cerveau
Page 24 : 3) Son action dans l’organisme
Page 24 : 4) Ses effets
Page 25 : 5) La dépendance et la tolérance
Page 25 : III/ La nicotine
Page 25 : A. Qu'est-ce que c'est
Page 26 : B. Son action sur le cerveau
Page 27 : C. Ses effets
Page 27 : D. Dépendance et tolérance
Page 28 : PARTIE 3 : UN EXEMPLE D’OPIACES : LA MORPHINE
Page 28 : I/ Présentation
Page 29 : II/ L’action de la morphine
Page 29 : A. Le rôle des différentes substances mises en jeu
Page 29 : 1) La morphine endogène ou l'enképhaline
Page 29 : 2) Les récepteurs opioïdes
Page 30 : 3) La substance P
Page 30 : 4) Sérotonine
Page 31 : 5) Les fibres A-delta et C
Page 31 : 6) GABA
Page 31 : 7) La dopamine
Page 31 : B. Les sites d'action de la morphine
Page 31 : 1) Action spinale
Page 32 : 2) Action supraspinale
Page 32 : 3) Action périphérique
Page 32 : 4) Action au niveau du cerveau

3
Page 33 : C. L'action inhibitrice de la morphine
Page 34 : 1) L'action de la morphine dans le contrôle de la douleur
Page 35 : 2) L'action de la morphine pour la sensation d'euphorie
Page 35 : III/ Les effets de la morphine
Page 35 : A. L'effet analgésique
Page 35 : 1) Par l'augmentation du seuil de perception de la douleur
Page 36 : 2) La modification de la perception douloureuse
Page 36 : 3) Durée de l'analgésie
Page 36 : B. Effets sur l'appareil digestif
Page 36 : C. Effets sur l'appareil urinaire
Page 36 : D. Effets respiratoires
Page 36 : 1) Dépression respiratoire
Page 36 : 2) Antitussif
Page 37 : E. Effets cardiovasculaires
Page 37 : F. Effets oculaires
Page 37 : G. Effets comportementaux
Page 37 : H. Effets hormonaux
Page 37 : I. Effets sur l'épiderme
Page 38 : J. Les effets divers
Page 38 : K. La tolérance
Page 38 : L. La dépendance
Page 38 : 1) La dépendance physique
Page 38 : 2) La dépendance psychique
Page 38 : 3) La mise en place de la dépendance
Page 39 : IV/ Conclusion
Page 39 : Conclusion générale
Page 39 : Bibliographie
Page 39 : les sites
Page 40 : les livres
Page 40 : les personnes
Page 40 : pour le site

4
Introduction :
Les drogues sont des substances synthétiques ou naturelle modifiant l’activité mentale et
susceptible de conduire à un état de dépendance constituant la toxicomanie. On pourrait se
demander comment ces substances peuvent-elles modifier la transmission de messages nerveux.
Par exemple, comment la morphine agit-elle pour supprimer la sensation de douleur et provoquer
une sensation d’euphorie ? Ou comment les stimulants accroissent-ils l’activité physique ou
psychique d’un individu ? Tout d’abord, nous verrons l’action des drogues dans le cerveau, ensuite
nous verrons comment agissent la morphine et les stimulants sur l’organisme.
Quelques définitions :
Une DROGUE est toute substance, autre que les aliments, qui est absorbée pour modifier la façon dont le corps
ou l'esprit fonctionne. (Santé Canada) Agissant sur le système nerveux central, l'usage abusif d'une drogue
provoque des perturbations physiques et mentales ainsi qu'un état de dépendance physique, un état de
dépendance psychologique et de tolérance.
Un PSYCHOTROPE est toute substance qui agit sur le psychisme en modifiant le fonctionnement mental,
entraînant des changements dans les perceptions, l’humeur, la conscience, le comportement et diverses
fonctions psychologiques et organiques. Le terme psychotrope signifie littéralement "qui agit, qui donne une
direction (trope) à l'esprit ou au comportement (psycho).
De manière spécifique réfère aux médicaments utilisés dans le traitement de désordres mentaux, tels les
neuroleptiques, les anxiolytiques, etc
PARTIE 1 : DROGUES & CERVEAU
I/ Du système nerveux aux neurotransmetteurs
Le système nerveux de l'homme est constitué de centres nerveux (cerveau et moelle épinière) et
de nerfs reliant ces centres à la périphérie (les nerfs rattachés à la moelle épinière sont appelés
nerfs rachidiens). Les contractions musculaires sont commandées par des messages en
provenance des centres nerveux et transmis par les nerfs. Grâce aux organes des sens,
l'organisme capte en permanence des informations en provenance de son environnement,
informations transmises aux centres nerveux sous forme de messages nerveux. Et tous les
messages nerveux circulent sous la forme d'activité électrique le long de fibres nerveuses. Ces
fibres appartiennent à des cellules nerveuses appelées neurones.
Or le fonctionnement nerveux reposes sur la circulation de signaux dans un réseau complexe de
neurones. Le neurone est l'unité structurale et fonctionnelle du système nerveux. Il est composé
d'un corps cellulaire contenant le noyau, de prolongements courts, les dendrites, et d'un long
prolongement, l'axone. Les neurones forment des chaînes et des circuits neuroniques :
l'extrémité de l'axone est en communication avec les dendrites ou le corps cellulaire d'un autre
neurone, ou avec une cellule musculaire au niveau d'un relais appelé synapse.
Le transfert de l'information d'une cellule à l'autre se fait au niveau des zones de synapses,
c'est-à-dire existe un espace entre la membrane axonale d'un neurone et la membrane
dendritique de l'autre neurone. Le message nerveux passe de la membrane présynaptique vers la
membrane postsynaptique en traversant la fente ou l'espace synaptique ; c'est-à-dire un espace
de taille constante et étroite. La synapse marque l'interruption dans la propagation de l'influx
nerveux bioélectrique, qui est remplacé par un message chimique. Dans la fibre présynaptique, on

5
observe des vésicules qui renferment des molécules appelées neurotransmetteurs ou
neuromédiateurs.
L'arrivée d'un message nerveux conduit à la libération en plus ou moins grande quantité des
neurotransmetteurs contenus dans les vésicules qui s'ouvrent sur la fente synaptique par
exocytose.
Les neurotransmetteurs vont se fixer sur des récepteurs spécifiques situés au niveau de la
membrane de la fibre postsynaptique.
L'action du neurotransmetteur durera plus ou moins longtemps selon l'activité antagoniste
d'enzymes présentes dans la fente synaptique et chargée de réduire la durée de leurs effets. De
plus, une partie des neurotransmetteurs peut-être recapturés par le neurone présynaptique. De
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
1
/
40
100%