TP 10: Etude de transformations forcées

TS TP de chimie n°10 L’électrolyse : une transformation forcée
I. Transformation spontanée et transformation forcée.
1. Transformation spontanée
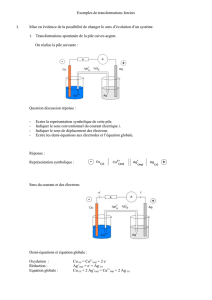
On s’intéresse au système chimique formé par les couples
oxydant/réducteur: Cu2+/Cu et Zn2+/Zn.
Réaliser les deux expériences ci-contre.
Pour chaque expérience, noter vos observations et décrire l’évolution du système chimique.
Conclusion : Dans quel sens évolue spontanément un système chimique formé par les couples Cu2+/Cu et
Zn2+/Zn.
2. Transformation forcée : électrolyse
Réaliser le montage ci-contre. Régler l’intensité du courant I délivré par le
générateur à environ 1 A. Faire fonctionner le dispositif pendant environ
5 minutes et observer attentivement les transformations sur les lames
métalliques et dans la solution.
Reproduire le schéma en faisant apparaitre les observations. Y indiquer le
sens du courant I délivré par le générateur et le sens de déplacement des
électrons dans les parties métalliques du circuit.
En déduire la demi-équation électronique associée à la lame de cuivre et
celle associée à la lame de zinc.
Où se produit la réduction ? l’oxydation ? En déduire la cathode et
l’anode du circuit.
Ecrire l’équation globale modélisant l’évolution du système. La comparer avec la réaction du I.1. Conclure.
II. Fabrication de l’eau de Javel : électrolyse d’une solution aqueuse de chlorure de sodium
Réaliser le montage sous la hotte.
Régler le générateur pour que la tension soit de
l’ordre de 3V. Fermer l’interrupteur et observer.
1. Quelles sont les réactions susceptibles de se
produire à l’anode et à la cathode ?
Données : O2 / H2O Cl2/Cl– H2O / H2 Na+/Na
2. Quels sont les produits effectivement formés ? (la
phénolphtaléine est rose en milieu basique, incolore
sinon. Le dichlore est un gaz vert toxique qui
décolore l’indigo)
3. En déduire l’équation traduisant l’électrolyse.
(Cu2+ + SO42_)
à 0,10 mol/L
+
–
A
Solution de chlorure de sodium
Na+(aq) + Cl–(aq) 1 mol.L–1
électrodes en graphite
indigo
phénolphtaléine

G
+
–
Solution électrolytique
Cu2+(aq) + SO42–(aq)
acide sulfurique
III. Purification des métaux : électrolyse à anode soluble
La purification des métaux par électrolyse est possible
grâce à l'emploi d'une anode soluble. Le métal impur
constitue l'anode : ce métal subit une oxydation et
passe à l'état d'ion en solution. Les impuretés libérées
tombent au fond de l'électrolyseur ou restent en
suspension dans la solution.
Pour illustrer le fonctionnement de cette électrolyse,
on dispose ici d’un fil de cuivre qui matérialisera le
cuivre « impur ». On réalise le montage suivant.
1. Compléter le schéma en indiquant le sens du courant, le sens de circulation des électrons, des
cations et des anions, l’anode et la cathode.
2. Qu’observe-t-on ?
3. La transformation qui se produit est-elle une réaction redox spontanée ou forcée ? Justifier.
4. Ecrire les équations des transformations ayant lieu aux électrodes.
5. En déduire l’équation de la réaction redox caractéristique de l’électrolyse.
6. Pourquoi parle-t-on d’anode « soluble » ?
7. La concentration en ions cuivre(II) varie-t-elle au cours du temps ? Justifier.
8. En fonction du pH de la solution dans laquelle il se trouve, l’élément cuivre peut exister sous deux
formes : Cu2+(aq) pour pH < 5 et Cu(OH)2(s) pour pH > 5. Expliquer qualitativement pourquoi on
ajoute parfois de l’acide sulfurique lors de cette manipulation.
IV. Galvanoplastie : électrozingage (exercice)
Le fer blanc est utilisé dans la fabrication des boîtes de conserve : il s’agit d’un acier recouvert d’étain par
voie électrolytique. L’électrolyte utilisé est une solution contenant des ions étain(II), Sn2+(aq).
L’anode est en étain (anode « sacrificielle »), la cathode est la boîte de conserve. Pour réaliser un bon
étamage, il faut déposer une épaisseur de 50 µm d’étain et une masse de 0,50 g par mètre carré d’acier. Le
générateur utilisé débite un courant d’intensité constante, I = 3,0 A.
On désire étamer une boîte rectangulaire sans couvercle dont les dimensions sont h = 9,5 cm ; L = 10 cm ; p
= 4,5 cm.
1. Ecrire les demi-équations électroniques des réactions qui modélisent les transformations ayant eu
lieu aux interfaces métal-solution des électrodes.
2. Déterminer la surface à étamer.
3. Calculer la perte de masse de l’anode.
4. Calculer la durée de cette électrolyse.
5. Comment varie la concentration en ions étain(II) dans l’électrolyte ?
6. Lors de l’électrolyse, le système chimique respecte-t-il le critère d’évolution spontanée ?
Données : M(Sn) = 118,7 g.mol–1. Couples Sn2+(aq)/Sn(s)

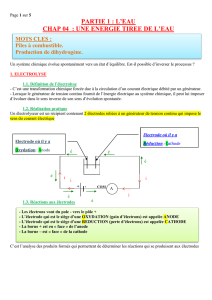
V. Electrloyse de l’eau en milieu acide (exercice)
Un élève réalise le TP suivant :
1. Protocole expérimental
! Port de gants et de lunettes obligatoires lors de la
manipulation de l’acide !
Introduire 125 mL d'eau distillée dans l'électrolyseur.
Remplir les tubes gradués avec de l'eau distillée et les
retourner, sans bulles d'air. Fixer les tubes gradués en
les plaçant légèrement à côté des électrodes.
Ajouter 25 mL d'acide sulfurique dans la cuve de
l'électrolyseur. Homogénéiser délicatement la solution
à l'aide d'un agitateur en verre et ce, particulièrement
entre les électrodes.
Réaliser le montage en série comprenant : un générateur de tension continue réglable, l’électrolyseur, un
multimètre utilisé en mode ampèremètre et un interrupteur. Fermer l’interrupteur et effectuer
rapidement les réglages pour que l’intensité du courant soit égale à 0,30 A. Ouvrir le circuit.
Placer les tubes gradués juste au dessus des électrodes Fermer l'interrupteur tout en déclenchant le
chronomètre. Relever la valeur de l'intensité du courant et la maintenir constante. Observer. L’élève
observe un dégagement gazeux sur chaque électrode.
Arrêter l'électrolyse, lorsque le volume dégagé à une électrode est conséquent et noter la durée de
l'électrolyse. Mesurer les valeurs des volumes dégagés à l'anode et à la cathode. L’élève arrête
l’électrolyse au bout de
t = 15 minutes ; il mesure un volume de gaz de 33 mL à la cathode et 16 mL à
l’anode.
Lorsqu’on approcher une allumette enflammée du tube de la cathode, il se produit une petite explosion.
2. Interprétation
Données : Quelques couples ox/réd…. : O2(g)/H2O H+(aq)/H2(g) S2O82-(aq)/SO42-(aq)
Volume molaire: Vm = 24 L/mol
Charge élémentaire e = 1,6. 10-19 C ; Constante d’Avogadro : NA=6,02.1023mol-1
a. Etude qualitative
Faire un schéma du montage. Indiquer le sens de circulation des électrons dans les parties
métalliques.
Au vu des espèces chimiques présentes initialement, et des observations visuelles, déterminer
parmi les couples proposés ceux mis en jeu lors de l’électrolyse. Ecrire l’équation de la réaction qui
a lieu à chaque électrode.
En déduire l’équation bilan de l’électrolyse.
b. Etude quantitative.
Soit n le nombre d’électrons ayant traversé le circuit pendant la durée t de l’électrolyse.
A partir de la définition de l’intensité du courant électrique, exprimer n en fonction de I, e, NA et t.
Calculer la quantité de matière d’électrons échangés au cours de l’électrolyse.
A partir des demi-équations : exprimer la quantité de matière de gaz formé à chaque électrode en
fonction de n. En déduire le volume de gaz formé en fonction de n. Calculer le volume de
dihydrogène et de dioxygène formé.
Est-ce en accord avec les volumes mesurés ? Calculer l’écart relatif pour chacun des deux gaz.

V. Electrloyse de l’eau en milieu acide (exercice)
Un élève réalise le TP suivant :
1. Protocole expérimental
! Port de gants et de lunettes obligatoires lors de la
manipulation de l’acide !
Introduire 125 mL d'eau distillée dans l'électrolyseur.
Remplir les tubes gradués avec de l'eau distillée et les
retourner, sans bulles d'air. Fixer les tubes gradués en
les plaçant légèrement à côté des électrodes.
Ajouter 25 mL d'acide sulfurique dans la cuve de
l'électrolyseur. Homogénéiser délicatement la solution
à l'aide d'un agitateur en verre et ce, particulièrement
entre les électrodes.
Réaliser le montage en série comprenant : un générateur de tension continue réglable, l’électrolyseur, un
multimètre utilisé en mode ampèremètre et un interrupteur. Fermer l’interrupteur et effectuer
rapidement les réglages pour que l’intensité du courant soit égale à 0,30 A. Ouvrir le circuit.
Placer les tubes gradués juste au dessus des électrodes Fermer l'interrupteur tout en déclenchant le
chronomètre. Relever la valeur de l'intensité du courant et la maintenir constante. Observer. L’élève
observe un dégagement gazeux sur chaque électrode.
Arrêter l'électrolyse, lorsque le volume dégagé à une électrode est conséquent et noter la durée de
l'électrolyse. Mesurer les valeurs des volumes dégagés à l'anode et à la cathode. L’élève arrête
l’électrolyse au bout de
t = 15 minutes ; il mesure un volume de gaz de 33 mL à la cathode et 16 mL à
l’anode.
Lorsqu’on approcher une allumette enflammée du tube de la cathode, il se produit une petite explosion.
2. Interprétation
Données : Quelques couples ox/réd…. : O2(g)/H2O H+(aq)/H2(g) S2O82-(aq)/SO42-(aq)
Volume molaire: Vm = 24 L/mol
Charge élémentaire e = 1,6. 10-19 C ; Constante d’Avogadro : NA=6,02.1023mol-1
a. Etude qualitative
Faire un schéma du montage. Indiquer le sens de circulation des électrons dans les parties
métalliques.
Au vu des espèces chimiques présentes initialement, et des observations visuelles, déterminer
parmi les couples proposés ceux mis en jeu lors de l’électrolyse. Ecrire l’équation de la réaction qui
a lieu à chaque électrode.
En déduire l’équation bilan de l’électrolyse.
b. Etude quantitative.
Soit n le nombre d’électrons ayant traversé le circuit pendant la durée t de l’électrolyse.
A partir de la définition de l’intensité du courant électrique, exprimer n en fonction de I, e, NA et t.
Calculer la quantité de matière d’électrons échangés au cours de l’électrolyse.
A partir des demi-équations : exprimer la quantité de matière de gaz formé à chaque électrode en
fonction de n. En déduire le volume de gaz formé en fonction de n. Calculer le volume de
dihydrogène et de dioxygène formé.
Est-ce en accord avec les volumes mesurés ? Calculer l’écart relatif pour chacun des deux gaz.
1
/
4
100%