Les récepteurs T (TCR)

DAVID Nathalie 11/10/10
LACAZE Cécile Master
1
Les récepteurs T (TCR)
I. Comparaison Ig et TCR
Les immunoglobulines:
Elles contiennent une chaîne lourde et une
chaîne légère.
Le fragment Fc (constant) confère des
propriétés biologiques particulières aux Ig.
Le fragment Fab comprend une région
variable et une région constante réunies par
un pont disulfure.
Deux sites sont capables de fixer
l'antigène.
Les TCR:
Ce sont des hétérodimères. On distingue deux populations lymphocytaires T en fonction de
l'hétérodimère exprimé. Un lymphocyte T exprime soit un récepteur TCR αβ (85% des LT
sanguins) soit un récepteur TCR γδ (ce dernier est comparable au dimère des Ig, moins de
5% des LT sanguins), mais jamais les deux ensembles. Le mode de reconnaissance des deux
TCR est probablement différent.
Il y a un seul site de reconnaissance de l'antigène.
Tout comme pour les Ig, le TCR contient une région variable ainsi qu'une région constante.
Les TCR ont deux régions transmembranaires et deux régions cytosoliques courtes.
TCR ne peut jamais être exprimé sans CD3 !
Les deux chaines α et β sont glycosylées, elles portent des carbohydrates fixés à des
Asparagines. On dit qu'ils sont N-liés.
Points importants:
Les Ig peuvent exister sous forme soluble tandis que le TCR est toujours exprimé à la
surface des lymphocytes T (LT).

DAVID Nathalie 11/10/10
LACAZE Cécile Master
2
Les Ac reconnaissent les Ag sous forme d'épitopes (repliement conformationnel).
Les TCR peuvent reconnaître des peptides entièrement enfouis dans la structure des
cellules en association avec les molécules du complexe majeur d'histocompatibilité
(MHC).
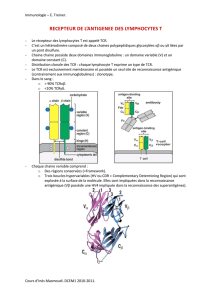
Le complexe moléculaire CD3:
Il est constitué de différentes chaines protéiques: delta (δ), epsilon (ε), gamma (γ). CD3 est
indispensable pour la reconnaissance de TCR. Sa fonction est de transduire un signal
d'activation cellulaire lorsque le TCR est activé.
Cas particulier: les résidus à l'intérieur d'une membrane lipidique sont habituellement
hydrophobes, cependant dans ce cas, la région transmembranaire (résidus α, β et ζ) de TCR
est chargée (voir diapo n°3). Les charges permettent de stabiliser les interactions entre les
chaines.
Les rectangles jaunes sur le schéma représentent les résidus Tyrosine phosphorylés qui
servent de site d'ancrage et d'adaptateurs impliqués dans la transduction du signal.
Diapo 3 : Les hétérodimères α et β du
TCR sont associés avec un complexe de
quatre chaines (2 × ε, γ, δ) appelées CD3.
TCR est aussi associé avec un
homodimère de chaines ζ qui contient des
séquences qui signalent à la cellule que
l’antigène s’est lié au TCR. Il semble que
la chaine α interagisse avec le dimère
CD3δε et le dimère ζ alors que la chaine β
interagit avec le dimère CD3γε. Ces
interactions sont médiées par deux charges
positives dans la région transmembranaire
de TCR α et par une charge positive dans
la région de TCR β. Des charges négatives
dans les domaines transmembranaires de
CD3 et de ζ interagissent avec les charges
positives de α et β.
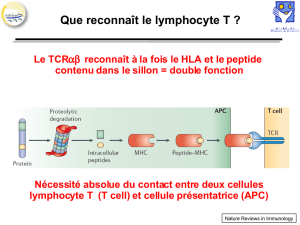
II. Les CMH
MHC classe 1
TCR αβ reconnaît des peptides présentés par des molécules du CMH.
Le complexe MHC de classe I est formé par l'association non covalente d'une chaine lourde
α polymorphe transmembranaire et d’une chaine légère non polymorphe, la β2
microglobuline. La chaine lourde possède 3 domaines extracellulaires: α1, α2, α3. (Fig 3-
20)

DAVID Nathalie 11/10/10
LACAZE Cécile Master
3
Le complexe MHC de classe I a été étudié par cristallographie, ce qui a permis de
comprendre que sa structure est constituée par un repliement dont la propriété est de former
une poche permettent de fixer un peptide (il y a une cavité entre les domaines α1et α2, c'est
dans ce sillon que se fixe le peptide). Le repliement est constitué d'une série de feuillets β.
Ces peptides sont des protéines endocellulaires dans 95 à 99% des cas. Ils sont
immunogènes et donc reconnus par les LT.
Une molécule MHC classe I est un
complexe trimèrique: elle est constituée
d'une chaine lourde (α1, α2, α3), d'une β2
microglobuline et du peptide.
Par exemple: si un virus infecte les
hépatocytes, il y a production de protéines
virales qui sont découpées, des peptides
sont présentés à la surface des hépatocytes
et seront reconnus par les LT CD8.
TAP 1 et TAP 2 (uniquement pour les CMH de classe I)
Ce sont des transporteurs qui permettent la translocation des peptides dans la lumière du
réticulum endoplasmique.
Après d’autres étapes, les peptides se retrouveront finalement à la surface des CMH.
Séquençage des peptides fixés aux MHC classe Ia:
Ce séquençage a permis de mettre en évidence que les CMH contiennent soit les mêmes
résidus, soit des résidus ayant les mêmes propriétés physico-chimiques (Ex: Tyr et Phe se
ressemblent cf diapos). Ce sont en fait des résidus d'ancrage qui permettent la fixation du
peptide au sein de la poche des molécules CMH classe I (ex: Tyr, Val, Ile = résidus
hydrophobes qui pénètrent dans la MHC et interagissent avec la poche hydrophobe). Les
peptides des MHC classe I ont environ tous la même taille, ils contiennent en moyenne
entre 8 et 10 résidus.
La cristallographie a montré qu'au niveau N-ter et C-ter, la poche est fermée. Des résidus
Tyrosine établissent des liaisons hydrogène aux deux extrémités ce qui permet de maintenir
cette poche fermée.
La taille fixe des peptides provient donc du fait que la poche qui les contient est fermée.
Dans la majorité des cas ce sont des peptides du soi à la surface des CMH.
En général, dans la région centrale le peptide forme une courbure: il est très exposé.
Les MHC classe Ia sont polymorphes, c'est-à-dire qu'ils expriment différents allèles et ce à
une fréquence supérieure à 1%.
Quand on compare leur séquence, on s'aperçoit que les résidus qui varient sont situés au
fond de la poche ou au niveau des hélices α qui pointent vers l'intérieur de la poche. D'un
individu à l'autre les résidus sont différents.

DAVID Nathalie 11/10/10
LACAZE Cécile Master
4
Les MHC classe II
Ce sont des glycoprotéines
transmembranaires hétérodimères
constituées d'une chaine α et d'une chaine
β. Chaque chaine présente deux domaines
extra membranaires (α1 et α2, β1 et β2)
associés par une courte séquence à une
région transmembranaire et à un domaine
intracytoplasmique. Les domaines les plus
externes α1 et β1 sont les plus
polymorphes. Ils s'associent étroitement
pour former une cavité qui reste ouverte
aux 2 extrémités (celle du CMH-I est
fermée).
Il est très difficile de réaliser des cristaux de protéines transmembranaires, car il faut
solubiliser les protéines avec des détergents. Cependant on peut les reconstituer in vitro
grâce à leurs domaines extracellulaires.
La différence essentielle entre MHC classe I et MHC classe II réside dans le fait que la
poche contenant le peptide n'est pas fermée pour les MHC classe II. Ainsi, les peptides
ont une taille variable, contrairement aux peptides de MHC classe I. De plus, les peptides
associés aux CMH-II ont une position plus étendue.
Les MHC-II ne sont pas polymorphes.
Au niveau de la poche, des interactions avec les hélices α (liaisons hydrogène) permettent
de stabiliser la poche sur toute sa longueur.
Tout comme pour les MHC classe I, on a pu mettre en évidence que les peptides présentent
des propriétés physico-chimiques similaires (ancrage au fond de la poche).
La totalité des variabilités est retrouvée au
fond de la poche : au niveau de α1 et α2 pour
MHC classe I, et au niveau de β1 pour les
MHC classe II (voir diapo n°11).
La totalité des variabilités est ainsi retrouvée au niveau des résidus situés au fond de la
poche ou sur les hélices α qui pointent vers l'intérieur de la poche.

DAVID Nathalie 11/10/10
LACAZE Cécile Master
5
Les peptides dans la poche sont différents chez deux individus. Ainsi chaque personne aura
des populations de LT tolérants à des CMH différents.
Suite aux études de cristallographie, on a pu mettre en évidence les conformations suivantes
des peptides en superposant les peptides de classe I et II:
classe Ia → bosse importante (TCR αβ reconnaît la Tyr qui pointe vers l'extérieur)
classe Ib → conformation allongée
TCR αβ ressemble à un Fab d'immunoglobuline.
Les boucles importantes correspondent aux régions hypervariables (reconnaissance de l'Ag)
CDR1, CDR2 et CDR3. Cette dernière est la région la plus variable, aussi bien chez les Ig
que pour TCR.
Arrangement des différentes boucles (diapo n°16):
NH3-ter Vα - CDR1α + CDR2α - CDR3α – CDR3β - CDR1β + CDR2β - Vβ COOH-ter
CDR3 est situé en position centrale. CDR3 α
et CDR3 β établissent des liaisons avec le
peptide tandis que CDR1 α et CDR2 α
participent aux interactions avec les hélices
α du CMH.
Contrairement aux Ig, TCR doit reconnaître à la fois le peptide replié et la molécule du
MHC.
III. Les molécules CD4 et CD8
Ce sont des marqueurs usuels des LT.
CD4 = chaine unique à 4 domaines (diapo n°18): D1, D2, D3 et D4
D1 et D2 ont un repliement de type domaine variable d’Ig.
CD8 = hétérodimère: 2 domaines α et β avec des régions à repliement de type Ig. Il y
a un pont disulfure entre ces domaines.
Les LT CD4+ interagissent avec les cellules qui présentent des peptides antigéniques sur
les molécules de classe II du CMH. Les LTCD4+ sont dits LT « helper ».
Les LT CD8+ interagissent avec les cellules qui présentent des peptides antigéniques sur
les molécules de classe I du CMH. Les LT CD8+ sont dits LT cytotoxiques.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%