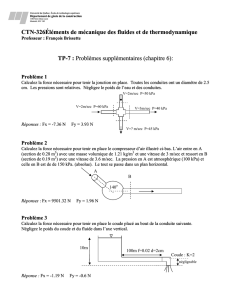
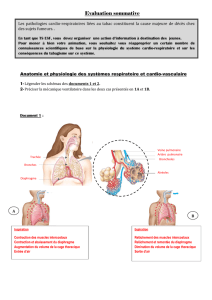
[ CO ] RT x [ H2O ] RT

CHIMIE DES SOLUTIONS Chapitre 3 Solution-3-1
E-1 D'après la loi d'action de masse Kc = [ produits ]p
[ réactifs ]r
alors Kc = [ O3 ]2
[ O2 ]3
et Kp = [ PO3 ]2
[ PO2 ]3
et puisque P = [ ] R T,
[ ] = P
R T
Kc = [ O3 ]2 = ( PO3 / R T )2 = ( PO3 )2 R-2 T-2
[ O2 ]3 ( PO2 / R T )3 ( PO2 )3 R-3 T-3
Kc = Kp R T
E-2 Il faut se rappeler que la concentration d'un solide n'entre pas dans l'expression
mathématique de la constante d'équilibre. L'expression générale de la constante
d'équilibre est :
Kc = [ produits ]p Kp = ( PProduits )p
[ réactifs ]r ( PRéactifs )r
a) Kp = PCO x PCl2
PCOCl2
b) Kc = [ CH3COOC2H5 ] [ H2O ]
[ C2H5OH ] [ CH3COOH ]
c) Kp = PCO x PH2O
PCO2 x PH2
d) Kp = ( PH2 )½ x ( PI2 )½
PHI
e) Kc = [ I2 ]
f) Kp = PCO2
g) Kp = ( PNOCl )2
( PNO )2 x PCl2
h) Kp = PNH3 x PH2S

CHIMIE DES SOLUTIONS Chapitre 3 Solution-3-2
E-3 Kc = [ NO2 ]2
[ N2O4 ]
Kp = ( PNO )2 = ( [ NO2 ] R T )2 = Kc R T
PN2O4 [ N2O4 ] R T
Kp = 9.21 x 8.315 x ( 25 + 273.2 ) = 2.28 x 104
E-4 Kp = ( PSO3 )2 = ( [ SO3 ] R T )2
( PSO2 )2 ( PO2 ) ( [ SO2 ] R T )2 ( [ O2 ] R T )
= Kc / R T
Kp = 2.79 / 8.315 x 1000
Kp = 2.79 x 8.315 x 1000 = 3.36 x 10—4
E-5 Il faut écrire l'expression mathématique permettant de calculer Kc et y introduire
les valeurs des concentrations а l'équilibre :
Kc = [ N2 ] [ H3 ]3 = 4.00 M x ( 2.00 M )3 = 1.12 ( M2 )
[ NH3 ]2 ( 5.35 M )2
E-6 Sachant Kp = ( PNH3 )2
PN2 x ( PH2 )3
2.75 x 10—6 = ( 1415 KPa )2 d'où PH2 = 900 KPa
1000 KPa x ( PH2 )3
E-7 Il faut déterminer la relation entre Kc et Kp pour ensuite pouvoir calculer la valeur
de Kc à partir de Kp :
Kp = PCO2 x PH2 = [ CO2 ] R T x [ H2 ] R T = Kc
PCO x PH2O [ CO ] R T x [ H2O ] R T
Kc = Kp = 50.0 KPa x 70.7 KPa = 4.94
17.7 KPa x 40.4 KPa
E-8 Il faut écrire l'expression mathématique permettant de calculer Kp et, par
stoechiométrie, déterminer les quantités de Hg (g) et O2 (g) à l'équilibre puis, calculer la
valeur de Kp :
Kp = PHg x ( PO2 )½

CHIMIE DES SOLUTIONS Chapitre 3 Solution-3-3
Or, on dit que 50% des 1.24 g de HgO de décompose
Calculer le nombre de moles de HgO qui réagit et le nombre de moles de porduits
formés
HgO(s)
<--->
Hg ( g )
+
2 O2 (g)
Ini
1.24 g / 216.59 g/mol
(5.73 x 10-3 mol )
xxx
xxx
Réagi
-2.87 x 10-3 mol
+2.87 x 10-3 mol
1.43 x 10-3 mol
équilibre
2.86 x 10-3 mol
+2.87 x 10-3 mol
1.43 x 10-3 mol
2.86 x 10-3 mol / L
+2.87 x 10-3 mol / L
1.43 x 10-3 mol / L
Puisque le volume est de 1.00 litre, la concentration а l'équilibre de chacun est
égale à mole / volume, soit 2.87 x 10-3 mol/L pour Hg et 1.43 x 10-3 mol/L pour O2 .
Calculer la pression de chaque gaz à l’aide de la loi des gaz :
PV = n R T P = n R T
V
PHg = 2.86 x 10-3 mol x 8.315 L Kpa x ( 400 + 273.2 ) K
1.00 L
= 16.0 KPa
PO2 = 1.43 x 10-3 mol x 8.315 L Kpa x ( 400 + 273.2 ) K
1.00 L
= 8.00 KPa
Kp = PHg x ( PO2 )½
= 16.0 KPa x ( 8.00 KPa )½
= 45.3
E-10 D'après la loi d'action de masse Kc = [ produits ] p
[ réactifs ] r
alors Kc = 1
[ CO2 ] [ NH3 ]2
et Kp = 1
( PCO2 ) ( PNH3 )2

CHIMIE DES SOLUTIONS Chapitre 3 Solution-3-4
et puisque P = [ ] R T
Kp = 1 = 1
( PCO2 ) ( PNH3 )2 ( [ CO2 ] R T ) ( [ NH3 ] R T )2
Kp = 1 = Kc
( [CO2 ] [ NH3 ] ) R3 T3 R3 T3
Kc = Kp R3 T3
E-11 Il faut, par stoechiométrie, déterminer les concentrations а l'équilibre, puis
calculer la valeur de Kc :
Kc = [ PCl3 ] x [ Cl2 ]
[ PCl5 ]
[ PCl5 ] = 3.00 moles / 2.00 L = 1.50 M
PCl5
<--->
PCl3
+
Cl2
Ini
1.50 M
xxx
xxx
Réagi
( 30% ) - 0.45 M
+ 0.45 M
+ 0.45 M
équilibre
1.05 M
0.45 M
0.45 M
Kc = ( 0.45 M ) x ( 0.45 M ) = 0.19
1.05 M
E-12 Il faut déterminer la pression de chaque gaz pour calculer la valeur de Kp .
Kp = ( PHg )2 x PO2
Par stoechiométrie, il y a 2 fois plus de molécules de Hg que de O2 , donc la
pression partielle du Hg est deux fois plus grande que la pression partielle de O2 .
PHg = 2 PO2
de plus Ptot = PHg + PO2
108 KPa = 2 PO2 + PO2
PO2 = 36 KPa
et PHg = 2 x 36 KPa = 72 KPa
Kp = ( 72 KPa )2 x 36 KPa = 1.87 x 105

CHIMIE DES SOLUTIONS Chapitre 3 Solution-3-5
E-14 a) 2 NO2(g) <===> N2O4(g)
b) Pour déterminer Kc il faut déterminer par stoechiométrie ( et en M ) les
concentrations à l'équilibre de chaque gaz, puis écrire l'expression
mathématique permettant de calculer Kc :
moles initilales de NO2 = masse NO2
M molaire NO2
= 0.617 g / 46.0055 g/mol
= 0.0134 mol
[ NO2 ] = moles NO2
V
= 0.0134 mole / 0.500 L
= 0.0268 M
2 NO2
<--->
N2O4
Ini
0.0268 M
xxx
Réagi
- 0.0268 x 70%
-0.0188 M
+ ½ x ( 0.0188 M )
+0.0094 M
équilibre
0.0080 M
0.0094 M
Kc = [ N2O4 ] = ( 0.0094 mol ) = 147 ( devrait
[ NO2 ]2 ( 0.0080 mol )2 avoir 2 cs )
c) Pour déterminer Kp il faut déterminer la pression de chaque gaz et écrire
l'expression mathématique permettant de calculer Kp :
PN2O4 = ( nN2O4 / VN2O4 ) x R x T ( par P V = n R T )
= ( 0.0094 mol / L ) x 8.315 KPa L x 300 K = 23 KPa
mol K
PNO2 = ( nNO2 / VNO2 ) x R x T
= ( 0.0080 mol / L ) x 8.315 KPa L x 300 K = 20 KPa
mol K
Kp = PN2O4 = 23 KPa = 0.0575 ( devrait
 6
6
 7
7
 8
8
1
/
8
100%