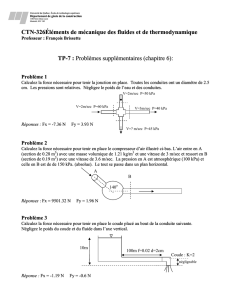
Comportement des gaz

Comportement des
gaz

4 variables sont nécessaires pour
définir le comportement des gaz.
Pression (P): dépend du nombre de collisions
des particules de gaz
Température (T): est une mesure de
l’énergie cinétique des particules
Volume(V): correspond à l’espace occupé
par le gaz
Quantité de gaz (n): correspond au nombre de
particules contenues dans l’échantillon de gaz

Normes relatives aux conditions
d’étude des gaz
TPN: température et pression normales
0oC et 101,3 kPa
TAPN: température ambiante et pression
normale25oC et 101,3 kPa

Étude du comportement des gaz
Expérimentalement, les variables seront
étudiées 2 à 2. (ex. pression et volume)
Les 2 variables qui ne font pas partie de
l’étude devront rester constantes. (ex.
température et nombre de moles)

Relation pression - volume
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%