Les cellules rares circulantes, un outil pour la

Abréviations :
- CRC : Cellules Rares Circulantes
- CTC : Cellules Tumorales Circulantes
- CFC : Cellules Fœtales Circulantes
UE 11 – Parcours N°3 – cours n°6
20/01/2016
Pr Patrizia Paterlini-Bréchot
patriziapaterlini@gmail.com
RT : Sophie Baltassis,
Alexandre Meunier
RL : Victor Quentin
Les cellules rares circulantes, un outil pour la médecine de demain :
personnalisée, prédictive et non invasive
Plan :
Avant-propos
1. Les cellules rares circulantes (CRC)
2. Les cellules tumorales circulantes (CTC)
a. Organes d’implantation préférentielle des métastases
b. Prérequis et étapes de l’invasion métastatique
c. Inefficacité de l’invasion métastatique
d. Applications : diagnostic et adaptation de traitements
e. Diagnostics de cancers
3. Les cellules fœtales circulantes (CFC)
Mot des RT
Il faut bien comprendre que la méthode ISET (développée par l’équipe de Patrizia Paterlini)
est une méthode de filtration du sang ; elle ne peut être considérée comme une méthode
diagnostique seulement si elle est associée à la cytopathologie.
Les exemples de cas cliniques et d'études sont indiqués en italique.

Avant-propos
Ce cours est axé sur un nouveau domaine de la médecine qui prévoit de pouvoir faire des
tests non invasifs (sans extraction corporelle), c'est-à-dire par la biais d’une simple prise de
sang (biopsie liquide). Cette méthode représente bien la médecine moderne qui se veut adaptée
à l'individu et non basée sur des critères généraux.
Cette filière de la médecine prend appui sur une découverte récente : en plus des cellules
sanguines communes (globule rouge ou globule blanc), on retrouve dans le sang des cellules
extrêmement rares.
1. Les cellules rares circulantes (CRC)
Les CRC sont présentes en très petite quantité dans le sang de chaque individu ; on en
compte d’une à quelques-unes par millilitre de sang, soit une cellule pour 10 millions de
leucocytes ou encore une cellule pour 5 milliards d’érythrocytes. Elles ne sont donc pas visibles
lors des examens courants du sang, où l’on prélève de 20 à 50mL de sang.
On distingue cinq types de CRC :
Les cellules tumorales qui représentent l’intermédiaire entre la tumeur primitive et la
métastase. Les cellules tumorales restent plusieurs années dans le sang avant la
formation éventuelle de métastases. Ainsi, on peut détecter ces cellules avant la
formation d'une métastase et intervenir de façon précoce.
Les cellules épithéliales non tumorales, d’origine organique. Les cellules d'origine
organique circulantes ne sont pas toujours tumorales : on peut en retrouver dans le sang,
typiquement après une inflammation. Cette caractéristique physiologique nécessite
ainsi d’opérer une distinction entre les cellules tumorales et non tumorales.
Les cellules endothéliales, diffusées dans le sang à partir de la paroi intérieure des
vaisseaux dans deux situations distinctes :
o maladie tumorale accompagnée d’une angiogenèse et d’une augmentation de
la production de cellules endothéliales (d’où l’utilisation de traitements
angiostatiques suivis par des comptages de cellules en thérapie) ;
o vasculopathie (comme l’infarctus) qui entraîne une lésion des vaisseaux et le
départ de cellules endothéliales dans le sang.
Les cellules souches, de nature hématopoïétique principalement, sont extrêmement
rares. Elles intéressent la médecine régénérative.
Les cellules fœtales (cf. 3.), dont la découverte permet de conclure sur l’absence de
perméabilité complète du placenta.

2. Les cellules tumorales circulantes (CTC)
La tumeur primitive seule n'est pas souvent létale, sauf si elle est localisée dans le cerveau
ou à proximité d'une artère, par exemple. Ce sont les métastases qui causent généralement la
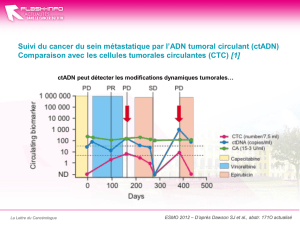
mort des patients. L’objectif de l’exploitation des CTC est ainsi l’élaboration de méthodes
visant à diagnostiquer des cancers précocement, avant l’apparition de métastases.
Les métastases représentent la survie et la croissance de cellules tumorales à distance de
leur lieu d’origine. Elles reflètent l’expression de la malignité et de la létalité de la tumeur. La
capacité d’un cancer de donner des métastases n’est pas la même dans les différents organes :
il y a des terrains plus ou moins favorables. Ainsi, la mécanique de formation des métastases
est globalement inefficace, sélective, et multiétapes : la cellule doit perdre un nombre important
de propriétés, comme le déclenchement de l’apoptose en cas de détachement de l’édifice
épithélial.
a. Organes d’implantation préférentielle des métastases
Cancer
Métastase préférentielle
Foie
Poumons
Colon, pancréas, estomac
Foie
Prostate
Os
Poumons
Os, cerveau
Note : le cancer du foie donne en règle générale peu de métastases, malgré la circulation des
cellules tumorales dans le sang. Les cellules tumorales d’origine hépatique doivent atteindre un
état très indifférencié pour devenir métastatiques.
Comme pour l’image de la « graine et du terrain », les cellules tumorales ont besoin d'un
terrain approprié pour pouvoir proliférer. Ces préférences concernent l'environnement offert
par les organes, notamment les facteurs de croissance présents.
C’est par exemple le cas des cellules tumorales hépatiques qui ont une nette préférence
pour le foie. Il a été montré que ces cellules passent dans le sang et reviennent parfois au niveau
du foie pour former d'autres foyers tumoraux à proximité de la tumeur primitive. En cas
d'ablation de la tumeur primitive, il existe alors un risque de réimplantation de la tumeur sur le
foie.
b. Prérequis et étapes de l’invasion métastatique
Différents facteurs sont nécessaires au développement tumoral. L’angiogenèse tumorale
joue ici un rôle prépondérant : elle intervient quand le volume tumoral atteint 1 ou 2 mm3,
permet la survie, la prolifération, la différenciation et participe à la migration. Cependant, des
tumeurs de plus petite taille sont également capables de se disséminer.
C'est un phénomène important pour le diagnostic : les cellules tumorales peuvent
commencer à diffuser avant même que la tumeur ne soit visible en imagerie. La détection des
CRC permettent donc un diagnostic très précoce de cancers invasifs.

Étapes de l’invasion métastatique :
i. Perte d'adhésion cellulaire. La cellule tumorale perd ses molécules d'adhésion et de
connexion, comme les intégrines (permettent la communication entre cytosquelette et
matrice extracellulaire) ou les cadhérines, et commence une transformation qui va la
rendre plus semblable à une cellule mésenchymateuse qu'à une cellule épithéliale ; on
parle de transition épithélio-mésenchymateuse. Les cellules tumorales sont
extrêmement plastiques et peuvent se transformer facilement. Elles ont ainsi une
structure qui leur permet de migrer d'abord dans les tissus, puis dans le sang et à nouveau
dans les tissus grâce au mécanisme inverse de transition mésenchymo-épithéliale.
ii. Production d'enzymes par la cellule tumorale. Ces enzymes protéolytiques
permettent la dégradation de la matrice extracellulaire ainsi que le développement de
pseudopodes pour permettre la migration dans le tissu (gènes de l’actine et différents
oncogènes comme le MSF ou le HGF). Ces enzymes sont en équilibre avec leurs
inhibiteurs respectifs. Les cellules tumorales expriment par ailleurs des antigènes pour
se cacher au système immun.
iii. Franchissement de la membrane basale. Les cellules qui parviennent à franchir la
membrane basale sont souvent incapable de proliférer. Leur évolution est indépendante
et l’accumulation de mutations les conduisent à proliférer.
iv. Arrivée dans un vaisseau sanguin. Les cellules tumorales franchissent la paroi
endothéliale, événement favorisé par la recherche de nutriments et de dioxygènes. Elles
peuvent alors migrer dans le vaisseau, mais aussi « ramper » le long de l’endothélium.
Ce phénomène est également retrouvé au niveau des nerfs où certaines cellules migrent
le long des terminaisons nerveuses.
v. Circulation sanguine et migration. Dans certaines conditions, les cellules
métastatiques tumorales peuvent s’agréger entre elles ou avec des plaquettes. Ces
microemboles tumoraux peuvent être arrêtés dans les microvaisseaux d’un organe et
développer une nouvelle tumeur à cet endroit. Ce risque est d’autant plus accru quand
les cellules tumorales emportent des fibroblastes et des cellules du stroma de leur milieu
d’origine : le terrain devient plus favorable à la prolifération. Ce phénomène
d’agrégation plaquettaire des cellules tumorales peut être contré par certains
antiagrégants plaquettaires comme l’Aspirine.
Pour les métastases il existe des gènes qui favorisent leur formation et d'autres qui
l'empêchent, à l’image des proto-oncogènes et des antioncogènes (pour les tumeurs). Parmi les
gènes suppresseurs de métastases, on peut citer :
E-cadhérine qui favorise l'adhésion cellulaire ;
Nm23 qui agit sur l'adhésion cellulaire, l’assemblage des microtubules, la mobilité
cellulaire et la transduction du signal.

c. Inefficacité de l’invasion métastatique
La formation des métastases reste cependant un processus inefficace. Chez l'animal, à
peu près une cellule tumorale sur 10 000 qui passe dans le sang est capable de former une
métastase ; chez un sujet moyen qui dispose de 5L de sang, on estime le nombre de CTC à
5000, ce qui est bien inférieur à 10 000.
Il est très difficile d’observer la sortie des cellules tumorales dans le sang. Pour étudier
ce phénomène, des chercheurs ont injecté directement des cellules tumorales chez des animaux.
À J3, 80% des cellules sont extravasées (dans le sang) et une sur 40 forme des micrométastases
(tumeurs secondaires de 4 à 16 cellules). À J13 une cellule sur 10 000 a formé une métastase.
Par ailleurs, certaines cellules restent en « repos » : elles ne sont pas détruites et ne forment pas
non plus de métastase.
Certains mécanismes viennent expliquer cette inefficacité :
- Les CRC restent des années dans le sang avant d'éventuellement former une
métastase : l'invasion débute 5 à 10 ans avant le diagnostic de cancer, lorsque la
tumeur est visible à l'imagerie. L’invasion tumorale est un processus précoce.
- Le détachement de la tumeur à l’édifice épithélial entraîne son apoptose.
- Les cellules tumorales font face aux attaques du système immunitaire.
- Les cellules sont fragiles : leur structure est modifiée et leur passage dans différents
organes entraîne leur lyse progressive.
- Les cellules ont une difficulté importante à s’arrêter dans les organes pour
s’implanter.
- Après implantation, certaines cellules ne sont pas capables de proliférer du fait de
l’absence de certains facteurs de croissance par exemple. Une réaction
inflammatoire stimule cependant la prolifération.
- Peu de micrométastases donnent d’autres métastases. Les cellules en état de
« repos » ne prolifèrent pas. 0,01% des cellules tumorales donnent des métastases et
0,1% des microemboles donnent des métastases.
Par ailleurs, certaines tumeurs primitives peuvent produire de l’angiostatine qui bloque
la prolifération des cellules tumorales dans les tissus à distance et augmente ainsi leur risque
d’apoptose. Ce facteur définit également le passage au « repos » de certaines cellules
métastatiques.
Exemples de conséquences cliniques.
Cas clinique 1 : un patient avec métastases non visibles a été opéré pour enlever sa
tumeur primitive du poumon. Après l'intervention chirurgicale, les métastases ont
« flambé », apparaissant un peu partout, avec un développement rapide.
Cas clinique 2 : Une femme qui avait été traitée pour un mélanome et qui était
considérée guérie depuis des années a été donneuse de reins. Les receveurs ont été
traités par immunosuppresseurs et sont morts d’un mélanome disséminé.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%