Acides, bases et sels

ACIDES, BASES ET SELS
Les composés qui, en solution aqueuse (du latin "aqua", eau), contiennent des ions sont classés en
acides, bases ou sels.
Un acide est un composé qui, dans l'eau, libère des protons, c'est-à-dire des ions hydrogène, H +.
Remarque : Pour les puristes, notons qu'en fait l'ion H + n'est pas libre mais qu'il forme avec
une molécule d'eau l'ion oxonium (ou hydronium) H3O +.
Une base est un composé qui, en solution aqueuse, forme des ions hydroxyles, OH -.
Un sel est un composé qui libère dans l'eau des ions positifs provenant de la base et des ions
négatifs provenant de l'acide.
Caractéristiques des acides
Le nom des acides qui ne comprennent que de l'hydrogène et un non-métal commence par le nom de
ce dernier suivi du suffixe "ure". Exemple : HCl : chlorure d'hydrogène.
Si l'acide comprend en plus de l'oxygène, son nom est formé du mot "acide" suivi de la racine du
nom du non-métal à laquelle on ajoute le suffixe "eux" ou "ique".
Exemple : H2SO4 : acide sulfurique, H2SO3 : acide sulfureux.
- Les acides ont une saveur sûre.
- Les solutions acides colorent en rouge le papier de tournesol.
- Les solutions acides libèrent habituellement de l'hydrogène quand elles réagissent avec la plupart des
métaux.
- Les solutions acides libèrent du dioxyde de carbone quand elles réagissent avec des carbonates.
Exemple : HCl + CaCO3
Error!
CaCl2 + H2O + CO2.
Caractéristiques des bases
Le nom des bases est formé du mot "hydroxyde" suivi du nom du métal qu'elles contiennent.
Exemple : NaOH : hydroxyde de sodium.
- Les bases ont une saveur amère.
- Elles colorent en bleu le papier de tournesol.
- Les bases réagissent avec les acides pour donner un sel et de l'eau.
Exemple : HCl + NaOH
Error!
NaCl + H2O
Remarque : les Anglo-saxons incluent dans les bases des composés comme certains oxydes, qui réagissent avec
les acides pour ne donner qu'un sel et de l'eau.

Caractéristiques des sels
Les sels sont des composés obtenus par le remplacement en tout ou en partie de l'hydrogène d'un
acide par un métal. Exemple : CuO + H2SO4
Error!
CuSO4 + H2O
Quand ils sont solubles, les sels sont en général des électrolytes forts car ils libèrent en solution un
grand nombre d'ions.
Ils sont composés d'un élément métallique et d'un élément non métallique.
Exemple : CaCl2 : chlorure de calcium.
Force des acides et des bases
Dans une solution :
- plus la concentration d'ions H + est grande et plus la solution est acide ;
- plus la concentration en ions OH - est grande et plus la solution est basique (ou alcaline).
Les composés comme l'eau qui libèrent autant d'ions H + que d'ions OH - sont neutres.
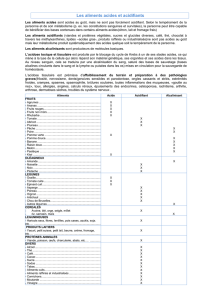
Indication de l'acidité et de la basicité en terme de pH
Concentration en ions H + (mol/L)
Concentration en pH
10 0
le + acide
0
10 -1
1
10 -2
2
10 -3
3
10 -4
4
10 -5
5
10 -6
6
10 -7
neutre
7
10 -8
8
10 -9
9
10 -10
10
10 -11
11
10 -12
12
10 -13
13
10 -14
le + basique
14
Comme on le constate d'après ce tableau, chaque fois que le pH diminue de 1, la quantité d'ions H + est
10 fois plus forte.
Note : en fait, le pH = - log [conc. en H + (en mol/L)].

LE CONCEPT D'ACIDE ET DE BASE
par Fred Scaffidi, chimiste
La corrosivité d'une substance, c'est-à-dire la propriété qu'a un produit
chimique de détruire visiblement la peau et d'autres tissus, constitue un
important paramètre en cas d'intervention d'urgence. Les acides sont bien
connus pour leur corrosivité. Des éclaboussures d'acides sur la peau
peuvent causer de graves brûlures et de profondes cicatrices. Quoique très
dangereuses, ces substances sont utilisées dans nombre de procédés
industriels, et ce, à une très grande échelle; on en trouve en plus dans
presque tous les foyers (dans les nettoyants, par exemple). Qu'est-ce qui
rend une substance acide (ou basique)? Quelles sont les méthodes courantes
pour faire face à ces produits chimiques en cas de déversement?
Souvenez-vous de vos premières notions de chimie. Les substances acides, en se dissolvant
dans l'eau, produisent un surplus net d'ions hydrogène [H+], les ions étant des produits
chimiques chargés électriquement. Les substances basiques se dissolvent aussi dans l'eau et,
ce faisant, produisent des ions hydroxyle [OH-]. C'est la concentration de ces ions qui
détermine la force d'un acide ou d'une base. Les acides forts produisent des concentrations
plus élevées de H+ que les acides faibles (il en va de même pour les bases). On peut
généraliser et dire que la solubilité dans l'eau de la plupart des acides communs est élevée,
c'est-à-dire qu'on peut les mettre dans l'eau, les dissoudre et produire ainsi une solution d'ions;
les acides ne sont pas inflammables, même si certains acides très concentrés peuvent
enflammer d'autres substances; les acides réagissent au contact des métaux, parfois lentement,
et ce faisant, produisent des gaz hydrogène inflammables et explosifs; les acides neutralisent
les bases, en d'autres mots, les ions hydrogène réagissent au contact des ions hydroxiles pour
produire de l'eau et de la chaleur. Donc,
ACIDE + BASE
<-->
un sel + eau + chaleur.
La soude caustique, base dont la formule chimique est NaOH, neutralise un déversement
d'acide chlorhydrique, acide dont la formule chimique est HCl. La réaction globale est la
suivante:
Na+ + OH- + H+ + Cl-
<-->
H2O + NaCl (sel de table).
La réaction précédente produirait énormément de chaleur et de vapeurs.
La présence d'eau est importante dans le concept d'acide et de base. On pourrait envisager
d'ajouter de l'eau aux acides et aux bases afin de les diluer et de les rendre ainsi moins

concentrés, moins dangereux. Une règle empirique veut que, dans un laboratoire de chimie,
on ajoute toujours l'acide à l'eau, jamais l'eau àl'acide. L'ajout d'eau à un acide concentré, la
seule façon de combiner les deux en cas de déversement, peut entraîner la projection et le
bouillonnement de l'acide. La dilution peut
Région acide
pH neutre
Région basique
pH 0-1-2-3-4-5-6-7-8-9-10-11-12-13-14
aussi provoquer le réchauffement de la solution (ce qu'on appelle la chaleur de dilution), qui
réduira la solubilité de l'acide dans l'eau et entraînera la production de vapeurs acides. Vous
êtes pour la plupart familiers avec le terme pH utilisé pour indiquer le degré d'acidité ou de
basicité d'une solution (voir l'échelle ci-dessous).
Les solutions dont le pH se situe entre 0 et 6 sont acides, celles dont le pH est de 7 sont
neutres et celles, finalement, dont le pH varie de 8 à 14 sont basiques. On peut effectuer des
lectures du pH à l'aide de papier de tournesol et en observant sa couleur changer. L'échelle du
pH ici illustrée est une échelle logarithmique, c'est-à-dire que des facteurs de 10 séparent
chaque valeur. Par exemple, un déversement d'un litre d'un acide fort (dont le pH=1) exigerait
10000 litres d'eau pour être dilué jusqu'à un pH égal à 5. Sa dilution jusqu'à un pH neutre
exigerait 1000000 de litres d'eau (même si pareille dilution serait inutile, étant donné qu'un
pH équivalant à 5 représenterait un faible risque en cas de contact avec la peau). L'ajout d'eau
aurait pour inconvénient additionnel d'étendre ou d'élargir le déversement.
PRODUITS
pH
Acide chlorhydrique
(nettoyant pour tuyaux d'écoulement)
0,1
Acide sulfurique
(acide pour accumulateurs)
0,3
Hydroxyde de sodium
(nettoyant pour tuyaux d'écoulement)
14,0
Eau de pluie
5,5
Eau de mer
7,8 à 8,2
Acide citrique
(jus de citron)
3,0

Vinaigre
(5% d'acide acétique)
2,4
Vins
2,8 à 3,8
Comme on peut le constater, les valeurs du pH dans le cas de certaines substances courantes
sont assez faibles (acides).
L'ajout soudain d'agents neutralisants à des acides concentrés en cas de déversement
entraînera des vapeurs et du bouillonnement. Une neutralisation s'effectue normalement en
laboratoire dans des conditions très contrôlées. Songez que certains agents neutralisants
peuvent être tout aussi dangereux que l'acide original. On devrait ajouter à peine assez de
neutralisant pour effectuer le travail et pas plus, étant donné qu'on pourrait dépasser le point
de virage et transformer la solution en une base forte. On peut neutraliser un déversement
d'acide sulfurique concentré à l'aide de bicarbonate de sodium (bicarbonate de soude) sans
trop de danger, tandis que le neutraliser avec de l'hydroxyde de sodium pourrait produire
beaucoup de chaleur et de vapeurs. Le bicarbonate de sodium a une chaleur de réaction plus
faible; il provoquera cependant un violent bouillonnement parce qu'il produira du gaz
carbonique. Le bicarbonate de sodium n'est pas une substance particulièrement dangereuse et
on peut en ajouter un excédent sans danger. La pierre à chaux broyée est aussi un excellent
choix; sa chaleur de réaction sera cependant plus élevée, ce qui produira donc plus de vapeurs.
La neutralisation d'une grande quantité d'acide sur le lieu d'un déversement exigerait la
présence de personnel très familier avec cette méthode. On recommande de récupérer autant
de substance déversée que possible avant une neutralisation.
On peut de toute évidence attribuer plusieurs propriétés chimiques aux acides en général.
L'échappement de vapeurs acides causé par une neutralisation ou une dilution semble le
problème le plus grave. L'échappement d'acide cyanhydrique, par exemple, pourrait être fatal.
Nous traiterons de la question des vêtements de protection appropriés en cas de déversement
dans un prochain article.
RÉFÉRENCES
Manuels «TIPS» d'Environnement Canada, Service de la protection de
l'environnement, février 1984
Chemistry: A Conceptual Approach, 4e édition, Mortimer, 1979
Handbook of Chemistry and Physics, 71e édition, CRC Press, 1990
Guide de premières mesures d'urgence, CANUTEC, édition 1992, TP 7341F
Parution: Bulletin de nouvelles TMD, Vol. 15, No. 1, Printemps 1995
1
/
5
100%