N° 221 - medecine.ups

38
N° 221
Algodystrophie
Nécrose idiopathique.
- Diagnostiquer une algodystrophie.
I - Introduction
Encore appelées syndrome neuro-trophique, les algodystrophies réalisent un syndrome vasculo-
sympathique caractérisé par :
- un syndrome clinique particulier, pseudorhumatismal,
- une déminéralisation osseuse sans atteinte de l'interligne articulaire,
- un syndrome biologique normal.
Elles surviennent dans des contextes étiologiques variés, tantôt évidents, tantôt difficiles à mettre en
évidence et sur des terrains particuliers.
II - Etude radio-clinique
A- sur le plan clinique :
L'algo-dystrophie se manifeste au niveau d'une région articulaire et va évoluer en deux stades :
a) Stade 1 (OEDEME) : ou phase chaude.
- Douleurs souvent vives, limitant le jeu articulaire et créant une impotence. Elles peuvent revêtir
une allure neuro-sympathique avec acroparesthésies et hypersudation.
- Gonflement : modéré ou très étendu, il déborde de toute façon le cadre étroit de l'articulation.
C'est un œdème diffus, régional. La chaleur locale est augmentée, la rougeur cutanée peut être très
marquée.
L'ensemble est pseudo-arthritique.
b) Stade 2 (FIBROSE) ou phase froide
Après des semaines d'évolution, la douleur a tendance à s'atténuer, quoique persistant lors
de la mobilisation. Le gonflement disparaît pour faire place à une atrophie et une rétraction des
parties molles périarticulaires. La succession des deux phases n'est pas abrupte et une phase
intermédiaire parfois prolongée, en associe les signes. En fin d'évolution, la fibrose domine:
- la peau est amincie, sèche,
- les poils peuvent s'atrophier, puis disparaître,
- la fibrose des éléments capsulo-aponévrotiques continue à conférer au syndrome
neurotrophique une allure pseudo-rhumatismale :
. limitation et même blocage permanent des mouvements articulaires (épaule, hanche)

39
. flexion irréductible du genou avec perte de la mobilité latérale de la rotule. Impression
tactile de « genou blindé ».
. rétraction permanente des doigts et des orteils,
- on peut observer des épaississements nodulaires des aponévroses :
. palmaire (ressemblant à la maladie de DUPUYTREN : rétraction primitive de l'aponévrose
palmaire),
. plantaire (ressemblant à la maladie de LEDDERHOSE : rétractation primitive de
l'aponévrose plantaire).
B- Sur le plan radiologique et scintigraphique
On retiendra 4 points fondamentaux :
1°) L'apparition des premiers signes radiologiques est en retard sur la clinique. Il peut arriver que la
déminéralisation soit encore importante, alors que le malade s'achemine vers la guérison clinique.
A l'inverse, les premières semaines d'évolution sont pures de toute traduction radiologique.
L'hyperfixation scintigraphique est précoce, elle précède les signes radiologiques. Elle peut
manquer et même être remplacée par une hypofixation, surtout chez l'enfant. Elle est régionale et
remonte sur la diaphyse.
2°) Le signe radiologique de l'algodystrophie est la déminéralisation osseuse.
- Trois aspects contemporains de la phase de pleine évolution :
a) Déminéralisation « en bande » métaphyso-épiphysaire,
b) Aspect « moucheté », plus diffus et hautement caractéristique,
c) Déminéralisation diffuse, homogène, réalisant l'aspect d'os « de verre ».
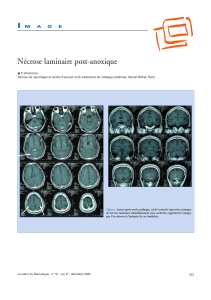
Algodystrophie du pied gauche : déminéralisation hétérogène diffuse
- Un aspect séquellaire :

40
Déminéralisation de type « fibreux », traduisant la réparation incomplète,
grossière et définitive de la perte calcique. Cet aspect peut permettre un diagnostic
rétrospectif plusieurs années après la guérison.
- Les interlignes articulaires resteront normaux (+++), ce qui différentie l'A.D des arthrites
inflammatoires chroniques, type P.R, ou infectieuses. Bien entendu, ce caractère radiologique
négatif d'un très haut intérêt ne prend toute sa valeur qu'au fur et à mesure de l'évolution (car,
rappelons-le, le pincement articulaire des arthrites peut demander des mois avant d'être évident).
- Il faut toujours être documenté sur les 3 étages des membres (épaule-coude-main ou
hanche-genou-pied) et les 2 membres homologues.
Fréquence des formes tripolaires radiologiques ou scintigraphiques, même si l'atteinte clinique
paraît unipolaire.
C- Sur le plan biologique
Absence de tout syndrome inflammatoire (mais certaines étiologies peuvent altérer le syndrome
biologique et ce caractère négatif disparaît).
III - Diagnostic
La clinique est trompeuse, mais on retiendra :
. la diffusion de l'œdème qui n'a pas la topographie strictement articulaire des rhumatismes
inflammatoires, . la succession des deux phases cliniques, . la note vasculo-sympathique.
L'apport de la radiographie et la scintigraphie est important :
- Radio : .déminéralisation sans atteinte des interlignes,
. mais elle est en retard sur la clinique.
- Scintigraphie (polyphosphates marqués au Technetium : 99 m Tc EHDP ou MDP) intérêts :
plus précocemment parlante que la radiographie, fixation évocatrice « pan-
régionale », souvent bi ou tripolaire, alors que la clinique ne l'est pas,
aide dans l'identification des formes localisée.
pièges : scintigraphie iso et hypofixantes, surtout dans l'A.D de l'enfant.

41
Algodystrophie de hanche droite : hyper fixation diffuse
3) Le bilan biologique est normal.
4) Le contexte étiologique, lorsqu'il est connu, est un élément majeur pour
l'orientation diagnostique (+++).
IV DIAGNOSTIC DIFFERENTIEL
La phase chaude peut évoquer une arthrite septique ou une arthrite inflammatoire mais il n'existe
pas de fièvre, pas d'altération de l'état général, pas d'adénopathie dans le territoire drainant
l'articulation concernée. De même les examens biologiques demandés systématiquement sont
négatifs : la VS et la CRP sont normales ainsi que l'électrophorèse des protides. S'il existe un
épanchement articulaire, l'articulation sera ponctionnée, toujours dans le but d'éliminer une arthrite
septique, ou une arthrite inflammatoire. Le liquide articulaire sera de type mécanique,
paucicellulaire. Enfin, radiologiquement, même quand il existe une importante déminéralisation
sous-chondrale, l’interligne articulaire est toujours respecté contrairement à une arthrite septique
dans laquelle le pincement est précoce.
V FORMES CLINIQUES
Formes évolutives
Il est classique d'affirmer au malade qu'il guérira toujours : cela le rassure ; toutefois, de façon
exceptionnelle, l'algodystrophie peut être grave entraînant des troubles trophiques et une raideur
articulaire majeurs incompatibles avec une fonction correcte du membre. Plus couramment de
discrètes séquelles peuvent persister longtemps, à la main ou au pied en particulier.
Formes partielles et parcellaires
Au genou par exemple, la rotule peut être touchée de façon isolée
Formes extensives (localisations successives)
L’atteinte de plusieurs articulations, successivement, aux membres inférieurs doit faire chercher par
ostéodensitométrie, une déminéralisation sous-jacente qui “ entretient ” l’algodystrophie.
Formes récidivantes (exceptionnelles)
Il est classique de dire qu'une articulation ne peut être touchée qu'une seule fois par
l'algodystrophie.
Formes étiologiques selon la topographie
- Au niveau du pied et de la cheville, l'algodystrophie est fréquente et très souvent post-traumatique
ou post-immobilisation plâtrée.
- Au niveau des genoux, l'algodystrophie est souvent post-chirurgicale, post-arthroscopie. Dans la
phase froide, il peut y avoir une fibrose de la capsule articulaire responsable d'une limitation
importante des mouvements du genou. La rotule est très souvent touchée, radiologiquement : c'est
“ l'os chéri ” de l'algodystrophie.
- Au niveau de la hanche, l'algodystrophie est souvent spontanée, parfois favorisée par des
trou-bles métaboliques : hyperlipémie, hyperuricémie. Au début, les radiographies peuvent
être normales et le diagnostic différentiel avec l'ostéonécrose se pose. Il faut alors réaliser
une imagerie par résonance magnétique qui montre un hyposignal diffus en T1 qui se
transforme en hypersignal en T2. Dans la nécrose, les anomalies sont plus localisées, à la
partie supéro-externe de la tête fémorale, il y a rarement un rehaussement du signal en T2.

42
Algodystrophie : RMN : séquences T2 : Hypersignal diffus de l’extrémité supérieure du fémur
- Aux membres inférieurs : pieds, chevilles, hanches, l'algodystrophie, surtout lorsqu'elle sur-vient
hors traumatisme, peut être favorisée par l'ostéoporose, l'ostéomalacie, en particulier l'ostéoporose
compliquant une tubulopathie rénale.
-Aux membres supérieurs, l'algodystrophie touche fréquemment de façon associée l'épaule et la
main, c'est le syndrome épaule-main qui peut révéler une insuffisance coronarienne, compliquer un
infarctus du myocarde, un dysfonctionnement thyroïdien, un problème neurologique (tumeur
cérébrale, AVC), un cancer bronchique, être associée à un traitement par antituberculeux, ou
barbituriques.
-A l'épaule, l'algodystrophie peut revêtir une forme particulière intéressant surtout la capsule et
donnant une limitation très importante des mouvements de l'épaule : on parle alors de “ capsulite
rétractile ” ou d’épaule “ gelée ”. La radiographie est le plus souvent normale, la scintigraphie peut
ne pas fixer, et le diagnostic est fait par l'arthrographie qui permet aussi le traitement, en rompant
les adhérences capsulaires.
VI TRAITEMENT
TRAITEMENTS MEDICAMENTEUX
Les Calcitonines (Calsyn®, Calcitar®, Miacalcic®, Cibacalcine®) sont efficaces en phase chaude
; on les administre quotidiennement pendant 15 jours, puis 2 à 3 fois par semaine les 15 jours
suivants. Elles peuvent occasionner des effets secondaires ennuyeux : nausées, vomissements,
flush. Pour éviter ces effets secondaires, l'injection doit être effectuée, le soir au coucher et le
produit peut être administré avec du Primpéran® injectable. Dans les formes graves, on peut
réaliser des perfusions de Calcitonine (300 ou 400 unités de Calcyn® dans 500 ml de glucosé iso-
tonique pendant 4 à 5 jours). Elles n’ont cependant plus l’AMM dans cette indication
Récemment, l'Arédia® (nouveau bisphosphonate) a été employé, hors AMM (autorisation de mise
sur le marché). Bien qu'il semble améliorer certains patients atteints de formes sévères et résistantes
aux traitements classiques, une étude randomisée, contrôlée, n'a pas prouvé sa supériorité comparé
au placebo. Il est administré en perfusion, 60 à 90 mg en 4 heures, une seule fois. Le Fosamax* 70
mg un jour sur 2 a fait récemment l’object d’une étude cntrôlée, randommisée, contre placébo,
positive.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%