vinaigre - Forum Sciences TPE

HOARAU Gaëtan
1
Titre :
Auteur : Gaëtan Hoarau (e-mail : [email protected] ).Île de la Réunion.
Les résultats de l’activité proposée sont, comme d’habitude, inclus dans le document.
Les photographies (une vingtaine, de taille moyenne 50 ko/image, concernant les différentes étapes de la
manipulation) prises avec la collaboration de la classe TS1 promotion 98/99 du lycée Roland Garros du
Tampon. ( Île de la Réunion ) :
- soit peuvent être demandées à l’adresse électronique ci-dessus en précisant les numéros de celles qui vous
intéressent.
- Soit peuvent être téléchargées directement sur le serveur de l’académie (voir ci-dessous)
Niveau : seconde (programme 2000)
Partie du programme concernée :
Chimie. Enseignement fondamental.
3- Le monde de la chimie : la synthèse des espèces chimiques au laboratoire et dans l’industrie.
Exemple d’activités : synthèse (ou hémisynthèse) d’une ou plusieurs espèces chimiques, mettant en jeu des
techniques simples, telles que chauffage à reflux, filtration, séparation.
L’ensemble de cette partie est fondé sur l’approche expérimentale permettant à l’élève de s’approprier les
techniques de base d’un laboratoire de chimie. Dans le cas des synthèses impliquant un chauffage à reflux,
l’enseignant présente la nécessité et le fonctionnement d’un montage à reflux (à eau comme à air).
Connaissances et savoir-faire exigibles : Suivre un protocole de synthèse en respectant les consignes
(sécurité, protection de l’environnement).
Je propose ici la synthèse d’un arôme (ester à odeur de banane) utilisé en parfumerie.
Pré-requis :
- L'utilisation de la verrerie (pipettes, poires aspirantes ou propipettes), d’une ampoule à décanter, d’un
chauffe-ballon électrique.
(Mes élèves s’étaient déjà entraînés lors du TP de chimie précédent d’hydrodistillation avec le zeste d’orange,
d’où une bonne rapidité, mais cela peut être appris au cours de ce TP)
- Pour le professeur, avoir en mémoire le cours correspondant à l’équilibre estérification-hydrolyse.
Durée pour un élève de seconde :
- 15 minutes à la maison pour quelques questions à choisir par le professeur.
- 1,5h en classe pour le TP et les réponses aux questions.
- 0,5h à la maison pour les autres questions, après traitement en cours de la partie du cours de chimie III-2-
Transformation chimique d’un système.
Fichier chargé : 2-ester.zip. Taille : 150 ko.
Fichier photos du TP à charger : 2-esterphot.zip. Taille : 1,69 Mo.
Vos remarques : Nous serions heureux que vous nous communiquiez vos critiques et commentaires à
l'adresse électronique suivante : ( patrice.lecarpe[email protected] )ou au secrétariat des IPR, au rectorat, à
l’attention de M. LECARPENTIER.
BANANE

HOARAU Gaëtan
2
Ce document est à l’usage du professeur. Il peut éventuellement choisir de fournir à l’élève la partie IV
Manipulation, ainsi que quelques questions pour réflexion préalable au TP, parmi celles du questionnaire.
I. BUTS
- Synthétiser l'éthanoate de 3-méthylbutyle couramment appelé acétate d'iosoamyle, ester très utilisé en
parfumerie et comme arôme dans l'alimentation.
- Bien faire la distinction entre un chauffage à reflux et une distillation.
- Utiliser une ampoule à décanter : lavage, dégazage, décantation.
- Manipuler en respectant les règles de sécurité.
II. MATERIEL ET PRODUITS
Chauffage à reflux:
- Lunettes de protection
- Ballon rodé de 250 mL (si possible bi-col pour thermomètre) ; réfrigérant et chauffe-ballon adaptés; support-
boy ; support avec noix; pierre ponce ; valet en liège.
- Deux éprouvettes graduées de 25 mL et une de 10 mL; petit cristallisoir ou récipient émaillé (pour le bain
d'eau froide).
- pipettes propres et sèches : graduée de 5 mL, jaugées de 10 mL, de 20mL et poires
- pince en bois pour maintenir le ballon chaud au début du démontage
Lavage, séchage :
- Ampoule à décanter de 250 mL ; deux béchers de 100 mL.
- 2 erlenmeyer/chaque groupe; balance (pour toute la classe).
- spatules, entonnoir, papier filtre, laine de verre
- papier pH
- eau distillée (glacée de préférence)
- Acide acétique anhydre (pur, dit glacial) ; alcool iosoamylique (3-méthylbutan-1-ol) ; acide sulfurique
concentré (en compte-gouttes, de préférence);
- Solution d'hydrogénocarbonate à 5 % ; chlorure de sodium solide ou solution saturée de chlorure de sodium;
sulfate de magnésium anhydre.
- balance électronique
III. PRINCIPE
On synthétise cet ester à partir d'acide éthanoïque glacial et du 3-méthylbutan-1-ol (ou alcool iosamylique)
selon une réaction d'estérification produisant un ester, incolore, dont l'odeur fruitée de banane est très
caractéristique (odeur dite de « bonbon anglais » ).
Écrire l’équation-bilan en utilisant les appellations ou les formules brutes des espèces chimiques :
- Cette réaction est limitée : nous utiliserons un excès d'acide pour déplacer l'équilibre chimique dans le sens
de l'estérification.
- Cette réaction est lente : nous chaufferons et nous catalyserons pour l'accélérer.
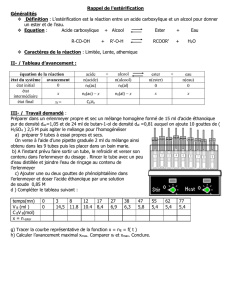
Données :
M(gmol-1)
Teb(°C)
Densité/eau
solubilité dans l’eau
acide acétique
60
118
1,05
très grande
alcool isoamylique
88
128,5
0,81
faible
acétate d'isoamyle
130
142
0,87
très faible
eau
18
100
1
DOCUMENT : Synthèse d’un ester utilisé en parfumerie
Acide acétique + alcool isoamylique acétate d’isoamyle + eau

HOARAU Gaëtan
3
IV MANIPULATION
1. Chauffage à reflux (45 min)
- Introduire dans un ballon de 250 mL disposé sur valet en liège :
- Agiter pour bien mélanger et ajouter un peu de pierre ponce qui régulera l'ébullition.
- Mettre en route le réfrigérant (bon débit d’eau froide !) et porter le mélange à douce ébullition. Chauffer à
reflux pendant environ = 30 min en surveillant régulièrement. Un support-boy en position « haute » est
essentiel pour descendre rapidement le chauffe-ballon en cas de surchauffe. (Attention, même un peu éloigné,
le chauffe-ballon chauffe !)
Remarques : SCHEMA DU MONTAGE A REFLUX
- En cas d’oubli de la pierre ponce, surtout ne pas l’ajouter dans le
mélange en ébullition car risque d’explosion
- on peut remplacer H2SO4 par l’acide paratoluène sulfonique CH3-
C6H4-SO3H, acide solide, plus cher, mais moins dangereux à manipuler,
et qui évite, de plus, la carbonisation des composés organiques.
- Attention : Au cours du reflux, les vapeurs ne doivent jamais atteindre
le milieu du réfrigérant.
- Ensuite, couper le chauffage, descendre le support et refroidir
extérieurement le ballon d’abord à l’air, posé sur son valet, le
réfrigérant fonctionnant encore pour éviter toute perte de vapeur.
- Puis enlever le réfrigérant et refroidir sous le courant d’eau froide du robinet.
2. Lavages successifs et séchage (35 min)
a. 1er lavage à l’eau
- Transvaser le mélange dans une ampoule à décanter contenant 50 mL d'eau glacée.
(Attention à la pierre ponce ! donc filtrer sur laine de verre)
- Agiter, dégazer, décanter, éliminer la phase aqueuse (enlever le bouchon car sinon le liquide ne coule pas
car action de la pression atmosphérique !)
b. 2ème lavage : à l’eau salée
- Ajouter encore à la phase organique 30 mL d'eau glacée et environ 1 g de chlorure de sodium ou 10 mL
d'une solution saturée en chlorure de sodium. Agiter, dégazer, décanter, éliminer la phase aqueuse.
c. 3ème lavage avec une solution aqueuse d'hydrogénocarbonate de sodium
- Laver maintenant l'ester avec 30 mL d'une solution d'hydrogénocarbonate de sodium à 5 %.
- Remarquer la formation immédiate de CO2 ! Laisser librement dégazer.
- Boucher ensuite l’ampoule, agiter, bien dégazer car le dégagement de CO2 augmente la pression dans
l'ampoule.
- Décanter, éliminer la phase aqueuse, mesurer son pH.
- On pourrait : - Répéter éventuellement l'opération si nécessaire
- Faire enfin un dernier lavage avec 30 mL d'une solution saturée de chlorure de sodium
- Transvaser la phase organique dans un bécher propre et sec dans lequel on aura mis deux spatules de
sulfate de magnésium anhydre. Agiter. Laisser reposer. On doit avoir une solution limpide.
- Filtrer sur un peu de laine de verre et récupérer le filtrat un peu jaune dans un petit erlenmeyer
préalablement taré et en déduire la masse d’ester obtenu.
15 mL d'alcool isoamylique
20 mL d'acide acétique (odeur fortement piquante)
puis avec précaution (danger)
2 mL d'acide sulfurique concentré, avec pipette et propipette, gants et lunettes.

HOARAU Gaëtan
4
V. QUESTIONNAIRE.
L’élève ne peut répondre à toutes les questions de ce questionnaire niveau TS qu’après étude de la partie de
programme de chimie III-Transformations de la matière 2-Transformation chimique d’un système.
Le professeur peut choisir de faire réfléchir l’élève de seconde, avant le TP, sur les questions 2, 3, 4.
1ère partie : Y répondre avant la séance de TP.
1) Calculer les quantités de réactifs utilisées (en mol).
n acide
n alcool
- Quel est le réactif en excès ? Justifiez !
- Pourquoi travaille-t-on avec un excès de l’un des réactifs ?
- Quel est le critère essentiel dans l’industrie pour le choix du réactif en excès ?
2) Pourquoi utilise-t-on un chauffage à reflux ? Expliquez son fonctionnement.
3) Pourquoi est-il important de refroidir le mélange réactionnel avant d'ajouter de l’eau (glacée, en outre) pour
le lavage?
- Quel est le but du 1er lavage ?
4) Lors des différentes décantations, où se situe la phase organique ? Pourquoi ?
- Proposer une méthode expérimentale simple permettant d'identifier les deux phases en l'absence des densités.
- Pourquoi propose-t-on d'ajouter du chlorure de sodium pour améliorer la séparation lors du 2ème lavage ?
5) Quel est le rôle de l'hydrogénocarbonate de sodium NaHCO3 utilisé au 3ème lavage ?
Écrire l'équation-bilan de la réaction concernée.
6) Calculer le rendement de la synthèse à la date d’arrêt de la réaction (lavage à l’eau glacée) si on a obtenu
9,2 g d’ester après séchage.
- L’état d’équilibre est-il atteint ? Justifiez la réponse !
2ème partie : Recherche après le TP. (Si l’on veut en savoir plus)
7) Une distillation fractionnée de l’ester brut obtenu permettrait d’obtenir de l’ester pur.
- Faire le schéma du montage de la distillation.
- Expliquer à quel moment et dans quel récipient on récupérerait l’ester pur.
- Pensez-vous que ce serait facilement réalisable avec l’ester brut acétate d’amyle que vous avez obtenu ?
8) Données pour une autre estérification:
masse volumique(g.cm-3)
Teb(°C)
solubilité dans l’eau
acide formique
1,22
100,7
totale
éthanol
0,79
78,5
totale
formiate d'éthyle
0,91
54,3
faible
Le formiate d'éthyle (ou méthanoate d'éthyle) est un ester à odeur de rhum.
- Écrire l'équation-bilan de sa synthèse.
- A quelle condition peut-on séparer facilement l’ester par distillation fractionnée, au fur et à mesure de sa
formation par la réaction d'estérification ? Est ce le cas pour le formiate d'éthyle ? Justifier la réponse !
- Quel est l’intérêt de procéder ainsi ?
9) Pourquoi utilise-t-on de la verrerie sèche (pipettes, ballon) quand on veut fabriquer un ester ?

HOARAU Gaëtan
5
CO
O
CH3H
Réponses au questionnaire.
1ère partie. (On peut corriger les questions élève de seconde, lors du chauffage à reflux).
1) n =
MVd
M
meau)..(
nacide carboxylique = 1,05.1.20/60 = 0,35 mol
nalcool = 0,81.1.15/88 = 0,14 mol
L’équation-bilan + H2O +
Montre que les proportions stoechiométriques sont
alcool
acide
n
n
= 1/1 = 1 or dans l’expérience
alcool
acide
n
n
= 0,35/0,14 >1
- Avec un excès de l’un de réactifs, l’équilibre est déplacé dans le sens de la consommation de cet excès, donc
dans le sens de la formation de produits, donc dans le sens de la formation d’ester.
Le rendement, calculé par rapport au réactif en défaut, augmente donc.
- Le critère industriel est le coût pour le choix du réactif en excès. Il est à espérer que la conscience de
l’environnement intervienne aussi dans les choix (biodégradabilité, retraitement ..).
Ici, de plus, l’acide, réactif en excès, est très soluble dans l’eau, et ce qui n’est pas utilisé sera éliminé en partie
déjà lors du 1er lavage à l’eau.
2) La réaction de formation d’ester est lente, et chauffer permet de l’accélérer pour atteindre plus vite l’état
final. Le tube réfrigérant permet de condenser les vapeurs de réactifs ou produits volatils et éviter leur perte.
L’eau froide entre toujours par le bas en circulant vers le haut autour du tube du réfrigérant avant d’être rejetée
en haut alors qu’elle s’est réchauffée.
3) On refroidit pour une raison cinétique, afin de limiter l’hydrolyse de l’ester.
Le but du 1er lavage est de dissoudre principalement les acides très solubles dans l’eau, et de l’alcool
éventuellement restant, l’équilibre n’étant probablement pas atteint, vu la faible durée du TP.
4) La phase organique a une densité inférieure à celle de l’eau et constituera la phase supérieure.
- A la pissette, on ajoute une goutte d’eau et l’on observe la phase qu’elle rejoint : c’est la phase aqueuse.
- Ajouter NaCl a 2 effets :
- « alourdit » la phase aqueuse, c’est à dire la rend plus dense, la différence de densités entre les 2 phases
aqueuse et organique augmente et la séparation devient plus nette.
- Effet de « relargage » : la solubilité des composés organiques diminue dans une solution d’ions minéraux
et ils vont donc mieux se séparer de cette phase aqueuse ionique.
5) Rôle de l'hydrogénocarbonate de sodium NaHCO3 utilisé au 3ème lavage :
Il peut rester des traces d’acide après les 2ers lavages à l’eau et à l’eau salée. On peut l’éliminer par réaction
totale avec une base, ici l’ion hydrogénocarbonate HCO3- base conjuguée de l’acide CO2,H2O.
Équation-bilan :
CO2 s’échappe (ce qui provoque d’ailleurs un déplacement de cet équilibre vers la droite, rendant la réaction
quasi-totale), tandis que l’ion éthanoate est parfaitement soluble dans l’eau (solvant polaire) et sera éliminé
sans problème.
6) Rendement de la synthèse à la date d’arrêt de la réaction (lavage à l’eau glacée) si on a obtenu 9,2 g d’ester
après séchage.
Le mélange initial n’étant pas stoechiométrique, il faut raisonner à partir du réactif limitant.
DOCUMENT PROFESSEUR
nacide carboxylique = 0,35 mol
nalcool = 0,14 mol
Il y a donc un excès d’acide
CH3-COOH + HCO3- CH3-COO– + CO2 + H2O
CH
CH3
CH3
CH2OH
CH2
CO
O
CH3CH2CH2CH
Ch3
CH3
 6
6
 7
7
1
/
7
100%