TP Chimie Estérification : Synthèse et Rendement

Réaction d’estérification :
Comment augmenter son rendement?
Objectifs : - Réaliser la synthèse d’un ester.
- Extraire au cours la transformation l’ester formé.
- Calculer la valeur du rendement.
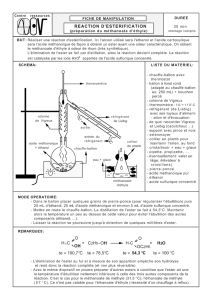
I- Synthèse et extraction de l'ester.
Le montage utilisé est celui de la distillation fractionnée.
- A l'aide d'une éprouvette graduée, verser dans le ballon :
- 10,0 mL d'éthanol,
- 5,0 mL d’acide méthanoïque,
- 1,0 mL d'acide sulfurique concentré (avec précaution).
- Ajouter quelques grains de pierre ponce.
- Placer la colonne de Vigreux et le réfrigérant.
- Mettre la circulation d’eau et le chauffage en route.
- Porter le mélange à ébullition douce pendant 20 minutes.
- Noter de temps en temps la valeur de la température.
(°C)= ……
- Recueillir le distillat dans un erlenmeyer.
II- Séchage de la phase organique.
- Ajouter 1 g de sulfate de magnésium anhydre dans le distillat.
- Boucher l'erlenmeyer et agiter doucement le mélange pendant quelques minutes.
- Transvaser la phase organique dans un autre petit enlenmeyer sec et préalablement pesé.
- En déduire la masse d'ester brut obtenu : mester = mexp =…….
- Noter la couleur et l'odeur de cet ester.
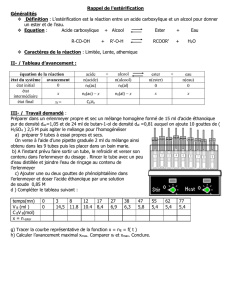
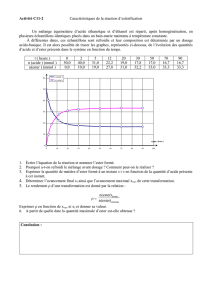
III- Exploitation des résultats.
Données :
- Le sulfate de magnésium anhydre est très avide d'eau.
- Le méthanoate d’éthyle n’est pas du tout soluble dans l’eau salée.
- Les masses molaires (M) , densité (d) , température d'ébullition (
eb) , solubilité (S) dans l'eau,
des différentes espèces, figurent dans le tableau suivant.
M (g.mol-1)
(g.cm-3)
eb (°C)
Solubilité (à 20°C)
acide méthanoïque
46,0
1,22
100,7
totale
éthanol
46,0
0,79
78,5
totale
méthanoate d’éthyle
74,0
0,91
54,3
faible
Compétences transversales
Auto évaluation
5-Réaliser un dispositif exp correspondant à un protocole donné.
6-Régler et mettre en œuvre le dispositif exp.
7-Réaliser les mesures avec la précision optimale.
11-Identifier le risque et respecter les règles de sécurité.
TP de chimie n°6
classe de T°ST2S

1- A propos de la synthèse.
1° Légender le schéma du montage utilisé.
2°a) Ecrire les formules semi-développées des espèces mentionnées dans le tableau ci-dessus.
acide méthanoïque : ; éthanol : ; méthanoate d’éthyle :
b) Ecrire l'équation-bilan de la réaction d'estérification étudiée.
3° Quel est l’intérêt du chauffage du milieu réactionnel pendant la préparation de l'ester ?
4° Pourquoi doit-on ajouter de l’acide sulfurique dans le milieu réactionnel ?
2- A propos de l'extraction.
5° D’après la température relevée lors de la distillation, quel produit recueille-t-on ?
6° Quel est le rôle du réfrigérant ?
7° Quel rôle le sulfate de magnésium anhydre va-t-il jouer ?
8° Quelle est l’odeur de l’ester ?
3- Rendement de la réaction.
9° Déterminer les quantités de matière des deux réactifs.
10° En déduire le réactif limitant.
11° Déterminer la quantité de matière d’ester que l'on aurait dû obtenir théoriquement (nmax).
12° Calculer la quantité de matière d’ester obtenu expérimentalement (nexp).
13° Calculer le rendement de cette réaction d’estérification.
Rappel : rendement d’une réaction = =
14° Cette réaction est-elle totale ? Justifier.
15° Comparer le rendement obtenu avec le rendement d’une réaction d’estérification réalisée sans
l’extraction. Commenter.
(max)
(exp)
n
n
1
/
2
100%