2013-2014 -- Sadiki (Maths)

~ 1/4 ~ 4ème Maths
Collège Sadiki
Devoir de synthèse n° : 1
Sciences physiques
Durée : 3 heures
4ème Maths 1 ; 2 ; 3 ; 4 et 5
Samedi 07 -12-2013
Profs : BelArbi, Abid, Hrizi, Feki et Cherchari
Chimie (7 pts) :
Exercice 1 (5,5 pts):
A la date t=0 et à une température constante, on mélange dans un bécher, n1 mole de
méthanoate d’héthyle HCOOC2H5 et n2 mole d’eau avec n2=6n1 et quelques gouttes d’acide
sulfurique concentré. On divise le mélange en 20
volumes égaux, chaque prélèvement est versé dans un
tube à essais. Juste après, à instant t0 choisi comme
origine des temps (t0=0), on plonge tous les tubes dans
un bain-marie maintenu à une température constante et
on suit l’évolution du système par des dosages successifs
de l’acide formé dans les différents tubes dégagés du
bain-marie à des instants convenablement choisis par
une solution aqueuse de soude de concentration molaire
CB=0,2 mol.L-1. Les résultats des mesures ont permis
de tracer la courbe représentant l’évolution au cours du
temps de la quantité de matière d’ester dans le mélange
(voir figure 1 ).
I-/
1-
a- Ecrire l’équation de la réaction d’hydrolyse qui se produit.
b- Quel est le rôle de l’acide sulfurique concentré ?
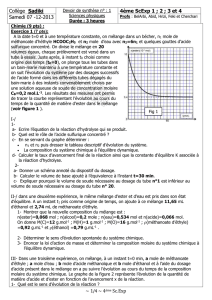
c- En se servant du graphe déterminer :
n1 et n2 puis dresser le tableau descriptif d’évolution du système.
La composition du système chimique à l’équilibre dynamique.
d- Calculer le taux d’avancement final de la réaction ainsi que la constante d’équilibre K associée à
la réaction d’hydrolyse.
2-
a- Donner un schéma annoté du dispositif du dosage.
b- Calculer le volume de base ajouté à l’équivalence à l’instant t=30 min.
c- Expliquer pourquoi le volume de soude nécessaire au dosage du tube n°1 est inférieur au
volume de soude nécessaire au dosage du tube n° 20.
II-/ dans une deuxième expérience, le même mélange d’ester et d’eau est pris dans son état
d’équilibre. A un instant t1 pris comme origine de temps, on ajoute à ce mélange 11,65 mL
d’éthanol et 2,74 mL de méthanoate d’éthyle.
1- Montrer que la nouvelle composition du mélange est :
n(ester)=0,068 mol; n(alcool)=0,2 mol ; n(eau)=0,534 mol et n(acide)=0,066 mol.
On donne M(C)=12 g.mol-1 ; M(H)=1 g.mol-1 ; M(O)=16 g.mol-1 ; (méthanoate d’éthyle)
=0,92 g.mL-1 et (éthanol) =0,79 g.mL-1 .
2- Déterminer le sens d’évolution spontanée du système chimique.
3- Enoncer la loi d’action de masse et déterminer la composition molaire du système chimique à
l’équilibre dynamique.
III- Dans une troisième expérience, on mélange, à un instant t=0 min, a mole de méthanoate
d’éthyle ; a mole d’eau ; b mole d’acide méthanoïque et b mole d’éthanol et à l’aide du dosage
d’acide présent dans le mélange on a pu suivre l’évolution au cours du temps de la composition
molaire du système chimique. Le graphe de la figure 2 représente l’évolution de la quantité de
matière d’acide et d’ester en fonction de l’avancement x de la réaction.
1- Quel est le sens d’évolution de la réaction ?
Fig 1

~ 2/4 ~ 4ème Maths
2- En utilisant la loi d’action de masse, trouver une relation entre les quantités de matière finales
d’acide et d’ester. Déduire graphiquement et sans calcul la valeur de l’avancement final xf de la
réaction.
3- La composition initiale du mélange a- t – elle un effet sur :
a- La constante d’équilibre K.
b- Le taux d’avancement final
Justifier la réponse dans chaque cas.
Exercice 2 (1,5 pts) : document scientifique
LA MENTHE POIVRÉE
La menthe poivrée, calmante (maux de tête, coups de soleil … )
mais aussi stimulante, digestive, antispasmodique et antiseptique
est bien connue pour ses bienfaits depuis des siècles.
Hippocrate et Aristote l'employaient
comme anaphrodisiaque (calmant, anesthésiant).
Utilisée en parfumerie, son huile essentielle contient un ester très
odorant: l'éthanoate de menthyle que l'on peut synthétiser en
laboratoire, à partir de menthol et d'un acide carboxylique.
Le menthol a pour formule semi-développée :
Dans la suite de l'exercice, on le notera pour simplifier R–OH, R est le
groupement encadré ci-contre.
1. À quelle famille chimique appartient le menthol ?
2. Donner le nom et la formule semi-développée de l'acide carboxylique
qui, par réaction avec le menthol, permet de synthétiser l'éthanoate de
menthyle.
3. À l'aide des formules semi-développées (simplifiée pour le menthol),
écrire l'équation de la réaction de synthèse de l'ester.
4. Citer trois utilisations de l’éthanoate de menthyle.
Fig 2

~ 3/4 ~ 4ème Maths
Physique : ( 13 pts)
Exercice 1 ( 6,5 pts)
I-/
Dans une bobine qui est fermée sur un microampèremètre
on place un aimant droit .
On éloigne l’aimant de la bobine.
1- Représenter le champ magnétique
A
B
créé par
l’aimant au centre de la bobine B.
2- Enoncer la loi de Lenz.
3- Représenter, en le justifiant, le champ magnétique induit
i
B
dans la bobine . En déduire le
sens du courant induit.
4- Préciser l’inducteur et l’induit.
II-/
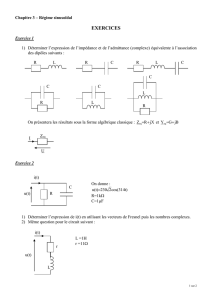
Le circuit électrique représenté par la figure 1
comportant , en série, un générateur de tension
idéale de f.e.m E, une bobine B1 d’inductance L1
et de résistance r1=10 Ω, un interrupteur K et
un résistor de résistance R.
A la date t=0 on ferme l’interrupteur K et à
l’aide d’un oscilloscope à mémoire, on enregistre
la tension uB aux bornes de la bobine B1, on
obtient le chronogramme de la figure 2 .
1- Interpréter le retard temporel de
l’établissement de la tension uB1 aux bornes
de la bobine.
2- Etablir l’équation différentielle régissant les
variations de l’intensité du courant électrique
i(t) dans le circuit.
3- Vérifier que i(t) =
1
E
Rr
.(1- e-t/) est une
solution de l’équation différentielle
précédemment établie avec
1
1
L
Rr
.
4-
a- Prélever du graphe de la figure 2 la fem
E du générateur et la constante de temps
.
b- Déterminer la valeur de la résistance R et
celle de l’inductance L1 de la bobine.
5- Pour ralentir l’établissement du courant
dans le circuit on remplace la bobine B1
par une bobine B2 de résistance r2 et
d’inductance L2. Et à l’aide de
l’oscilloscope on visualise la tension uR au
cours du temps voir figure-3-
a- En utilisant l’équation différentielle précédente, montrer que
0
2
Rt
du RE
()
dt L
.
b- Déduire la valeur de L2.
c- En utilisant les deux graphes, montrer sans calcul que r1=r2.
Fig-2-
uB1(V)
Fig-3-

~ 4/4 ~ 4ème Maths
Exercice 2 (6,5 pts ):
I-
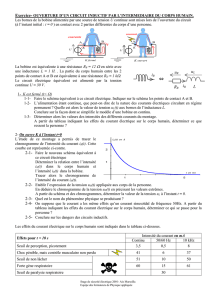
En travaux pratiques, un élève dispose de trois dipôles de nature
inconnue, D1 ; D2 et D3. Chaque dipôle peut être soit un conducteur
ohmique de résistance R, soit une bobine de résistance r et d’inductance
L, soit un condensateur de capacité C.
Afin d’identifier les trois dipôles l’élève réalise le circuit schématisé ci-
contre (figure-1-)
Lorsqu’il ferme l’interrupteur K :
La lampe L1 s’allume instantanément.
La lampe L2 s’allume avec un retard temporel.
La lampe L3 s’allume pendant une courte durée
puis s’éteint.
Identifier, en le justifiant, les dipôles D1 ; D2 et D3.
II-/
Dans une deuxième l’élève réalise un circuit série
comportant les trois dipôles où le condensateur est
initialement chargé (voir figure-2).
A la date t0=0 il ferme K, le circuit est alors le siège d’oscillations électriques libres amorties. A
l’aide d’un oscilloscope numérique branché comme l’indique la figure 2, on obtient la courbe de la
figure 3.
1-
a- Expliquer les termes soulignés : Oscillations électriques
libres
amorties
.
b- De quel régime s’agit-il ?
c- Déterminer graphiquement
- la pseudo période T.
- Le sens du courant réel entre les dates t1 et t2. Comment se comporte le condensateur entre
ces deux instants ?
d- La résistance totale du circuit est petite, on peut considérer que la pseudopériode est
pratiquement égale à la période
propre
T LC
02
, calculer la valeur de
l’inductance L de la bobine sachant que la
capacité du condensateur est égale à 40
µF.
2-
a- Etablir l’équation différentielle régissant
les variations de la tension uC(t) aux
bornes du condensateur au cours du
temps.
b- Donner l’expression de l’énergie
électromagnétique E du circuit.
c- Montrer que E diminue au cours du
temps. Interpréter cette diminution.
d- Calculer la valeur de l’énergie dissipée
par effet joule dans le circuit entre les
instants t0=0s et t1.
Fig 1
L,r
R
K
C
Voie 1
Fig 2
A
M
B
i
0
t1
t2
44 ms

~ 5/4 ~ 4ème Maths
1
/
5
100%