La minéralogie

1
La minéralogie
Etudier la composition chimique et la structure des minéraux.
Qu’est-ce qu’un cristal ?
C’est un solide naturel et homogène, il est limité par des surfaces plus ou moins planes avec
des angles bien définis.
120°
Quartz
La structure atomique bien définie, ordonnée, périodique, composition chimique définie.
Quartz : SiO2 Silex : SiO2 Opale : SiO2 Olivine (Mg, Fe) : SiO4
Comment différencier les minéraux ?
Forme
On définit un certain nombre de mailles cristallines.
Ex : 2D
Dans la nature il y a 7 volumes de bases qui permettent de recouvrir tout l’espace.
Système 3D permettant de définir le réseau.
Le système cubique
a = b = c
γ = α = β = 90°
γ
β
α

2
La symétrie axiale
Axe d’ordre 2 (180°)
Axe d’ordre 3 (120°)
Axe d’ordre 4 (90°)
Axe d’ordre 6 (60°)
Plan de symétrie :
- Plan perpendiculaire à un axe d’ordre Y est dit plan d’ordre X.
3 Plans d’ordre 4 = M4
3 Axes d’ordre 4
6A2 et 6M2

3
Axe d’ordre A3
4A3 4M3
Le cube possède donc :
3A4, 4A3, 6A2, 6M2, 6M4 et un centre de symétrie.
Exemple : pyrite (FeS2), Halite (NaCl), le diamant (C)
Grenat : un cube avec les coins coupés.
- quadratique : prisme à base carré
- orthorhombique : prisme droit à base rectangulaire (3 paires de rectangle)
- hexagonale : prisme droit à base hexagonale (quartz)
- rhomboédrique : toutes les faces sont des losanges égaux. (calcite)
- monoclinique : prisme oblique (orthose / mica) des parallélogrammes
- triclinique : que des parallélogrammes égaux 2 à 2.
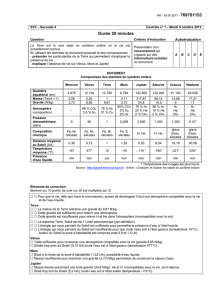
Dureté :
Elle se mesure avec l’échelle de Mohs
Principe : un minéral de dureté 5 raye ceux de dureté 1→4.
8 raye 1→7
1 2 3 4 5 6 7 8 9 10
Talc – Gypse – Calcite – Fluorite – Apatite – Orthose – Quartz – Topaze – Corindon – Diamant
Attention : l’échelle n’est pas linéaire (c’est exponentiel)
Ex : l’ongle a une dureté de 2-2,5
Une lame de couteau suisse 6-6,5
La densité
Dépend de la composition chimique et de la structure du minéral.
Calcite 2,7
Quartz 2,5
Olivine 3,27 – 4,3
La composition chimique (8 familles)
- éléments natifs
- sulfures (S-)
- sulfates (SO42-)
- phosphates (PO43-)
- silicates
- carbonates (CO32-)
- halogénures
- oxydes et hydroxydes

4
Comment décrit on les minéraux ?
Composition chimique
Caractéristique physique
- forme : mailles élémentaires (7 mailles : a, b, c et α, β, γ symétrie)
- densité
- dureté
- éclat
- couleur
- transparence
- goût
- toucher
Les indices de Miller = servent à définir les plans des cristaux.
1. on regarde où passe le plan sur les 3 axes en multiple de a, b, c. 1.a, 1.b, 1.c.
2. on prend l’inverse de ces coefficients 1/1, 1/1, 1/1. 1, 1, 1
3. on réduit les fractions. Indice du plan (rouge) (1, 1, 1)
Ex : 2
1/2a, 1/2b, 1/2c.
On prend l’inverse → 2, 2, 2
On divise par le plus grand multiple commun.
→ Les indices de Miller définissent une série de plans parallèles.
Exercices :
1) ½, ½, 1
2) 2, 2, 1
3) indice (2, 2, 1)
1) 1, inf, 1
2) 1, 0, 1
c
a
b
c
a
b

5
3) indice (1, 0, 1)
1) inf, inf, 1
2) 0, 0, 1
3) indice (1, 0, 1)
La trace :
On frotte le minéral sur une porcelaine dépolie et on regarde la couleur de la trace.
Pourquoi l pyrite (sulfure de fer) fait un cube.
Les liaisons interatomiques
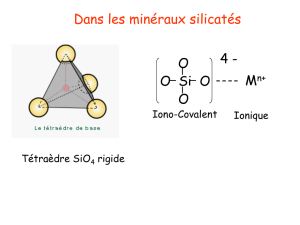
→ Ioniques : force entre un cation un anion
→ Covalences : mise en commun d’électrons entre des atomes voisins.
→ Métalliques : comme ioniques mais tous les atomes sont semblables.
→ Van der Walls : liaisons lâches entre atomes neutres.
La coordination
Atour de chaque cation il y a un certain nombre d’anions. Ce nombre est le nombre de
coordination.
Il dépend du rapport rayon du cation/rayon de l’anion. Rc/Ra.
Les formes :
R/ra
Type
Forme
Elément
1 à 0,73
Octocoordination
Cube
Na, Ca
0,73 à 0,41
Hexacoordination
Octaèdre
Al, Fe, Mg
0,41 à 0,22
Tetracoordination
Tétraèdre
Si, Al
Exemple :
SiO4 est une tétraèdre avec le silicium au centre et 4 atomes d’oxygène aux angles du
tétraèdre.
On peut mettre certains cations par paires : Si4+ / Al3+ Mg2+/Fe2+ Ca2+/Na+
Chaque cation de la paire à un rayon plus ou moins similaire.
Pour pouvoir substituer un ion par un autre il faut qu’ils aient la même taille (± 15%)
c
a
b
Il y a une charge
négative supplémentaire
 6
6
 7
7
 8
8
1
/
8
100%