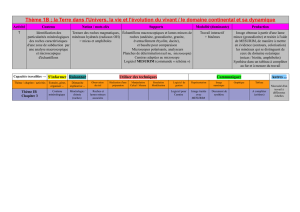
les silicates

LES SILICATES
Les silicates et les différentes formes de silice qui s’y
rattachent ont une importante industrielle et
géochimique considérable. Ces minéraux, matières
premières des industries du bâtiment, de la verrerie,
de la céramique, et constituants des laitiers
métallurgiques, forment la quasi-totalité de l’écorce
terrestre. Ce sont, pour la plupart, des solutions
solides dont la synthèse et l’interprétation des
analyses chimiques sont différentes de celles des
autres composés inorganiques. C’est la
détermination, à partir de la diffraction des rayons
X, des structures atomiques de ces composés
cristallisés et les synthèses faisant intervenir des
minéralisateurs (et, en particulier, l’eau agissant à
des températures et à des pressions élevées) qui ont
résolu les énigmes de ce chapitre de la chimie
minérale. On ne considère plus les silicates comme
des sels d’acides siliciques, mais comme des
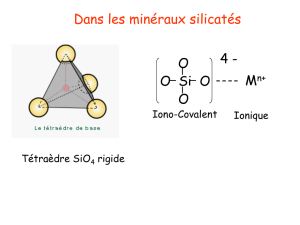
assemblages de tétraèdres quasi réguliers (Si, Al)O4,
dont les centres sont occupés par des ions silicium ou
aluminium, et les sommets par des ions oxygène.
Dans les tectosilicates, les tétraèdres forment une
charpente tridimensionnelle (Si, Al)x O2x, dans
laquelle chacun des atomes d’oxygène est commun à
deux tétraèdres. Quand les centres des tétraèdres
sont tous des atomes Si, les charpentes,
électriquement neutres, ont pour formule SiO2 et

correspondent aux différentes formes de silice telles
que le quartz, la tridymite et la cristobalite [cf.
SILICE]. Si une partie des atomes Si est remplacée
par des atomes Al, la charpente constitue un
macroanion dont la charge négative est compensée
par des cations, comme dans les feldspaths, les plus
importants des silicates, les feldspathoïdes, les
zéolites, toujours hydratées, auxquelles les
charpentes très ouvertes confèrent des propriétés
physico-chimiques particulières en ce qui concerne
l’échange des cations et la mobilité de l’eau. Les
phyllosilicates (micas, chlorites, minéraux des
argiles, etc.), à clivage facile, sont caractérisés par
des feuillets plans de tétraèdres associés par trois de
leurs sommets. Dans les inosilicates, les tétraèdres
s’associent pour former soit des chaînes simples
comme dans les pyroxènes, soit des chaînes doubles
comme dans les amphiboles. Dans les sorosilicates,
les tétraèdres constituent des groupes finis; le plus
simple, comprenant deux tétraèdres, se trouve dans
de nombreux silicates tels que l’épidote; le groupe
peut être un anneau de tétraèdres: ce sont les
cyclosilicates tels que le béryl. Dans les nésosilicates,
tels que les péridots (olivine), les grenats, les
tétraèdres sont indépendants.
1. Importance et nature
Rôle géochimique

Si l’importance économique des silicates est
considérable, leur rôle géochimique est essentiel. Ils
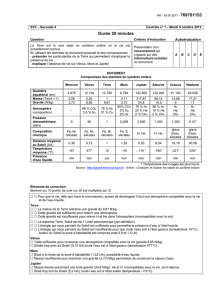
forment plus de 90 p. 100 en poids de l’écorce
terrestre. Les nombreuses données statistiques sur la
composition chimique de la partie superficielle, en
particulier celles qui ont été obtenues par
F. W. Clarke et H. S. Washington (1924) se
rapportant aux roches éruptives, peuvent être
présentées sous forme condensée dans le tableau ci-
contre.
Les roches sédimentaires et les roches
métamorphiques, qui proviennent principalement de
la transformation des roches éruptives, sont
beaucoup moins abondantes et ont presque la même
composition chimique: les actions d’oxydation,
d’hydratation, de carbonatation de l’atmosphère
altèrent très peu la composition de l’ensemble. Il en
résulte que huit éléments chimiques seulement se
combinent pour former pratiquement toute la masse
de la lithosphère qui est directement accessible à
l’analyse chimique. L’oxygène prédomine largement
avec 46,60 p. 100; puis vient le silicium avec 27,72 p.
100. Ces deux éléments interviennent donc pour les
trois quarts de la masse de la lithosphère. Les six
autres éléments chimiques sont l’aluminium avec
8,13 p. 100, le fer 5,00 p. 100, le calcium 3,63 p. 100,
le sodium 2,83 p. 100, le potassium 2,59 p. 100, le
magnésium 2,09 p. 100; tous les autres éléments
chimiques ne comptent, pondéralement, que pour

1,41 p. 100. En attribuant à l’ion oxygène, un rayon
de 0,132 nm, V. M. Goldschmidt fait remarquer que
les atomes d’oxygène occupent 90 p. 100 du volume
de la lithosphère; ces atomes ionisés sont liés entre
eux par les cations, qui sont essentiellement Si, Al,
Fe, Ca, Na, K, Mg, pour former des silicates et la
silice. Les plus abondants – plus de 60 p. 100 en
poids – sont les feldspaths, aluminosilicates de
potassium, de sodium et de calcium; viennent ensuite
les pyroxènes et les amphiboles (env. 17 p. 100), puis
le quartz (12 p. 100), les micas (4 p.100). Les silicates
sont aussi les constituants essentiels de l’ensemble
des météorites, sous la forme, le plus souvent, de
l’olivine et d’un pyroxène; dans leur composition
pondérale moyenne, fournie par Goldschmidt, les
éléments chimiques qui comptent pour plus de 1 p.
100 sont: l’oxygène (32,30 p. 100), le fer (28,80), le
silicium (16,30), le magnésium (12,30), le soufre
(2,12), le nickel (1,57), l’aluminium (1,38), le calcium
(1,33).
Place particulière en chimie minérale
Jusqu’à une période relativement récente, les
silicates ont constitué un des chapitres de la chimie
minérale les moins bien connus, car les méthodes
classiques d’étude des composés inorganiques ne leur
sont pas, en général, applicables. Quand ils peuvent
être chauffés jusqu’à leur fusion sans se décomposer,
ils fournissent, souvent, un verre au refroidissement,
et beaucoup d’entre eux ne peuvent être reproduits

au laboratoire à la pression ordinaire. Leur analyse
chimique est difficile, car ce sont, presque toujours,
des solutions solides dans lesquelles interviennent
différents éléments chimiques par le jeu des
remplacements isomorphiques. Et la traduction des
analyses dans une formule chimique a, pendant
longtemps, fait appel aux hypothèses fausses d’acides
siliciques complexes. Il en a résulté un divorce entre
chimistes et minéralogistes; pour ces derniers, la
parenté des propriétés cristallographiques et
physiques rapproche, dans une même famille,
comme celles des micas et des pyroxènes, des
minéraux qui, du point de vue chimique,
apparaissaient très différents. C’est la diffraction
cristalline des rayons X, entreprise d’abord par
W. L. Bragg et ses élèves, qui a réconcilié chimistes
et minéralogistes; et la détermination des structures
atomiques a eu pour conséquence de faire du
chapitre des silicates l’un des plus clairs de la chimie
inorganique.
En s’appuyant sur les données des rayons X,
Goldschmidt fournit, dès 1924, les dimensions des
atomes ionisés, qu’il assimile à des sphères chargées
électriquement; les silicates peuvent être envisagés
comme des édifices d’anions oxygène, de rayon
0,132 nm, au contact de cations plus petits, liés par
les forces électrostatiques de Coulomb. Goldschmidt
insiste sur la notion de coordination d’un cation:
c’est le nombre des anions qui l’entourent; il est
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%