SiO 4 - Free

O Si O
O
O4 -
Mn+
Iono-Covalent Ionique
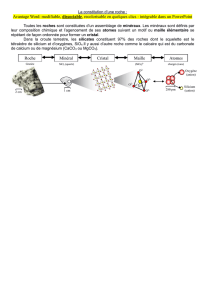
Dans les minéraux silicatés
Tétraèdre SiO4rigide

94% du volume de la croûte continentale est constitué d’oxygène
Si et O les plus abondants: Si+O = 74,3% en masse
silicates = 95% en masse
8 éléments
chimiques
à la base de
la composition
de la croûte
continentale

Composition moyenne de la Croûte continentale
Elément % Poids
----------------------------
Oxygène (O) 46.6
Silicium (Si) 27.7 (très important)
Aluminium (Al) 8.1
Fer (Fe) 5.0
Calcium (Ca) 3.6
Sodium (Na) 2.8
Potassium (K) 2.6
Magnésium (Mg) 2.1
total 98.5
1.5% poids pour
tous les autres éléments
chimiques

Organisation structurale = classification des silicates
3D

Polymérisation des tétraèdres silicatés
neutralisation des charges des oxygènes
[Si2O7]6-
[SiO4]4-
[Si6O18]12-
[Si2O6]4-
[Si4O11]6-
[Si2O5]2-
[SiO2]0
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
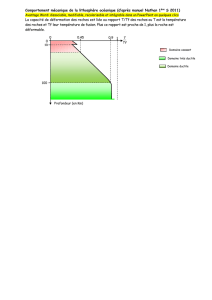
100%