correction DS

page 1
NOM : PRENOM :
DS PV + PVI + PVII + CV + CVI 2h noté sur 35 points
PRESENTATION, REDACTION : +1 ou -1 point
PHYSIQUE (19 points)
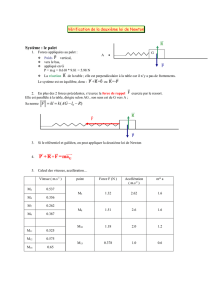
Dans un stand de kermesse, un jeu consiste à projeter un palet sur un plan incliné vers le haut.
Le palet de masse m = 10 kg est guidé par un rail incliné d’un angle a = 45° par rapport à l’horizontale :
On mesure la vitesse initiale du palet au point A. On trouve vA = 6,5 m.s-1.
Après avoir parcouru une distance notée L, le mobile s’arrête au point B avant de redescendre.
Dans tout le problème on néglige la poussée d’Archimède et on considère que l’intensité de la pesanteur est constante.
On prendra g = 9,8 N.kg-1.
PREMIERE PARTIE : détermination de la valeur de L par deux méthodes différentes
Dans cette première partie, on néglige aussi les forces de frottement de l’air et du rail. La réaction du rail sur le palet est
perpendiculaire au déplacement.
A) 1ère méthode : théorème de l’énergie cinétique (10 points)
1. Faire le bilan des forces s’exerçant sur le palet.
2. Représenter ces forces sans soucis d’échelle mais en respectant leur point d’application.
3. Que peut-on dire du travail de la réaction du sol lors du déplacement ? Justifier la réponse.
4. Le travail du poids est-il moteur ou résistant lors du déplacement du palet ?
Exprimer ce travail, sans le calculer, en fonction L.
5. Calculer l’énergie cinétique du palet au point A.
6. Que peut-on dire de l’énergie cinétique du palet au point B ? Justifier la réponse.
7. Enoncer et appliquer le théorème de l’énergie cinétique entre les points A et B pour déterminer la distance L parcourue
par le palet.
B) 2ème méthode : conservation de l’énergie mécanique (5 points)
8. Exprimer l’énergie potentielle du palet au point B en fonction de L.
On prendra le point A comme origine des altitudes.
9. Que peut-on dire de l’énergie potentielle du palet au point A ? Justifier la réponse.
A
B
a
z

page 2
10. Déduire des questions 6. et 8. l’énergie mécanique du palet au point B.
11. Déduire des questions 5. et 9. l’énergie mécanique du palet au point A.
12. Justifier que l’énergie mécanique se conserve lors du mouvement et déterminer la distance L parcourue par le palet
lorsqu’il s’arrête au pont B.
13. Lorsque le palet redescend et passe de nouveau au point A, il retrouve la même vitesse. On sait que vA = [2×g×L×sin(a)]1/2.
Que montre ce résultat ? (à part que vos résultats pour L sont corrects ou faux …)
DEUXIEME PARTIE : prise en compte des frottements (4 points)
Dans cette deuxième partie, on considère que la force globale de frottement qui s’exerce sur le palet est constante,
parallèle à son mouvement, en sens inverse de celui-ci et de valeur égale à f = 10 N.
Le palet s’arrête moins loin à un point C tel que AC = 2,5 m.
14. Représenter cette force sur le schéma sans soucis d’échelle.
15. Calculer le travail de cette force lors du déplacement du palet du point A au point C.
16. Calculer la puissance consommée par ces frottements sachant que la montée dure 1,2 s.
CHIMIE (15 points)
EX 1 (4 points)
1. Rappeler la définition d’un acide et d’une base selon Bronsted.
2. Indiquer la formule de la base conjuguée de l’ion ammonium NH4+(aq).
Ecrire la demi-équation protonique liant ces deux espèces chimiques.
3. Ecrire le couple acide-base contenant l’ion éthanoate CH3COO-(aq) .
4. On mélange une solution aqueuse de chlorure d’ammonium (NH4+(aq) , Cl-(aq)) avec une solution d’éthanoate de sodium
(Na+(aq) , CH3COO-(aq)). Comment appelle–t’on les ions Cl-(aq) et Na+(aq) ?
Ecrire l’équation de la réaction acido-basique qui s’effectue.
EX 2 (11 points)
Le détartrant pour cafetière est vendu sous forme de poudre blanche. Celle-ci est essentiellement constituée d'acide
sulfamique, de formule H2NSO3H(s) , dont la base conjuguée est l'ion sulfamate H2NSO3-(aq) .
On dissout m = 200,0 mg de ce détartrant dans une fiole jaugée de volume V = 250 mL contenant un peu d'eau distillée. On
complète avec l'eau distillée jusqu'au trait de jauge puis on agite.

page 3
L'équation de dissolution de l'acide sulfamique dans l'eau est totale : NH2S03H(s) + H20(l) → NH2S03-(aq) + H30+.
On dispose donc d'une solution aqueuse, notée SA, de concentration inconnue CA, contenant uniquement les ions NH2S03-(aq)
et H30+ tels que n(NH2S03-(aq)) = n(H30+).
Pour doser les ions H30+ présents dans cette solution SA, on utilise une solution aqueuse d'hydroxyde de sodium, notée SB,
contenant les ions Na+(aq) et HO-(aq) tels que n(Na+(aq)) = n(HO-(aq)).
On dose un volume VA = 20,0 mL de la solution SA de concentration CA, par la solution d'hydroxyde de sodium, SB, de
concentration molaire CB = 1,0.10-2 mol.L-1.
On utilise une sonde conductimétrique pour repérer l’équivalence du dosage. La courbe donnant l'évolution de la conductance
G en fonction du volume VB d'hydroxyde de sodium ajouté est donnée ci-dessous :
1. Annoter le schéma du montage réalisé pour ce dosage :
2. Ecrire les deux couples acide –base mettant en jeu l’eau.
En déduire l'équation bilan de la réaction de titrage qui a lieu entre les ions HO-(aq) et H30+.
3. Quel est le réactif titrant ? Quel est le réactif titré ?
4. Définir l'équivalence. Quel est le réactif limitant avant l’équivalence ? Quel est le réactif en excès après l’équivalence ?
Compléter le tableau d'avancement de ce titrage en tenant compte des ions spectateurs, en fonction de CA, VA, CB, VB et
VB,E le volume de solution SB ajouté à l'équivalence :
H30+
NH2S03-(aq)
HO-(aq)
Na+(aq)
Avant l’équivalence
nA =
n1 = CA×VA
nB =
n2 = CB×VB
A l’équivalence
VB = VB,E
nA =
nA = 0
n1 =
nB =
n2 =

page 4
Après l’équivalence
nA =
n1 =
nB =
n2 =
5. En déduire la relation entre CA, VA, CB et VB,E.
6. Déterminer graphiquement le volume VB,E de solution SB ajouté à l'équivalence. Faire figurer les traits de construction.
7. Calculer alors la concentration CA d'acide sulfamique de la solution SA.
8. Montrer alors que la masse d'acide sulfamique présent dans la fiole jaugée est mA = 182 mg.
Donnée : M(NH2S03H(s)) = 97,1 g.mol-1.
9. En déduire la teneur (= pourcentage massique) du détartrant en acide sulfamique.
1
/
4
100%