Devoir Surveillé 6 EXERCICE 1 : Dosage du dioxyde de soufre On

Devoir Surveillé 6
EXERCICE 1 : Dosage du dioxyde de soufre
On dose un effluent gazeux contenant du dioxyde de soufre à la sortie d’une
cheminée industrielle, avant traitement pour rejet à l’air libre.
Pour cela on fait barboter un volume de gaz Vg = 10 m3 dans V1 = 250 mL d’eau
distillée de façon à dissoudre tous les gaz solubles dans l’eau. La solution obtenue,
versée dans un erlenmeyer est dosée par une solution de permanganate de
potassium acidifiée de concentration C2 = 1,0.10-3 mol.L-1.
Pour atteindre l’équivalence le volume de permanganate versé Ve2 = 18,8 mL.
1. Ecrire l’équation chimique de la réaction modélisant la transformation
2. Déterminer la quantité de matière d’ions MnO4
- ajoutés pour atteindre
l’équivalence.
3. Donner la relation qui lie la quantité de matière n MnO4
-
versés et celle de
dioxyde de soufre initialement présent dans le mélange réactionnel. à
l’équivalence
4. Déterminer la quantité de matière de dioxyde de soufre dans la solution dosée
5. En déduire la masse de dioxyde de soufre contenue dans Vg = 10 m3
d’effluent gazeux
EXERCICE 2 :
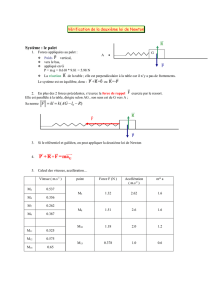
En travaux pratiques, on propose à un binôme d'élèves de réaliser le dosage par
conductimétrie d'un détartrant ménager acide (contenant de l'acide sulfamique). Ils
dissolvent un sachet de 25,0g dans 1,00L d'eau (solution A), prélèvent une prise
d'essai de volume V1=10,0mL, qu'ils versent dans un bêcher, et ajoutent 90,0mL
d'eau.
Les élèves disposent d'une solution d’hydroxyde de sodium de concentration
CB=5,00.10-1mol.L-1.
Ils réalisent le dosage conductimétrique et calculent les valeurs de la conductance
G de la solution dans le bécher au cours de celui-ci. Enfin, ils tracent le graphe
représentant G en fonction du volume de base VB versé.
1. Quelle est l'équation de la réaction de dosage ?
2. Comment, à partir de cette courbe, détermine t-on le point d’équivalence ?
3. Les élèves ont déterminé un volume équivalent VBE=5,31mL de base versé.
Déterminer la quantité de matière d'ions hydroxyde HO-
(aq) introduits à
l'équivalence.
4. En déduire la quantité de matière d'ions oxonium H3O+
(aq) contenue dans la
prise d'essai de la solution d'acide.
Données : masses molaires atomiques : M(N)=14,0g.mol-1; M(O)=16,0g.mol-1;
M(S)=32,1g.mol-1. M(H)=1,0g.mol-1;
EXERCICE 3 :
Un palet de masse M=4,5kg est lancé du point O vers le haut, avec une vitesse
initiale V0=4,2m.s-1 suivant la ligne de plus grande pente d'un plan incliné d’un
angle α=12° par rapport au plan horizontal.
1. On suppose les frottements négligeables. Quelle est la vitesse V1 du palet
lorsqu'il a parcouru la distance d1=OA=2,7m ?
2. Au bout de quelle distance d2=OB la vitesse du palet s'annule-t-elle?
3. L'observation montre que la vitesse du palet s'annule en fait au bout d'une
distance d=OC=4,05m. Quelle est la valeur f de la force de frottement f,
supposée constante, exercée par le plan sur le palet ?
Donnée : intensité de la pesanteur g=9,81N.kg-1.
EXERCICE 4 : Tarzan se balance
Tarzan s'élance du haut d'un rocher,
accroché à une liane tendue. Au plus bas
de sa descente, l'altitude de son centre
d'inertie G est à 4,0 m au dessous de sa
position de départ.
On ne tient pas compte des forces de
frottements
L'altitude z du centre d'inertie est
comptée à partir de la position de départ.
Pour étudier le mouvement de G, on peut modéliser Tarzan par un objet ponctuel
placé en G.
1. Etablir l'inventaire des forces extérieures exercées sur Tarzan après son
départ du rocher.
2. Exprimer le travail de chacune de ces forces pour un déplacement depuis la
position de départ jusqu'à une position où G est à l'altitude z quelconque.
3. Tarzan quitte le rocher sans vitesse initiale. Calculer sa vitesse lorsqu'il
passe par sa position la plus basse ;
4. Dans les mêmes conditions, quelle altitude maximale peut-il atteindre ?
5. A quelle vitesse minimale devrait-il s'élancer pour atteindre le sommet
d'un autre rocher, situé à 1,5 m au dessus de la position de départ ?
…………….Bonne chance
1
/
1
100%