Fiche méthodologique sur la pratique du raisonnement scientifique

Fiche méthodologique sur la pratique du raisonnement scientifique S.Dalaine 2011
Lycée E. Delacroix 1ère S
Exercice de type II.2. « Pratique du raisonnement scientifique »
Démarche à suivre pour résoudre le problème posé (Bordas p47)
Phrase introductive :
Il s’agira de comprendre les effets des UV à travers l’étude d’une maladie le Xeroderma Pigmentosum. L’analyse des
documents proposés doit nous permettre d’expliquer la maladie à différentes échelles d’observation.
Le paragraphe introductif accompagné d’une photographie présentant un individu atteint par XP révèle que cette
maladie est génétique. Elle trouve donc son origine dans l’expression de un ou plusieurs gènes, codant pour une ou
plusieurs protéines.
D’autre part, le texte précise les symptômes à l’échelle macroscopique de la maladie : une sensibilité excessive de la
peau aux UV, un risque anormalement élevé de développer un cancer de la peau.
Cette maladie d’origine génétique semble donc être favorisée par un facteur environnemental : les UV.
Comment expliquer le lien entre UV et gène ?
Le document 1 nous précise que les UV agissent directement sur la molécule d’ADN en créant des dimères de
thymine. Ces dimères perturbent la réplication de l’ADN (phase S de l’interphase) et également son expression en
protéine. Ces dimères engendrent donc des mutations sur la molécule d’ADN, créant de nouveaux allèles.
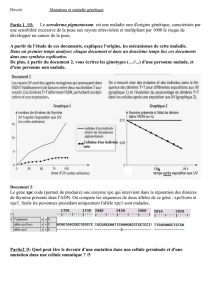
Le graphique 1 présente le nombre de dimères de T 24h après exposition aux UV en fonction de la dose d’UV en ua
pour des cellules d’individus sains et des cellules d’individus atteints de XP. On constate que le nombre de dimères de
T augmente avec la dose dans les deux cas, mais surtout, pour une dose d’UV de 75 ua, on enregistre 2 ua de dimères
de T dans les cellules de personnes saines contre 7 ua chez des personnes malades. Plus la dose d’UV est forte plus le
nombre de dimères augmente rapidement chez des personnes malades.
Comment expliquer ce constat ?
Les personnes atteintes de XP n’ont peut-être pas une molécule qui protège leur ADN (hypothèse 1), ou bien ils ne
possèdent pas une molécule qui répare l’ADN lésé par les UV (hypothèse 2).
Le graphique 2 présente le % de dimères de T dans l’ADN en fonction du temps après exposition à une dose constante
d’UV pour des cellules d’individus sains et malades. On constate qu’initialement juste après exposition aux UV les
cellules des deux types possèdent 0,10 % d’ADN lésé. On en déduit que parmi les deux hypothèses proposées
précédemment l’hypothèse 1 est infirmée. En effet, l’ADN des individus XP n’est ni plus ni moins protégé des UV que
celui des individus sains. En revanche, on constate qu’après exposition, le nombre de dimères de T disparaît
progressivement au cours du temps chez les individus sains. En 12h il a diminué de moitié. Chez les individus XP les
dimères créés au temps 0 restent après l’exposition. On en déduit donc que la seconde hypothèse est validée : les
individus XP ne possèdent pas une protéine permettant de réparer les dimères de T créés par les UV.
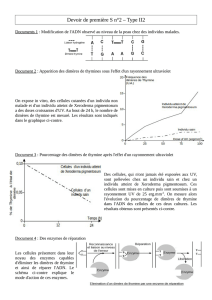
Le document 2 présente une protéine, l’enzyme XPf dont le rôle est de réparer les dimères de T. Il nous propose la
séquence en nucléotides des allèles codant cette protéine chez un individu sain et chez deux individus malades. On
constate chez l’individu malade 1 une différence au nucléotide n°2362, la cytosine de l’individu sain est remplacée par
une thymine chez l’individu malade.
Dans le cas de l’individu malade 2, on constate deux différences dans la séquence nucléotidique avec l’individu sain de
référence : n°1471 l’adénine a remplacé la guanine, et n°1553 la cytosine a remplacé la thymine.
Ainsi, on observe deux versions alléliques chez les individus malades qui diffèrent de la version allélique de l’individu
sain. On en déduit que les allèles « mutés » (car rares) des individus malades codent pour des enzymes XPf non
fonctionnelles, qui ainsi ne réparent pas l’ADN lésé par les UV.
Bilan :
Un individu XP possède dans son génotype la version allélique rare (appelée mutée) du gène codant pour enzyme XPf
dont le rôle est de réparer les dimères de T créés par les UV.
Dès qu’un individu XP s’expose aux UV, les dimères de T engendrés par les UV sur l’ADN ne peuvent être réparés. Si
cette erreur affecte un gène « vital » pour la cellule, comme par exemple, un gène intervenant dans l’entrée en mitose
(gène code la protéine P53 par exemple), alors la mutation non réparée, est conservée et transmise aux cellules filles.
Cette transmission de cellules en cellules implique une mitose anarchique des cellules, aboutissant à une tumeur.
Ainsi le génotype « allèle XPf muté » implique un phénotype moléculaire « enzyme XPf non fonctionnelle », qui
implique un phénotype cellulaire « mitoses non régulées des cellules », induisant un phénotype macroscopique
« cancer de la peau ». Ce phénotype malade est dû au génotype mais aussi à l’environnement (ici les UV).
Enfin, on peut remarquer, grâce aux individus malades du doc 2, qu’un même phénotype (ici phénotype malade) peut
découler de génotypes différents (les individus 1 et 2 n’ont pas les mêmes allèles mutés).
1
/
1
100%