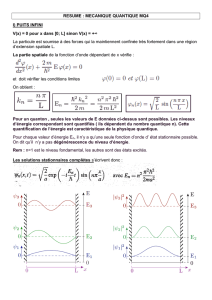
TP d`Immunologie

TP d’Immunologie 2009-2010
1
Au cours de ce TP vous allez dans un premier temps visualiser le phénomène de maturation
lymphocytaire, des organes lymphoïdes primaires vers les organes lymphoïdes secondaires. Dans un
deuxième temps, vous mettrez en évidence le caractère spécifique de la réponse immunitaire à un antigène
(ici l’antigène LACK du parasite Leishmania major) en dosant les immunoglobulines anti-LACK
produites par les lymphocytes B, et les cytokines produites par les lymphocytes T spécifiques de LACK.
Visualisation des lymphocytes dans le thymus et la rate
Les cellules du système immunitaire dérivent toutes de précurseurs immatures de la moelle rouge osseuse. Une
fois matures, ces cellules vont se localiser via le sang dans les organes lymphoïdes secondaires. Toutefois,
certaines cellules subissent un processus de sélection dans les organes lymphoïdes primaires. C’est notamment le
cas des lymphocytes T qui subissent une double sélection dans le thymus, avant de migrer vers la rate ou les
ganglions lymphatiques.
Vous visualiserez le contenu cellulaire d’un organe lymphoïde primaire, le thymus, ainsi que d’un organe
lymphocyte secondaire, la rate. Pour cela vous préparerez des suspensions cellulaires de ces deux organes, vous
les marquerez avec des anticorps fluorescents, puis vous les analyserez par cytométrie de flux.
Mise en évidence d’anticorps anti-LACK dans le sérum de souris immunisées par cet antigène
Des souris ont été injectées dans le coussinet plantaire avec 100 µg de protéine LACK émulsifiée dans de
l’Adjuvant Complet de Freund. Cette première injection a eu pour but de déclencher chez la souris une réponse
immunitaire dite "primaire" qui a abouti a l'activation des lymphocytes T anti-LACK et à la différenciation des
lymphocytes B exprimant à leur surface des IgM anti-LACK. Une semaine plus tard, les souris ont été injectées
une nouvelle fois avec la protéine LACK émulsifiée dans de l’Adjuvant Incomplet de Freund. Les lymphocytes
B activés lors de la réponse primaire ont ainsi été induits à sécréter des IgG anti-LACK.
Vous mettrez en évidence la présence d'IgG anti-LACK dans le sérum issu du sang des souris immunisées en
utilisant un dosage ELISA.
Production de cytokines par les lymphocytes T activés
Comme pour les lymphocytes B, l'injection de la protéine LACK a entraîné l'activation des lymphocytes T anti-
LACK. Cette activation résulte de l'interaction du récepteur des lymphocytes T avec leur ligand: un fragment
peptidique de LACK lié au complexe majeur d'histocompatibilité à la surface des cellules présentatrices
d'antigène. Ce processus entraîne la sécrétion de cytokines comme l'Interleukine-2 (IL-2) ou l'interféron-gamma
(IFN-) par les lymphocytes T. Cette activation peut être mise en évidence in vitro lorsque l'on re-stimule des
cellules de rate en culture avec le peptide LACK: les lymphocytes T anti-LACK activés vont produire des
cytokines.
Vous mettrez en évidence la production de cytokines par les lymphocytes T spléniques spécifiques de
l'antigène LACK:
-en dosant par ELISA l’IL-2 sécrété dans le milieu de culture des splénocytes
-en mettant en évidence par RT-PCR les ARNm de l'IL-2 et l'IFN- à l'intérieur des splénocytes

TP d’Immunologie 2009-2010
2
Diagramme récapitulatif du TP
2

TP d’Immunologie 2009-2010
3
Jour 1
I. Préparation des suspensions cellulaires
Une souris, préalablement immunisée avec la protéine LACK, sera sacrifiée. Sa rate et son thymus seront
prélevés par un enseignant.
Thymus
1. Placer un filtre dans une boîte. Verser 1 ml de [DMEM - 10% FCS] sur le filtre avant d'y déposer le thymus
2. Ecraser le thymus avec le piston d'une seringue (côté caoutchouc)
3. Rincer le filtre au dessus de la boîte avec 4 ml de [DMEM - 10% FCS]
4. A l'aide d'une pipette, homogénéiser puis récupérer la suspension cellulaire dans un tube Falcon de 15 ml
(identifié "thymus" avec vos initiales)
5. Compter le nombre de cellules dans la suspension. Pour cela, diluer dans un tube Eppendorf 100 µl de la
suspension cellulaire dans 1 ml final de [DMEM - 10% FCS] (dilution 1/10), et prélever quelques µl de la
dilution pour la compter dans une cellule de Thoma.
Rate
1. Placer un filtre dans une boîte. Verser 1 ml de [DMEM - 10% FCS] sur le filtre avant d'y déposer la rate
2. Ecraser la rate avec le piston d'une seringue (côté caoutchouc)
3. Rincer le filtre au dessus de la boîte avec 4 ml de [DMEM - 10% FCS]
4. A l'aide d'une pipette, homogénéiser puis récupérer la suspension cellulaire dans un tube Falcon de 15 ml
(identifié "rate" avec vos initiales)
5. Centrifuger 5 minutes à 1500 tpm. Eliminer le surnageant. Ajouter au culot 2 ml d’ACK (tampon de lyse des
hématies).
6. Après 2 minutes, ajouter 5 ml de [DMEM - 10% FCS] dans le tube afin de stopper la réaction de lyse par
l'ACK
7. Centrifuger 5 minutes à 1500 tpm. Eliminer le surnageant. Ajouter au culot 5 ml de [DMEM - 10% FCS]
8. Compter le nombre de cellules dans la suspension de la même manière que pour le thymus
II. Visualisation des lymphocytes dans le thymus et la rate
1. Remplir 2 tubes FACS avec 1 ml de [PBS - 0,5% BSA] (identifiés "thymus FACS" et "rate FACS" avec vos
initiales)
2. Prélever 2.106 thymocytes et 2.106 splénocytes, et les transférer dans les tubes FACS correspondants
3. Centrifuger 5 minutes à 1500 tpm. Jeter le surnageant, puis éponger le tube retourné sur du papier absorbant
(afin d'éliminer la totalité du surnageant)
4. Ajouter 50 µl du mélange d'anticorps fluorescents dans vos tubes
Attention: Noter la combinaison d'anticorps dont il s'agit, ainsi que les fluorochromes auxquels ils sont
couplés.
5. Incuber 30 minutes dans la glace, à l'obscurité
Pendant l'incubation, passer aux étapes III & IV: Mise en culture des splénocytes & Préparation des
plaques ELISA
6. Ajouter 1 ml de PBS - 0,5% BSA dans chacun des tubes FACS afin de rincer la solution d'anticorps
7. Centrifuger 5 minutes à 1500 tpm. Jeter le surnageant
8. Remettre en suspension les cellules dans 300 µl de [PBS - 0,5% BSA] pour l'analyse FACS
9. Passer les cellules au FACS

TP d’Immunologie 2009-2010
4
III. Mise en culture des splénocytes: re-stimulation des lymphocytes T anti-LACK
Si la concentration de votre suspension cellulaire de rate est <107 cellules/ml étape 1
Si la concentration de votre suspension cellulaire de rate est >107 cellules/ml étape 3
1. Centrifuger le tube "rate" 5 minutes à 1500 tpm. Jeter le surnageant
2. Ajouter la quantité de [DMEM - 10% FCS] nécessaire pour obtenir une concentration cellulaire de 107
cellules/ml. Agiter pour resuspendre le culot. Laisser le tube à température ambiante
3. Préparer la plaque de culture 96 puits comme suit:
1
2
3
4
5
6
7
8
9
10
11
12
A
H20
H20
H20
H20
H20
H20
H20
H20
B
H20
10
µM
5
µM
2,5
µM
1,2
µM
0,6
µM
0
H20
C
H20
H20
H20
H20
H20
H20
H20
H20
H20 = 200 µl d'eau stérile pour limiter l’évaporation ("l'effet de bord")
10µM - 5µM - 2,5µM - 1,2µM - 0,6µM … = 100 µl de milieu de culture contenant le peptide LACK à
différentes concentrations
Pour cela, réaliser des dilutions sérielles au 1/2 de la solution de peptide LACK qui vous est donnée (20 µM dans
du milieu de culture):
- Remplir le puits "10 µM" avec 200 µl de la solution de peptide à 20 µM, et remplir les autres puits
(5 µM - 2,5 µM - …) avec 100 µl de milieu de culture seul
- Prélever 100 µl du puits "10 µM" et les mélanger au puits "5 µM"
- Prélever ensuite 100 µl du puits "5 µM" et les mélanger au puits "2,5 µM"
- etc. jusqu'au puits "0,6 µM"
Attention: Ne pas mettre de peptide dans le puits "0"
De cette manière on obtient 5 concentrations de peptide + un “blanc”: 20 - 10 - 5 - 2,5 - 1,2 - 0 µM,
respectivement dans les puits 10 - 5 - 2,5 - 1,2 - 0,6 – 0.
4. Déposer 100 µl de splénocytes (prélevés du tube "rate" à 107 cellules/ml 100 µl = 106 splénocytes) dans
chacun des puits contenant le peptide et dans le puits "0"
De cette manière on ajoute 106 cellules par puits et on dilue les concentrations de peptide au 1/2, soit: 10 - 5 -
2,5 - 1,2 - 0,6 - 0 µM dans un volume total de 200 µl
5. Incuber à 37°C
Passer à l'étape IV. Préparation des plaques ELISA
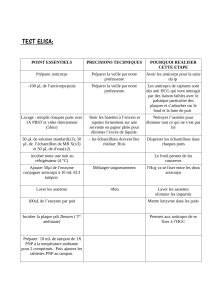
IV. Préparation de la plaque ELISA pour le dosage de l’IL-2 et des anticorps
La même plaque ELISA servira au dosage de l'IL-2 dans les surnageants de culture et des anticorps anti-LACK
du sérum des souris immunisées
1. Déposer 50 µl de la solution d'anticorps primaire (anti-IL-2) par puits sur la plaque ELISA
Déposer également 50 µl des solutions protéiques LACK et OVA sur la plaque
Respecter le plan suivant:
1
2
3
4
5
6
7
8
9
10
11
12
Utilisation:
A
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Standards
B
Ac I
Ac I
Ac I
Ac I
Ac I
Ac I
Surnageants
C
LACK
LACK
LACK
OVA
OVA
OVA
Sérum
2. Placer à 4°C

TP d’Immunologie 2009-2010
5
Jour 2
I. ELISA
A. Saturation
1. Laver 2 fois la plaque en [PBS-Tween]. Pour chaque lavage:
- remplir les puits avec du [PBS-Tween]
- vider les puits en secouant la plaque retournée au-dessus de l'évier
- taper la plaque retournée sur du papier absorbant
2. Remplir les puits avec 150 µl de [PBS – BSA]
3. Couvrir la plaque et incuber 30 minutes à température ambiante
Pendant l'incubation préparer les dilutions des gammes et échantillons
B. Préparation des standards et échantillons (dans une plaque 96 puits):
1. Gamme standard
Réaliser des dilutions sérielles au 1/2 de la solution d’IL-2 qui vous est donnée:
1
2
3
4
5
6
7
8
9
10
11
12
A
20
ng/ml
10
ng/ml
5
ng/ml
2,5
ng/ml
1,25
ng/ml
0,62
ng/ml
0,31
ng/ml
0,15
ng/ml
0,08
ng/ml
0, 04
ng/ml
0,02
ng/ml
0
B
C
- Remplir le puits A1 "20 ng/ml" avec 250 µl de la solution d’IL-2, et remplir les autres puits de la gamme
(A2-A12) avec 125 µl de [PBS – BSA]
- Prélever 125 µl du puits "20 ng/ml" et les mélanger au puits "10 ng/ml"
- Prélever ensuite 125 µl du puits "10 ng/ml " et les mélanger au puits "5 ng/ml "
- etc. jusqu'au puits "0,02 ng/ml"
Attention: ne rien ajouter dans le puits "0"
De cette manière on prépare une gamme de 11 concentrations d’IL-2 + un “blanc”
2. Surnageants de culture
- Prélever la totalité des surnageants de culture des splénocytes maintenus en présence de 0-10M de peptide
LACK depuis J1, en prenant soin de ne pas aspirer ou resuspendre les cellules qui sont déposées sur le fond
des puits. Transférer ces surnageants dans les puits B1-B6 de la plaque 96 puits , en dessous de la gamme
standard d’IL-2 (comme suit):
1
2
3
4
5
6
7
8
9
10
11
12
A
20
ng/ml
10
ng/ml
5
ng/ml
2,5
ng/ml
1,25
ng/ml
0,62
ng/ml
0,31
ng/ml
0,15
ng/ml
0,08
ng/ml
0, 04
ng/ml
0,02
ng/ml
0
B
sngt
LACK
10 µM
sngt
LACK
5 µM
sngt
LACK
2,5 µM
sngt
LACK
1,2 µM
sngt
LACK
0,6 µM
sngt
LACK
0
C
D
 6
6
 7
7
1
/
7
100%