LES PILES – LA CORROSION

T BEP date :
Ph. Georges Chimie 1/3
ions
e-
Zone
d'oxydation
Zone de
réduction
bleu
rose
LA CORROSION PAR EFFET DE PILE
La corrosion est l'action destructrice qu'exerce le milieu ambiant sur un métal. On estime que sur une
production mondiale annuelle de 800 tonnes, plusieurs dizaines de millions de tonnes sont transformées
en rouille. Plus de 5 % de la masse d'acier produite dans le monde disparaît chaque année.
Nous n'aborderons que la corrosion humide qui est la corrosion par des agents contenus dans les eaux,
les sols ou l'air humide, de loin la plus importante (la corrosion sèche concerne l'attaque des métaux
par des gaz en l'absence d'humidité présente surtout dans les installations industrielles). L'étude ne
portera que sur le fer.
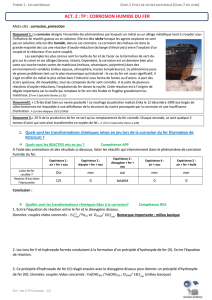
La corrosion électrochimique est une oxydation du métal. Les électrons libérés induisent
nécessairement une réduction, mais pas au même endroit : Il y a donc des zones d'oxydation et des
zones de réduction entre lesquelles circulent des ions et des électrons.
On a la structure d'une
pile.
Le phénomène de corrosion est dû à la formation de micropiles.
I- Expériences de corrosion du fer
Afin d'accélérer les phénomènes de corrosion, nous allons utiliser une solution de chlorure de sodium à
environ 0,5 mol.l-1. Nous ajoutons à cette solution :
- de la phtaléïne (réactif des bases) pour observer la formation d'ions hydroxyde OH–
(coloration rouge violacée) ;
- du ferricyanure de potassium (ou hexacyanoferrate III de potassium) qui donne naissance avec les
ions Fe2+ à une couleur bleue.
Pour éviter la diffusion trop rapide des couleurs, on gélifie la solution par addition d'agar-agar.
Au bout d'une heure environ, on constate l'apparition de zones colorées
en rose et d'autres en bleu.
Interprétation
Les zones bleues ont été le siège de l'oxydation du fer :
Fe Fe2+ + 2 e–.
Les zones roses indiquent la formation d'ions OH– :
Error!
O2 + H2O + 2 e– 2 OH–
Ces ions OH– sont formés par la réduction du dioxygène O2 dissous
dans l'eau (solubilité).
(couple O2 / OH–) :

Ph. Georges Chimie 2/3
+
cuivre
–
fer
eau
salée
I
e–
+
–
O2 , Fe
Anode
Fe
Cathode
Électrolyte :
solution de NaCl
Remarque: le phénomène de réduction est lent du fait de la faible solubilité (50 cm3/l ) du dioxygène
dans l'eau. Par conséquent, le processus de corrosion est lui-même lent.
Conclusion
Il s'est constitué une pile. La zone du clou où à lieu l'oxydation en est la cathode (pôle –) et
l'oxygène est réduit à 'anode (pôle +).
La micro pile est en court-circuit puisque
anode et cathode sont deux parties du
même clou.
Les zones anodiques et cathodiques constituent les électrodes de la pile dont l'électrolyte est la
solution de chlorure de sodium ; le circuit extérieur est le clou lui-même, donc un court-circuit.
La corrosion se produit aux endroits où la surface présente des irrégularités (pointe et tête du
clou), des rayures ou là où le métal a subit des contraintes.
Expérience : un clou est plongé dans un tube à essais contenant une solution saline et les
indicateurs colorés précédents. Le clou est oxydé à sa base, c'est-à-dire au fond du tube.
Ce résultat paraît paradoxal car le fer s'oxyde là où il y a le moins de dioxygène dissous
(le dioxygène de l'air diffuse dans la solution à partir de la surface).
Mais le dioxygène est réduit à la cathode qui est la partie supérieure du clou ;
le fer est donc oxydé plus bas.
Cela justifie le fait que la corrosion de la coque d'un navire soit plus importante à la quille qu'à
la ligne de flottaison : on appelle se phénomène l'effet Evans
II- Pile de corrosion fer / cuivre
Deux lames de fer et de cuivre en court-circuit plongent dans une solution
aqueuse de chlorure de sodium (eau salée).
Quelques gouttes de phénolphtaléïne et de ferricyanure de potassium permettent
de mettre en évidence le phénomène de corrosion.
Au bout de quelques minutes, on peut faire les observations suivantes :
Autour de l'électrode de fer, le ferricyanure de potassium prend une teinte bleue caractéristique de
la présence d'ions Fe2+. Borne – : Fe Fe2+ + 2 e–
Autour de l'électrode de cuivre, la phénolphtaléïne vire au rose ; le milieu est basique (excès
d'ions OH–). Borne + : O2 + 2 H2O + 4 e– 4 OH–
Le pôle – est du côté du métal le plus réducteur, le fer, qui s'oxyde en libérant des électrons. Le courant
circule du cuivre vers le fer dans le circuit extérieur.
Lors de la réalisation d'une "pile de corrosion", le métal le plus réducteur s'oxyde
et constitue l'électrode négative, la cathode.
rose
bleu

T BEP date :
Ph. Georges Chimie 3/3
bleu
rose
EXPÉRIENCES : CORROSION DU FER
Afin d'accélérer les phénomènes de corrosion, on utilise une solution de chlorure de sodium à environ
0,5 mol.l-1.
Pour mettre en évidence les produits de la réaction d'oxydoréduction, on ajoute à cette solution :
- de la phtaléïne, le réactif des bases, pour observer la formation d'ions hydroxyde OH–
et qui donne une couleur rose.
Error!
réduction du dioxygène O2 dissous dans l'eau (couple O2 / OH–) :
Error!
O2 + H2O + 2 e– 2 OH–
- du ferricyanure de potassium (ou hexacyanoferrate III de potassium) qui donne
naissance avec les ions Fe2+ à une couleur bleue.
Error!
oxydation du fer : Fe Fe2+ + 2 e–
Pour éviter la diffusion trop rapide des couleurs, on gélifie la solution par addition d'agar-agar.
Dissoudre dans 100 ml d'eau :
3 g de NaCl, 1 g de ferricyanure de potassium
2 g d'agar-agar
10 gouttes de phtaléïne à 3 g/l.
On chauffe cette solution en l'agitant et on la verse, dans une boite de Pétri ou un tube à essais, sur
le clou avant prise en masse.
Autre source :
Préparer un gel en dispersant
2 g d'agar-agar en poudre dans 200 ml d'eau à ébullition.
environ 1 g de NaCl
une dizaine de gouttes de solution de ferricyanure de potassium à 30 g/l
une dizaine de gouttes d'une solution alcoolique de phénolphtaléïne à 10 g/l.
Au bout d'une heure environ, on constate l'apparition de zones colorées en rose et d'autres en bleu.
bleu
rose
1
/
3
100%