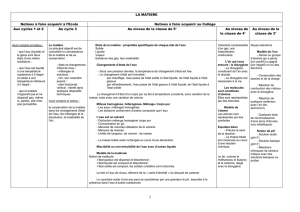
Manip_corrosion différentielle

Expérience*1:**
!
On!prépare!à!chaud!un!mélange!d'eau!salée,!de!solution!aqueuse!d'hexacyanoferrate!III!de!potassium,!
de!phénolphtaléïne!et!d’agar>agar!(gélifiant).!Ce!mélange!est!versé!dans!une!boîte!de!Pétri!;!on!laisse!!
refroidir!:!le!gel!fige.!!
!
!
!
!
!
!
!
!
!"#$%&'$()*+,&-.%$(/(
0!il#faut#utiliser#de#préférence#des#clous#neufs#;#(
0!pour%le%clou%tordu,%il%est%bon%de%le%tordre%plusieurs%fois%au%même%endroit%;%(
0!il#faut#préparer#cette#expérience#plusieurs#jours#avant#si#on#veut#avoir#les(
résultats(dans(l’heure(;((
0(l’expérience+est+présentable+pendant+plusieurs+jours+car+la+diffusion+dans+le+gel+est+relativement+lente+;(
!
!
Résultats*:*
!
>!clou!et!clou!plié!
!
!
!
!
!
!
!
!
!
!
!
Sur$une$pièce$de$fer,$les$zones$d’écrouissage$important$se$comportent$en$pôle$–!avec!oxydation!du#fer#
à"l’état"de"fer(II)"(coloration"bleue)".Les"autres"zones"agissent"en"pôle"+"avec"réduction"de"l’eau"et"du"
dioxygène*dissous*et*apparition*d’un*milieu*basique(*coloration*rose)!
Il#en#est#de#même#au#cours#du#phénomène#d’aération#différentielle#(lorsque#le#fer#est#dans#un#milieu#
où#existe#un#gradient#de#concentration#en#dioxygène)#:#la#corrosion#se#produit#dans#les#zones#les#
moins&oxygénées.!
!
!
!
!
!
!
!
!
(
12+3,&4(,%$,(
56$%*7+,&"#$(
12$.',+,(8.(,%$,(
Ion!fer!II:!Fe2+(aq)!
Ion!hexacyanoferrate!(III)!
[Fe(CN)6]!3>!
Coloration!bleue!
Mise!en!évidence!des!ions!Fe2+(aq)!
Ion!zinc!ll!:!Zn2+(aq)!
Ion!hexacyanoferrate!(III)!
[Fe(CN)6]!3>!
Précipité!blanc!
Mise!en!évidence!des!ions!Zn2+(aq)!
Ion!hydroxyde!:!HO!–(aq)!
Phénolphtaléïne!
Coloration!rose!
Mise!en!évidence!des!ions!HO!–(aq)!
!'".(%#(4%*(9:%9$;;((
mélange!!
!'".(%#(4%*(9:%9$;;((
mélange!!

Expérience*2*:!Clous!recouverts!de!différents!métaux!
!
!
<>!!clou!recouvert!avec!du!zinc!
!
!
!
!
!
!
!
!
!
!
!
> clous!en!fer!recouverts!partiellement!de!métal!
d’une!autre!nature!
!
!
!
!
!
!
!
Le#fer#est#attaqué#lorsqu’il#est#associé#à#un#métal#moins#réducteur#que#lui#comme#le#cuivre#;#par#
contre,(il(est(protégé(par(le(zinc(et(le(magnésium(qui(sont(des(métaux#plus#réducteurs.!
Ainsi,&les&clous&ne&sont&oxydés&que&s’ils&sont&plus&réducteurs&que&le&métal&avec&lequel&ils&constituent&la&
micro>pile!de!corrosion.!
!
Les$participants$à$la$corrosion$d'un$métal$appartiennent$à$3$phases$:$!
1.#la#phase#métallique,!solide,(où(se(déplacent(les(électrons,(!
2.#la#phase#aqueuse,!où#se#déplacent#les#ions,#!
3.#la#phase#gazeuse,!qui!contient!l'oxydant.!
Le#système#électrochimique#ainsi#réalisé#constitue#une#micropile,#dans#laquelle#on#peut#parler:!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!

!
>!d'une#zone# anodique,"où!a"lieu"l'oxydation"du"métal,!
>!d'une#zone#cathodique,"où"se"pro>!duit%la%réduction%du%dioxygène,!
>!d'une&circulation&des&électrons!dans%le%conducteur%métallique,!
>!d'une#diffusion#des#ions#obtenus!dans!la!solution,!avec!conduction(électrolytique(eventuellement(
!"#$%&'()*(%!*)$*+)&'(+,)$'--*).'/!)0#)1'!-#%&'()2*)0#)!'/&00*3!
!
!
!
!
1
/
3
100%