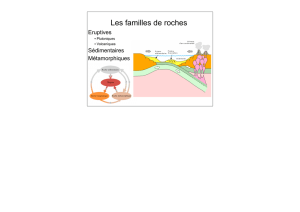
Haute température

# Les tétraèdres partagent leurs quatre sommets entre eux et
forment un réseau peu dense et ouvert
# Minéraux très polymérisés
# Cas de la silice:
Si aucun atome ne se substitue au Si : formule stoechiométrique
SiO2
La neutralité du minéral est respectée
# Si Al3+ se substitue à Si4+ des cations intersticiels sont nécessaires
pour compenser la charge
# Les grandes cavités disponibles (arrangement des tétraèdres)
Permettent l’introduction de gros cations (K+, Ca2+…)
Les tectosilicates: Connexion 3D des tétraèdres

# Les minéraux basés sur un réseau alumino-silicaté sont les plus
abondants pour la croûte terrestre
# Les feldspaths représentent 65% en volume
# Réponse structurale aux changements de composition, température et
pression
# A haute température, structure très ouverte avec des enchainements
tétraédriques très symétriques

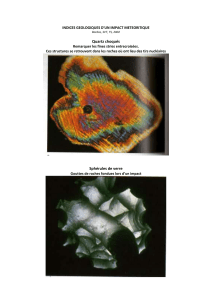
La silice
Formes contrastées:
cristaux formés dans
des filons
hydrothermaux
Tous les tétraèdres
sont polymérisés
formule = SiO2.

cristaux de quartz en remplissage des derniers
vides persistant lors du
refroidissement du granite

Les polymorphes de la silice
Différentes formes sur Terre
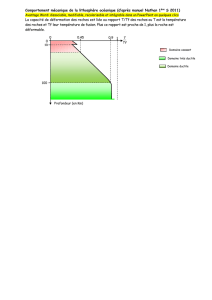
I) Domaines de stabilité en température
Le quartz est le plus commun des polymorphes
Il est stable jusqu’à 857°C avec deux polymorphes de
basse température (alpha - 573°C- beta)
Vient ensuite la forme tridymite stable entre 857°C
Et 1470°C
La forme de haute température est la cristobalite
stable entre 1470°C et 1713°C le point de fusion
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%