Labo-4 - Chimie générale

1
Éléments de biochimie
210-120-AH (hiver 2012)
Laboratoire 41
Propriétés des glucides
Buts :
Caractériser des glucides par des tests d’identification chimiques
Vérifier l’hydrolyse acide et enzymatique de certains glucides
Théorie :
Les glucides forment le groupe de composés organiques le plus abondant dans la biosphère.
Tout organisme capable de photosynthèse (algues, plantes...) peut en produire des quantités
parfois considérables à partir du CO2 atmosphérique et de l’énergie solaire. Source
d’énergie pour les organismes vivants, sous forme immédiatement utilisable (glucose) ou
sous forme de réserve (amidon, glycogène), les glucides jouent aussi un rôle structural
important chez les plantes et les animaux (cellulose, chitine).
Du point de vue chimique, on peut définir les glucides comme étant des
polyhydroxyaldéhydes (aldoses) ou des polyhydroxycétones (cétoses). La chimie des
glucides porte donc essentiellement sur l’étude de la réactivité des fonctions hydroxyles et
carbonyles qui, coexistant dans une même molécule, conféreront à ces composés des
propriétés particulières qu’il sera utile de connaître en vue de leur isolement, leur dosage et
leur identification structurale. Voici un survol des classes de glucides, des réactions
chimiques caractéristiques et une description des tests utilisés dans cette expérience.
1-Classification des glucides
Selon qu’il s’agisse d’une fonction aldéhyde ou cétone, les glucides sont répartis en aldoses
et cétoses. Pour chaque famille, on peut retrouver des sucres à 3, 4, 5 ou 6 carbones (7 et 8
carbones existent mais plus rares). Ces dernières catégories sont nommées trioses, tétrose,
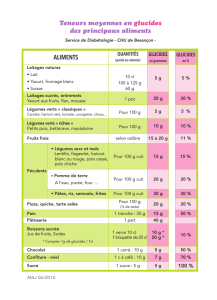
pentoses et hexoses. Le tableau de la page suivante montre des exemples de glucides pour
les catégories utilisées dans de ce laboratoire.
Une unité glucidique seule porte le nom de monosaccharide. Deux monosaccharides
peuvent être condensés en une seule molécule appelée disaccharide. La nouvelle liaison
formée porte le nom de lien glycosidique. Comme c’est le cas pour un lien peptidique, la
formation d’un lien glycosidique entraîne la production d’une molécule d’eau :
Monosaccharide + Monosaccharide Disaccharide + H2O
Bien que souvent représentés sous une forme linéaire en projections de Fischer, les
glucides adoptent en réalité une forme cyclique (voir page suivante). Cette forme cyclique,
majoritaire, est en équilibre avec la forme ouverte.

2
Aldoses
Cétoses
Pentoses
Hexoses

3
2-Réactions chimiques
2.1-Formation d’acétals
En milieu acide, la fonction carbonyle se combine aux alcools pour donner des acétals :
R-OH
O
H
HO
H
HO
H
HO
OH
HH
OH
O
H
HO
H
HO
H
RO
OH
HH
OH
+ H2O
configuration
Cette réaction s’effectue aussi bien avec les aldoses qu’avec les cétoses. Les dérivés
formés seront de type et selon la configuration de l’anomère qui a réagi.
2.2-Oxydation
La fonction aldéhydique ou cétonique des glucides est susceptible d’être oxydée. Dans le
cas des cétoses, la réaction passe par une isomérisation du cétose en aldose avant de subir
l’oxydation. Aldoses et cétoses vont donc se comporter comme des réducteurs. Certains
oxydants agissent sélectivement sur l’une ou l’autre des extrémités (C1 ou C6), d’autres
oxydent seulement les aldoses. Pour sa part, l’acide nitrique est assez puissant pour oxyder
les deux extrémités :
CHO
OHH
HHO
OHH
OHH
CH2OH
CHO
OHH
HHO
OHH
OHH
COOH COOH
OHH
HHO
OHH
OHH
CH2OH
COOH
OHH
HHO
OHH
OHH
COOH
HNO3
O2/Pt
I2/H2O

4
2.3-Réduction
Un réducteur assez puissant tel que le sodium peut réduire un hexose en hexa-alcool.
Ainsi, on obtient le sorbitol utilisé dans l’industrie alimentaire comme précurseur de
synthèse de la vitamine C par la réduction du glucose ou du fructose :
CH2OH
OHH
HHO
OHH
OHH
CH2OH
CHO
OHH
HHO
OHH
OHH
CH2OH
CH2OH
C O
HHO
OHH
OHH
CH2OH
D-Glucose Sorbitol (D-Glucitol) D-Fructose
2H 2H
2.4-Action des acides forts
Un acide concentré et à chaud provoque le départ de plusieurs molécules d’eau à partir des
aldoses et des cétoses en formant le furfural ou son dérivé selon qu’il s’agisse d’un pentose
ou d’un hexose. Le furfural ou son dérivé réagissent ensuite avec les phénols pour donner
des composés colorés utilisés dans plusieurs tests (cet item est décrit dans la section 3-Tests
d’identification).
2.5-Action des bases diluées
L’action d’une base diluée provoque des inter-conversions appelées épimérisations. Ainsi,
lorsqu’on traite en milieu alcalin l’un des 3 sucres suivants, on observe la formation des 2
autres; un équilibre s’installe entre les 3 formes :
CHO
OHH
HHO
OHH
OHH
CH2OH
CHO
HHO
HHO
OHH
OHH
CH2OH
CHOH
COH
HHO
OHH
OHH
CH2OH
CH2OH
C
HHO
OHH
OHH
CH2OH
O
CHOH
COH
HHO
OHH
OHH
CH2OH
D-Glucose D-Fructose D-Mannose

5
2.6-Formation d’éthers
Les fonctions alcools des glucides forment des éthers avec d’autres alcools en présence
d’un catalyseur :
H C OH + R-OH H C OR + H2O
De telles réactions sont utilisées en analyse instrumentale afin de faciliter la séparation ou
la détection des différents produits.
2.7-Formation d’esters
Ces mêmes fonctions alcools forment aussi des esters avec des acides :
H C OH + R-COOH H C OCOR + H2O
La formation d’ester a permis autrefois l’élucidation de la structure de plusieurs sucres. En
biochimie, on retrouve beaucoup d’esters phosphoriques (entre sucres et phosphate), ils
sont à la base des processus de transfert et d’entreposage de l’énergie chimique.
3-Tests d’identification chimique utilisés lors de ce laboratoire
3.1-Test de Molisch
L’essai de Molisch est utilisé depuis longtemps comme test général d’identification qu’une
substance est de nature glucidique. Tous les glucides libres ou liés qui ont une structure
supérieure aux tétroses, peuvent être transformés, en présence d’un acide fort, en furfural
(pentoses) ou en hydroxyméthylfurfural (hexose). Ce dernier se condense à son tour avec
le 1-naphtol pour produire des composés colorés sulfoniques (voir schéma page suivante).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%