1L/ES Nourrir l`humanité Activité/Cours : Espèces tensioactives

1L/ES Nourrir l’humanité
Activité/Cours : Espèces tensioactives
Objectif : Comprendre le rôle d’une espèce tensioactive dans la formation d’une émulsion stable.
I. Qu’est-ce qu’une émulsion ?
1. Expériences :
Dans un tube à essais, verser un peu d’eau et un peu d’huile.
Fermer le tube à essais à l’aide d’un bouchon, et agiter fort.
Poser le tube dans son support, et observer ce qui se passe juste après l’agitation
Schématiser l’expérience ci-dessous.
Laisser reposer le mélange deux minutes, observer.
Schématiser.
Refaire la même expérience avec de l’eau et de l’éthanol, observer.
Schématiser.
Définition d’une émulsion :
2. Structure des molécules de l’eau, d’l’huile et de l’éthanol, pour comprendre.
Les molécules d’eau de formule H2O restent globalement neutres électriquement, mais elles possèdent un côté
chargé plutôt négativement (C’est l’atome d’oxygène O), et un autre chargé plutôt positivement (Les deux atomes
d’hydrogène H). On dit que la molécule d’eau est polaire.
Les molécules d’eau, par attirance électrique de leurs pôles positive et négative (H attiré par O et réciproquement),
forment des liaisons appelées liaisons hydrogène (Voir schématisation ci-dessous).
1L/ES 1/3
- 2δ
+δ
+δ
Liaison hydrogène

L’huile est constituée de lipides, macromolécules composées de très longues chaînes de carbone C et d’hydrogène H
(Voir représentation ci-dessous). Ces lipides possèdent ne possèdent pas de groupe - OH susceptibles de former des
liaisons hydrogène avec les molécules d’eau. Cela explique que l’eau et l’huile ne se mélangent pas.
On dit que l’huile est formée d’entité chimique hydrophobe.
Structure de l’oléine, lipide de l’huile d’olive
L’éthanol est constitué de molécules qui possèdent un groupe - OH susceptible de former des liaisons hydrogène avec
les molécules d’eau (Voir représentation ci-dessous). Cela explique que l’eau et l’éthanol se mélangent parfaitement.
On dit que l’éthanol est formé d’entité chimique hydrophile.
Structure de la molécule d’éthanol
II. Espèce tensioactive.
Si on ajoute, dans un mélange d’eau et d’huile, un émulsifiant comme la lécithine du jaune d’œuf (E322) ou la moutarde,
la mayonnaise prend : l’huile et l’eau forment une émulsion stable. En effet, la lécithine est un composé tensioactif,
c’est-à-dire une molécule qui possède deux parties (Voir représentation ci-dessous) : une partie hydrophile ou <<tête>>
ionique qui permet de former des liaisons hydrogène avec les molécules d’eau, et une partie hydrophobe ou <<queue>>
composée d’une longue chaîne carbonée non chargée qui a des affinités avec les lipides (Lipophile : qui aime les lipides).
Les molécules tensioactives servent de lien entre les molécules d’eau par sa partie hydrophile (Tête) et les molécules
d’huile par sa partie hydrophobe ou lipophile (Queue). Ces molécules entourent les gouttelettes d’eau (Voir représentation
ci-dessous) formant ainsi une micelle.
Les différentes micelles formées sont ensuite dispersées et se repoussent car elles ont la même charge électrique
(plus le milieu est acide plus les micelles se repoussent). Le fouettage de l’émulsion favorise la formation de micelles de plus
en plus petite, donc l’obtention d’une mayonnaise plus ferme.
1L/ES 2/3
CH
(CH2)7
(CH2)7
(CH2)7
C8H17
CH
CH
CH
CH
CH
CH2
O
CH
O
CH2
O
O
C
O
C
O
C
C8H17
C8H17
CH3
CH2
OH
Tête hydrophile qui se
dissout bien dans l’eau
Queue hydrophobe
ou lipophile
Structure simplifiée d’une molécule tensioactive
Eau
Gouttelettes d’huile
Molécule tensioactive
tetensioactive
Micelle

Les composés tensioactifs peuvent donc se lier simultanément à l’eau par leur tête hydrophile <<qui aime l’eau >> et à l’huile
par leur queue hydrophobe << qui fuit l’eau >> ou lipophile << qui aime l’huile >>, soudant ainsi l’eau l’huile.
Ils se disposent à l’interface entre gouttelettes et liquide environnant et empêchent les deux phases de se séparer.
Dans le cas d’une émulsion huile/eau (H/E) chaque gouttelette
d’huile est entourée par les composés tensioactifs disposant
leur queue dans l’huile et leur tête dans l’eau, on parle de
micelle directe.
Dans le cas d’une émulsion eau/huile (E/H) chaque gouttelette
d’eau est entourée par les composés tensioactifs disposant
leur queue dans l’huile et leur tête dans l’eau, on parle de
micelle indirecte.
III. Les émulsions en cuisine
1. Les émulsions liquide/liquide :
Les sauces sont caractérisées par des gouttelettes d’huile en suspension dans une phase aqueuse, on parle
d’émulsion huile dans l’eau (H/E).
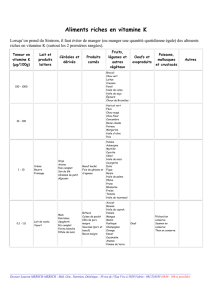
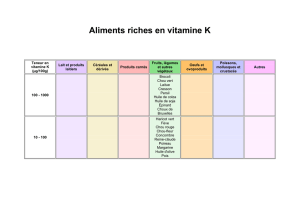
La vinaigrette est une émulsion huile/vinaigre. Les deux phases ont tendance à se séparer dès la fin de
l’agitation : c’est donc une émulsion instable.
La mayonnaise est une émulsion huile/eau de l’œuf : c’est une émulsion stable.
Le beurre est une émulsion eau dans l’huile (E/H), caractérisée par des gouttelettes d’eau en suspension dans une
phase lipidique.
2. Les émulsions liquide/gaz :
Ce sont les mousses, la crème Chantilly … dans lesquelles la phase liquide est en partie lipidique.
IV. Les espèces tensioactives dans la cuisine
On les appelle émulsifiants. Ce sont le plus souvent des lécithines, lipides présents naturellement dans le jaune d’œuf
Et le soja dont on les extrait, ou bien des émulsifiants synthétiques tels des composés d’acides gras ou lipides modifiés.
On les repère sur les emballages par les codes E322 à E495.
Exemple de la mayonnaise :
La phase lipidique est l’huile, la phase aqueuse est constituée par l’eau contenue dans le jaune d’œuf (50%), la moutarde et
le vinaigre, et l’émulsifiant est la lécithine du jaune d’œuf.
Lorsqu’on agite le mélange, les molécules de lécithine enrobent les gouttelettes d’huile en mettant leurs queues
hydrophobes dans l’huile et se lient à l’eau par leurs têtes hydrophiles, ceci dispersent les gouttelettes d’huile dans l’eau.
Les têtes étant chargées électriquement, se repoussent empêchant le retour aux deux phases séparées.
De ce fait la mayonnaise est une émulsion stable de l’huile dans l’eau.
La réussite d’une bonne mayonnaise dépend des proportions entre phases aqueuse et lipidique, ainsi que la présence de
molécules tensioactives stabilisant l’ensemble.
1L/ES 3/3
Eau
Gouttelettes d’huile
Micelle directe
Micelle indirecte
Huile
Gouttelettes d’eau
1
/
3
100%