ECBU

Infections urinaires
PRINCIPALES BACTERIES RESPONSABLES D’INFECTIONS URINAIRES
En ville :
E. coli
75 %
A l’hopital
Levures sont svt infections nosocomiales sur sonde
PHYSIOPATHOLOGIE : infection ascendante+++. Rarement infection hematogene.
SIGNES CLINIQUES
* cystite simple :
* pyelonéphrite : fièvre + douleurs lombaires. Signes urinaires inconstants.
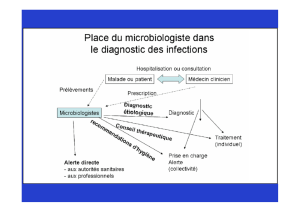
EXAMEN : ECBU
ITU définie par : leucocytes > 104/mL
germes > 104 – 105/mL
Leuco / mL
Bact / mL
N
< 104
< 104
ITU
> 104
> 104 monobact
Décapitée
Tuberculose
Prostatite, urétrite
> 104
< 104
ITU débutante
Pyélonéphrite
Terrain particulier (diabète, ID…)
Contamination
< 104
> 104
La présence de cellules épithéliales traduit une contamination vaginale (ac B+ etc …).
Patient diabétique
: nombre de leuco pê normal
Prostatite
: (y penser si homme âgé, urgences …) : leuco <, germes peu nombreux (103/mL poss)
Patient sondé
: poss ITU avec germes peu nombreux (évacuation continue) : 104 voire 103 /mL.
Patient sondé avec levures sur ECBU
: poss simple colonisation de la sonde sans ITU.
Femme enceinte
: ITU asymptomatique possible. A détecter régulièrement (bandelette)
TRAITEMENTS
Cystite simple non compliquée (chez la femme uniquement) : tt probabiliste « minute »
MONURIL®
fosfomycine
(sauf sur
S. saprophyticus
,
Enterococcus
…)
BACTRIM FORTE®
cotrimoxazole
UNIFLOX®
ciprofloxacine
; MONOFLOCET®
ofloxacine
; PEFLACINE-MONODOSE®
pefloxacine
Cystite récidivante* ou cystite compliquée (femme enceinte, diabétique, état général…) : ECBU !
Clamoxyl® Augmentin®
C3G orale :
FQ
Cystite de la femme enceinte : péniA, C3G orale, acide pipémidique, nitrofurandoine : 3j ou 10j
Antibioprophylaxie cystite récidivante (femme agée, fille < 2 ans) : BACTRIM® 6 mois + contrôle

Pyélonéphrite non compliquée : monothérapie 15-21
C3G parentérale :
FQ (relais possible PO)
Pyélonéphrite compliquée : bithérapie avec aminoside: C3G, FG,
A l’hopital
Abstention thérapeutique
- patiente âgée asymptomatique (tt si confusion, rétention urinaire …)
- patient sondé asymptomatique
Cystite récidivante : par définition 4 ou + cystite / an.
ECBU et ABg nécessaires
Cystite compliquée :

ECBU
Prélèvement
: desinfection méat urinaire, rejet premier jet, urines du matin ++,
Examen direct
:
Etat frais : numération leucocytes, hématies,
présence de cellules épithéliales, de cylindres
présence de germes : bactéries, levures
Gram : caractéristiques des germes présents (si > 10 leuco/µL)
NB : la présence de ¢ épithéliales en grand nombre et d’une flore polymorphe est caractéristique
d’un mauvais prélèvement (ex : Doderlain + cell = conta vaginale du plvmt).
Ensemencement
1 µL (anse calibrée)
milieu chromogène Uriselect (bien pour urine trouble. Colorations parfois trompeuses)
milieu CLED : toutes les bact responsables d’ITU sont susceptibles d’y pousser)
candiselect si levures à l’examen direct.
VCA3-sg cuit si gonocoques à l’examen direct
Numération :
1 colo = 1.103 bact/mL
Identification
Sur milieu Uriselect :
Colonies roses :
E. coli
faire un test de l’indole. Si - gallerie API.
Colonies bleu outremer : entérocoques cf. identification entérocoques
Colonies bleu-violet : groupe KES (
Klebsiella
,
Enterobacter
,
Serratia
) gallerie API
Sur milieu CLED :
Les colonies lactose + (
E. coli
, …) sont jaunes gallerie nécessaire
Identification à poursuivre selon aspect colonies, gram etc …
Sur milieu Candiselect :
Colonies roses : C. albicans faire test de filamentation (4h confirme C.albicans)
Autres : gallerie AUXACOLOR


Diarrhées infectieuses
PVD : risque fécal
PI : virus ++ et TIAC
Flore colique
Flore commensale
Anaérobies strictes +++ : Bacteroïdes, Bifidobacterium, Clostridium ..
Aéro-anérobies facultatives :
* entérobactéries : E. coli, Klebsiella, Enterobacter
* entérocoques
Flore de passage
S. aureus
P. aeruginosa
Proteus
Levures
Syndromes diarrhéiques
sd dysentérique : Shigella, EIEC
lésions de la muqueuse colique : selles sanglantes, purulentes, glaireuses
douleurs intenses (epreintes, tenesmes)
fièvre
gastro-entérite fébrile : Salmonella mineures ; Yersinia, Campylobacter, Clostridium ..
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%